Xavier Piqué y col.: Miguel Claver; Lorena Pérez; Pedro José Sánchez
Swine Technical Consultant
Elanco
Etiología
La Disentería Porcina es una colitis infecciosa muco-hemorrágica provocada por la bacteria Brachyspira hyodysenteriae en los cerdos, clínicamente se caracteriza por pérdidas productivas y un proceso diarreico característico con cantidades variables de moco, sangre y material necrótico en las heces. Afecta principalmente a los cerdos en la fase de cebo, aunque se ha descrito que la enfermedad puede presentarse en todas las etapas productivas.
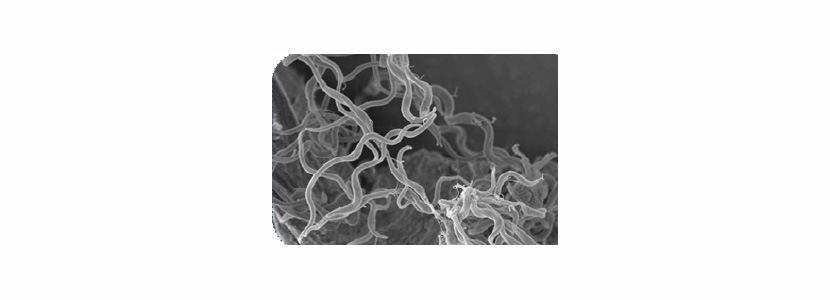
Brachyspira hyodysenteriae es una bacteria muy alargada (6-9 microm.) que crece en colonias diminutas y que es intensamente b-hemolítica, apenas metaboliza los azúcares, Gram-negativa y anaerobia. Tiene movimiento propio gracias a dos flagelos periplásmicos que le confieren una gran capacidad invasiva.
Patogénesis
La infección se produce por vía fecal-oral. El principal riesgo de introducción de la infección lo constituyen los cerdos infectados a nivel subclínico, los camiones de cerdos infectados, las botas contaminadas que llevan los visitantes y los portadores mecánicos de Brachyspira hyodysenteriae: ratas, ratones (Fellström et al., 2004), pájaros e insectos como las moscas y las cucarachas (McOrist et al., 2009).
Después de producirse la infección, Brachyspira hyodysenteriae coloniza el intestino grueso en 2 – 4 días, se multiplica en las criptas, invade las células caliciformes y las células epiteliales y las daña o las rompe.
En el plazo de 5 – 7 días de infección se desarrolla colitis, la mucosa se congestiona y el contenido del colon se puede volver hemorrágico. Se produce una hiperplasia de las células caliciformes y un exceso de producción de moco que da lugar a heces diarreicas que contienen moco y sangre. En ocasiones por una presión de infección baja en la explotación o por algunas cepas de Brachyspira hyodysenteriae que parecen tener un bajo potencial de virulencia, la enfermedad se manifiesta de forma subclínica con patología muy leves.
Síntomas Clínicos
Los primeros síntomas incluyen temblores de cola, dolor abdominal, hundimiento de los flancos, ligero enrojecimiento de la piel y algo de inapetencia (Taylor D., 1999). El primer síntoma realmente visible es la diarrea, que comienza a los 5 – 7 días de la infección, se puede observar sangre fresca en las heces y el exceso de moco es una característica desde 10 días después de la infección.
La enfermedad clínica dura 10-14 días Los cerdos afectados muestran síntomas que van desde una diarrea moderada hasta enfermedad grave y la muerte.
Los cerdos con diarrea hemorrágica se muestran flacos, débiles, se vuelven anoréxicos y con letargo grave. Se pueden dar altas tasas de mortalidad en los brotes graves (Thomsom J., 2002).
Se puede hacer un diagnóstico provisional teniendo en cuenta los síntomas clínicos (sangre, moco y exudado mucofibrinoso), historia, patología macroscópica y examen microscópico de preparaciones de mucosa de colon para detectar espiroquetas grandes.
La confirmación del diagnóstico requiere un examen histopatológico y la detección específica del agente mediante cultivo o por la prueba específica de reacción en cadena de la polimerasa (PCR) para este agente.
No hay pruebas serológicas fiables para la infección por Brachyspira hyodysenteriae. Es importante conocer que hasta la fecha se han descrito 6 especies de Brachyspiras (B.) en el colon del cerdo: B. hyodysenteriae (agente causal de la Disentería Porcina), B. pilosicoli (causa de la Espiroquetosis Intestinal Porcina), B. innocens, B. intermedia, B. murdochii y B. suanatina (estas últimas con poca o ninguna capacidad patológica). (Hampson & Trott 1999), (Jensen et al., 2010), (Fellström et al., 1995), (Jansson et al., 2004)
Prevalencia y pérdidas económicas
Tenemos muy poca información referente a la prevalencia de la enfermedad en los diferentes países, últimamente se han publicado estudios realizados en Polonia (Dors A et Al. 2015) que dan un 1,4% de granjas positivas a B. hyodysenteriae del total de granjas analizadas, con un 75% de positivos a B. hyodysenteriae entre las granjas con patología diarreica.
Existen varios estudios que relacionan la Disentería Porcina y otras colitis con las pérdidas económicas por animal, con resultados de aumentos del Índice de Conversión (IC) de 0,2 a 0,8 puntos (Fourchon et al., 2000), disminución de la Ganancia Media Diaria (GMD) que provocan un retraso de hasta 35 días de llevar el cerdo a matadero y un aumento del número de animales desiguales y que no alcanzan el peso óptimo de salida (Thomson J., 1999).
Sin embargo uno de los trabajos más realista e ilustrativo que conozco, es la simulación de costes realizada por SIP consultors en el año 2006, en el que después de comparar cerdos sanos con cerdos afectados de disentería porcina determina variaciones del 7% en GMD, 5% en IC, 60% en coste de la medicación y un 25% en mortalidad. En conclusión, la pérdida económica estimada en un cerdo de cebo con disentería porcina es de 8 a 15 € por cerdo, siendo en consecuencia una de las enfermedades más caras que tenemos en la producción porcina (Font J., 2006).
Control de la Disentería Porcina
Es por todos estos argumentos que es necesario mantener bajo control la disentería porcina y para ello podemos (Szancer et al., 2013):
- Aplicar mejoras de manejo y medidas complementarias como disminuir contacto con heces, control de portadores, reducir estrés, todo dentro todo fuera estricto, autovacunas, mejoras en la alimentación (granulometría, digestibilidad, fibra…).
- Tratamiento y prevención con antibióticos registrados para ello y a las dosis recomendadas por etiqueta
- Eliminación del Brachyspira hyodysenteriae de la granja = Erradicación
Las principales razones para plantearse una erradicación de Disentería Porcina son: el incremento de productividad, mayores beneficios por cerdo, menor variación en el coste de producción, menos trabajo en granja, menor uso de antibióticos, menor riesgo de resistencias y un mayor bienestar de los animales.
Los principales métodos de eliminación de enfermedades según la experiencia danesa son tres:
- Total despoblación con repoblación posterior (típico de las granjas SPF)
- Diagnóstico y eliminación
- Despoblación parcial y medicación (Procedimiento para la eliminación de B. hyodysenteriae, Mycoplasma hyopneumoniae, Actinobacillus pleuropneumoniae y Sarcoptes scabiei suis)
Nuestra experiencia de varios años con temas de erradicación de enfermedades con especial atención a la erradicación de B. hyodysenteriae, nos ha llevado a utilizar la despoblación parcial con medicación en la mayoría de los casos. Este método se ajusta perfectamente a los modernos sistemas de producción en fases, permite conseguir eliminar un patógeno sin necesidad de parar la producción y mantiene nuestra actual genética en la granja (ver Fig.1).
Y los 12 puntos clave para una exitosa erradicación son:
En el día 0 (día en que se inicia el programa de medicación) solo debería estar en la granja los reproductores de más de 100 Kg de peso vivo (preferiblemente mayores de 10 meses de edad) y los lechones lactantes. Es decir sin reposición, sin transición y sin cebo.
No deberíamos tener sintomatología de Disentería Porcina en los animales reproductores, al menos en los dos últimos meses previos a la erradicación (en caso de tener síntomas, tenemos que implementar un tratamiento y cortar la sintomatología).
Este programa es para erradicar Brachyspira hyodysenteriae de animales portadores crónicos. Los animales con clínica reciente presentan lesiones necróticas a nivel intestinal donde puede permanecer la Brachyspira hyodysenteriae en anaerobiosis y no eliminarse a pesar de la medicación.
Antes de medicar debemos aislar B. hyodysenteriae de la granja, realizar un estudio de Concentración Mínima Inhibitoria (CMI) y comprobar cuál es el antibiótico de elección para la medicación (será aquel que tenga una mayor actividad inhibitoria, es decir menor CMI).
En la granja debe establecerse un programa general de control de ratones, pájaros e insectos lo más eficiente posible:
Revisión y mantenimiento de la malla pajarera de la granja, así como la revisión de las posibles vías de entrada de los pájaros, agujeros en tejados, paredes, puertas…
Programa efectivo de control de ratones y ratas, que son los principales reservorios de la disentería porcina: aplicación y revisión de raticidas eficaces, limpieza de basura, escombros y matorrales tanto dentro de la granja como en el exterior de las naves. Se recomienda el aplicar grava en el perímetro de las naves para entorpecer la entrada de ratones y ratas del exterior.
Control efectivo de las moscas en el interior de la granja, ya que también pueden ser portadoras de Disentería Porcina.
Deberíamos revisar y mejorar en lo posible el plan de bioseguridad de la granja: una sola entrada, con vestuarios y duchas separando la zona sucia y la limpia. Control del acceso de camiones, visitas. Vallado de la zona, pediluvios en las entradas. Eliminación de escombros y matorrales en el exterior de la granja…
Es necesario tener un protocolo de limpieza-desinfección-secado de los vehículos que vienen a la granja.
Los puntos de riesgo de la cabina del camión (pedales, alfombras…) deben desinfectarse mediante desinfectante en spray eficaz.
Todo el material orgánico (heces, orina, comida…) debe eliminarse. Prestar especial atención a los lugares de difícil acceso (esquinas, cierres, pestillos…)
Una vez limpio debe desinfectarse y debemos dejar un tiempo de secado.
Muelle de carga, ideal cuando el diseño de este permite que el camión cargue los animales sin entrar en el recinto de la granja.
Protocolos de entrada de personal
Ducha a la entrada
Uso de ropa y calzado limpio y específico de la granja (o incluso cambio entre secciones de una misma granja).
Lavado y desinfección frecuente de las manos
El uso de guantes disminuye la transmisión de patógenos
Utilizar pediluvios en las entradas de las naves, con desinfectante que se cambia como mínimo una vez al día.
Especial atención a las botas que nunca deben salir de la granja y se deben limpiar y desinfectar frecuentemente.
Se recomienda la instalación de un arco de desinfección con vado desinfectante para la entrada de vehículos a la explotación y de forma muy necesaria no debe permitirse el acceso a la granja de camiones con subproductos o cadáveres, se aconseja para ello que la vía de acceso a los contenedores de cadáveres sea distinta para el tractor que los lleva y el camión que los recoge.
Formación de empresarios y granjeros para que todos sean conscientes de los beneficios y la necesidad de unas buenas prácticas de bioseguridad.
Es muy importante cumplir con los protocolos de limpieza y desinfección de las zonas pobladas y las zonas vacías. Iniciándolo 14 días antes del día 0 de medicación.
Un ejemplo de protocolo sería:
- Limpieza y desinfección de las áreas vacías:
- Las fosas de purines deben ser vaciadas, limpiadas, desinfectadas y secadas: desinfección con glutaraldehido y secado de las fosas de purines con solución de hidróxido sódico “Ca(OH)2” (cal hidratada o cal de construcción).
- En las naves, limpieza de la materia orgánica, después desinfección con 1500 ppm de hipoclorito sódico (1,5%). Después de secarse, deben ser desinfectadas una segunda vez con glutaraldehido (comercial y siguiendo las dosis de etiqueta).
Aprovecharemos para revisar y reparar los desniveles de suelo o agujeros que provocan acumulaciones de suciedad. La puertas también se revisarán para que cierren de forma hermética, evitando el paso de vectores (roedores y pájaros principalmente).
Limpieza y desinfección de las áreas pobladas:
Desde 14 días antes del inicio de medicación (día 0), dos veces al día todos los corrales y boxes deben de ser limpiados (es muy importante quitar todos los excrementos y suciedad orgánica que puedan existir) y desinfectados con Hipoclorito sódico al 1,5%.
Las fosas deben ser vaciadas desinfectadas con glutaraldehido y encaladas de forma que en el día 0 (inicio de la medicación) todas las fosas hayan pasado por este proceso de limpieza y desinfección.
Animales enfermos o en mala condición corporal (ingesta reducida) deben de ser eliminados de la granja. Todos los animales que presenten una reducción de la ingesta de pienso, independientemente de la causa, deben ser tratados vía inyectable. El tratamiento debe aplicarse cada día con un máximo de 3 aplicaciones. Si el animal no recupera la ingesta debe sacarse de la granja.
Una vez finalizado el plan de erradicación, todas las cerdas de reposición deben venir de granjas libres de Disentería Porcina o de la propia explotación. Podemos establecer unos análisis de comprobación, analizando heces por PCR de las cerdas de reposición (que al menos lleven 7 días sin medicar).
Es necesario asegurar la no incorporación de peróxidos o productos que puedan oxigenar e inactivar los antibióticos, durante la fase de medicación. También es necesario conocer el pH y la calidad del agua a fin de ajustar las dosis de medicación para la erradicación.
Para evitar la sobremedicación de cerdas en lactación con alto consumo de pienso, estas deberían recibir un máximo de 4 Kg/cerda de pienso medicado, el resto se completará con pienso blanco o no medicado.
Todos los lechones lactantes de más de 3 días de vida deben ser tratados con antibiótico vía inyectable los días 2, 8, 14 y 21 del programa de medicación.
Todos los lechones nacidos después de los primeros 21 días de tratamiento (periodo de eliminación de B. hyodysenteriae de las cerdas) son considerados libres de Disentería porcina y pueden ser movidos a un sitio 2 de la misma granja, el cual habrá sido totalmente vaciado, limpiado, desinfectado y secado (habiendo estado un mínimo de 7 días vacío después del secado).
Una vez se ha finalizado el programa de erradicación de la Disentería Porcina, debemos instaurar un sistema de diagnóstico que nos garantice en la mayor medida posible una eliminación total de la B. hyodysenteriae.
En Dinamarca las granjas tienen que ser testadas por PCR, una vez por mes, durante 6 meses y al menos 20 animales de la granja según marcan las “Danish SPF guidelines” (Szancer et al., 2013).
REFERENCIAS
- 1. Taylor, D.J. (1999) Pig Diseases, 7th edition p157
- 2. Harris, D.L., Hampson, D.J., Glock, R.D. (1999) Swine Dysentery en Straw, B.E. Disease of Swine & Iowa State University Press p579.
- 3. Thomson J. (2001) Colitis, mixed infections and problema solving actions & Thomson J. (2002) Colitis: Disentería y Espiroquetosis colónica.
- 4. Carvajal A., Hidalgo A., Osorio J., Jaramillo H.A., Rubio P. (2012) Disentería Porcina: Tratamiento y Control. Rev Avances, volumen IX.
- 5. McOrist S., Blunt R., & Cheswoth M., (2009) The potential transmission of swine dysentery by cockroach vectors. International conference on colonic spirochaetal infections. León (Spain)
- 6. Fellström C., Landen A., Karlsson M., Gunnarson A., & Holmgren N., (2004) Mice as reservoir of Brachyspira hyodysenteriae in repeated outbreaks of swine dysentery in a Swedish fattening herd. Proceedings of 18th IPVS.
- 7. Hampson D.& Trott D. 1999 Spirochetal diarrhea. Diseases of Swine (Straw B., Taylor D.)
- 8. Jansson D.S., Johansson K.E., Olofsson T., Rasback T., Vagsholm I., Petterson B., Gummarsson A & Fellström C. 2004 Bhachyspira hyodysenteriae and other strongly B-haemolytic and indole-positive spirochaetes. Med. Microbiaol. 53:p293.
- 9. Font, J. Estudio SIP Consultors (2006). Cálculo de las pérdidas que provoca la Disentería Porcina, realizando una simulación en los datos de SIP Consultors.
- 10. Rubio, P. et Al. Estudio prevalencia B. hyodysenteriae, B. pilosicoli, L. intracellularis y S. enterica años 2001/2002
- 11. Dors A., Pomorska-Mól M., Czyżewska E., Wasyl D., Pejsak Z., Pol J. en Vet Sci. 2015; 18(4):825-31 Prevalence and risk factors for Lawsonia intracellularis, Brachyspira hyodysenteriae and Salmonella spp. in finishing pigs in Polish farrow-to-finish swine herds.
- 12. Philip V., (2007) Enfoque práctico para la eliminación de la disentería porcina en explotaciones de ciclo cerrado. Rev SUIS n.42
- 13. Figi, Goldinger, Fuschini, Hartnack, Sidler, Schweiz Arch Tierheilkd, 2014 Aug; 156(8):373-80. Eradication of swine dysentery as modified partial depopulation in a nucleus sow breeding farm.
- 14. Speiser SA, Zeeh F, Goy N, Albini S, Zimmermann W, Luginbühl A, Schweiz Arch Tierheilkd. 2011 Jan;153(1):14-8 Swine dysentery eradication in a grower-finisher farm in Switzerland.
- 15. Szancer J. (2013) Attempts to eradicate some respiratory and enteric pathogens in Danish pig farms. Technical conferences to swine vets in EU.
- 16. Pico L, Szancer J, Piqué J, Domeque A, Rodríguez-Sierra E, Vidal A. Swine Dysentery Eradication Program in large herds by strategic management and medication. Proceedings, International Pig Veterinary Society Congress (IPVS-2008)
ESSWIDEN00001