| En este artículo se expone un caso clínico que se presentó en una explotación de 900 cerdas reproductoras con manejo en bandas semanales. |
DATOS DE LA GRANJA




Se emplea el sistema de cubrir y soltar a los 3 días postcubrición.

Las nulíparas proceden de la multiplicadora propia de la empresa y son criadas en unas instalaciones que se encuentran fuera de la granja.


DESCRIPCIÓN DEL CASO CLÍNICO
Problemas en gestación
El caso clínico comenzó con un incremento de los abortos a término que podría hacernos sospechar de un brote de PRRS, como se refleja en la Gráfica 2. Pero estos abortos no se producían en forma de tormenta, sino que todas las semanas se encontraba un incremento notable, es decir, un aumento en escalera.
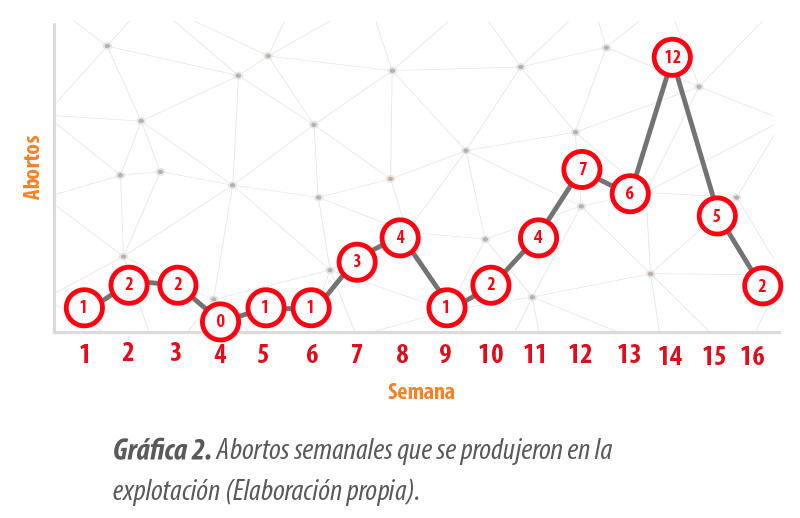
| Se comprobó que los abortos eran a término gracias al análisis del historial de la cerda abortada (días de gestación en el que se produjo el aborto) y la fertilidad. |
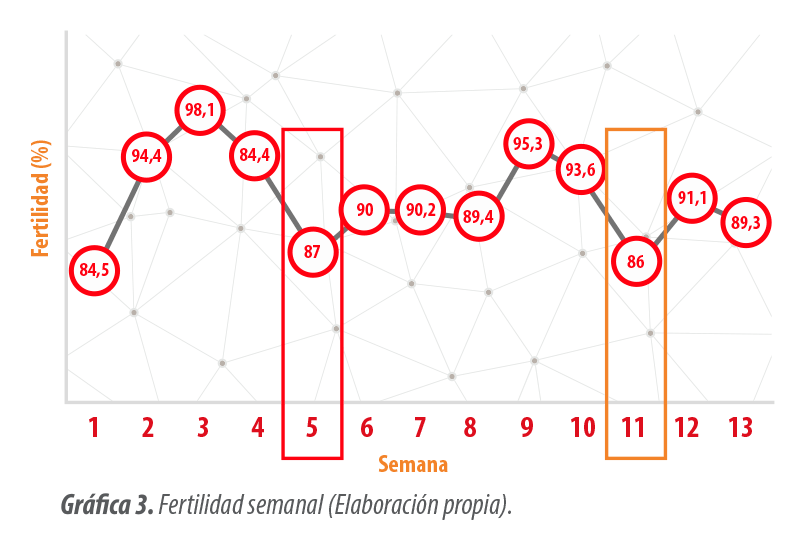
| En la Gráfica 3 (5a semana) se muestra el momento de la caída de la fertilidad cuyo motivo se desconocía, ya que en la granja no se había comenzado a observar ninguna clínica, y, por lo tanto, se atribuyó a un problema de manejo.
Revisando el protocolo de manejo, se apreciaron algunos fallos que se comenzaron a corregir para volver a alcanzar los valores propios de la explotación. A pesar de ir mejorando, de nuevo se observó un descenso importante en la semana 11. |
Estos valores pueden ser debidos a dos causas.
|
Problemas en maternidad
En la maternidad, se observó un incremento de lechones nacidos muertos por parto, aunque lo que era verdaderamente preocupante era la pérdida de la vitalidad de los lechones que nacían vivos.

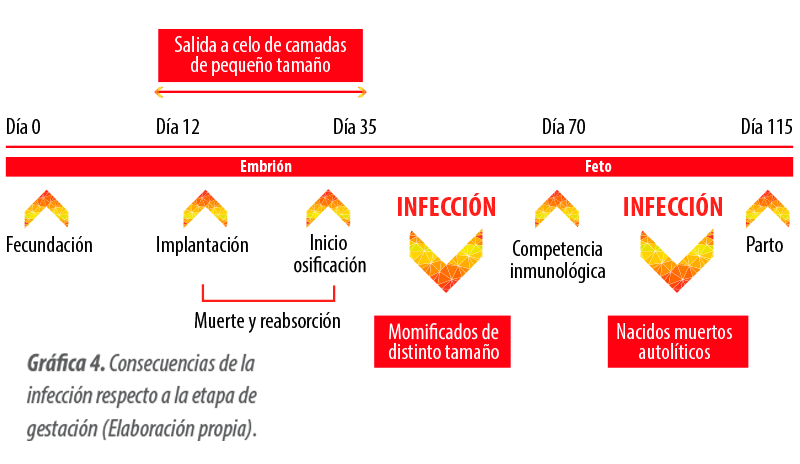
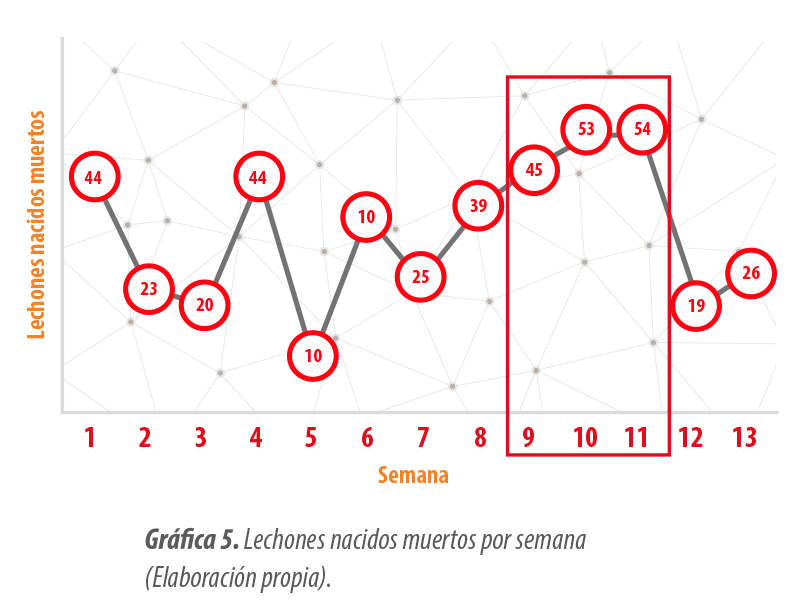
Tal y como se muestra en la Gráfica 5, los nacidos muertos por semana aumentaban en las semanas 9, 10 y 11 y posteriormente volvían a los niveles normales de la explotación.
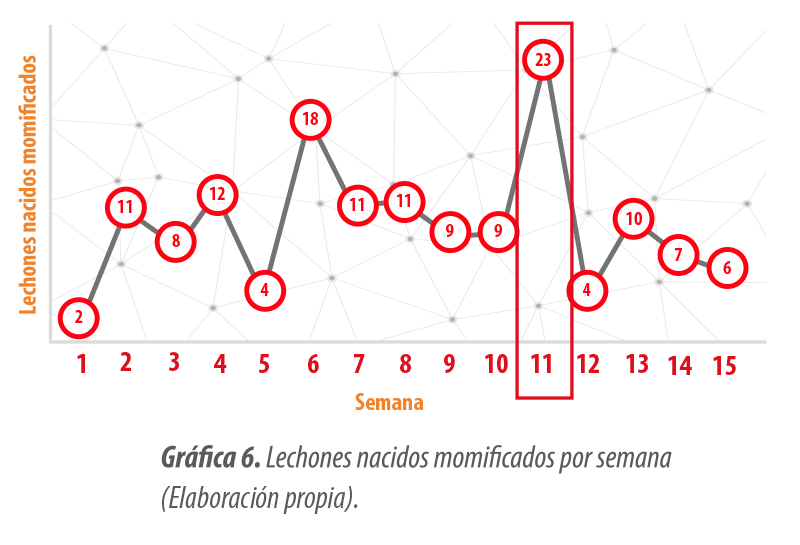
Con respecto a los lechones momificados, aunque en la Gráfica 6 se observa un incremento importante en la semana 11, no hubo una tendencia clara con respecto a este parámetro.
MUESTREO Y DIAGNÓSTICO LABORATORIAL
La granja cuenta con un programa de monitorización que consiste en la recogida semanal de trozos de lenguas de los lechones nacidos muertos, diferenciado siempre las lenguas que proceden de cerdas primíparas de las procedentes de lechones de cerdas multíparas.

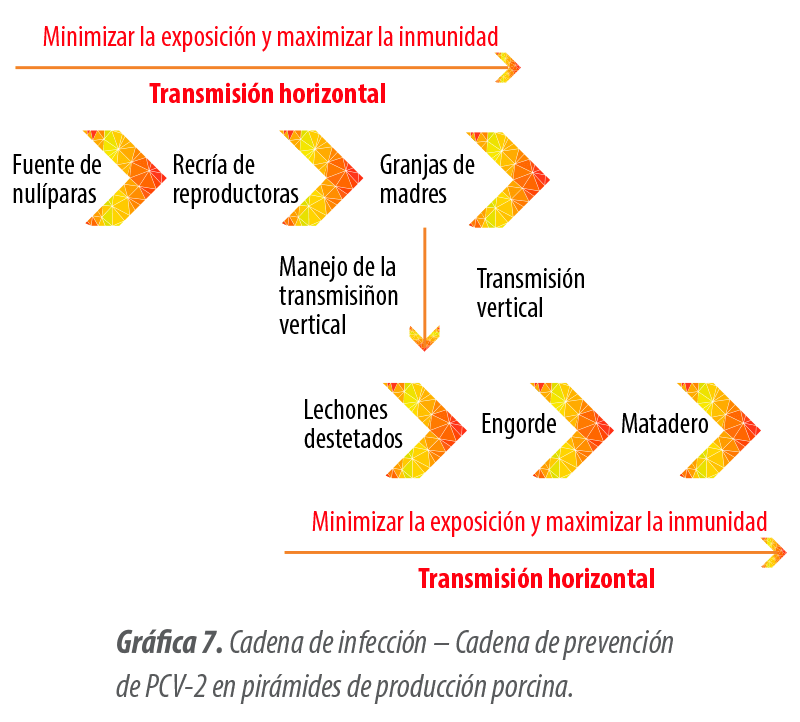
Hace tiempo, el seguimiento de la cadena de infección-prevención demostró que la vacunación de las reproductoras frente a PCV-2 (vacuna de subunidades, registrada) permite controlar la transmisión vertical y horizontal del virus.
| Para nuestra sorpresa, las analíticas revelaron que todos los pools de las lenguas eran negativas a PCV-2 y PRRSV, pero positivas a Circovirus tipo 3 (PCV-3) (Tabla 1). |

Se podría argumentar que estos resultados no explicaban los abortos ni la falta de vitalidad de los lechones nacidos vivos.
Sin embargo, la vitalidad de los lechones condiciona en gran medida su comportamiento productivo en las siguientes fases, ya que determina el grado de encalostramiento, y, por tanto, su capacidad de respuesta inmunitaria frente a las infecciones.

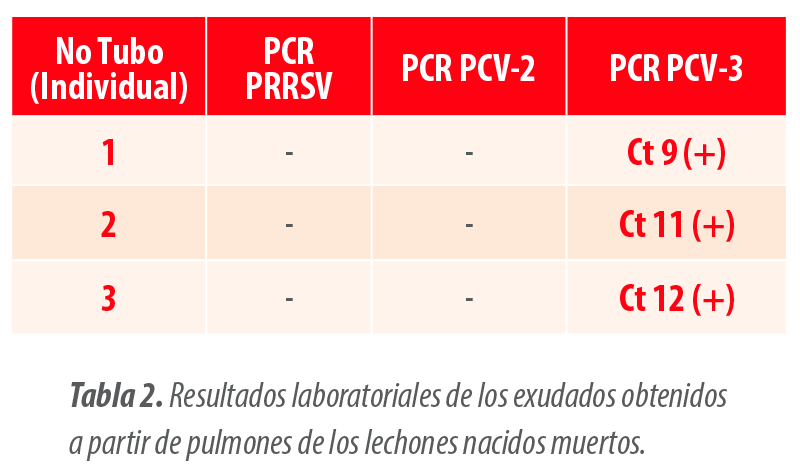
Por ello, se analizaron también los pulmones de los lechones que estaban naciendo con poca vitalidad, obteniéndose resultados similares (Tabla 2).
| Otros procesos que entraron en el diagnóstico diferencial fueron:
|
Los resultados de los análisis laboratoriales y la observación de partos con lechones que tardaban mucho en levantarse e ir a tetar, con orejas agrandadas y pegadas en la parte posterior indujeron a pensar que podría estar involucrado el PCV-3.
Actualmente, diferentes estudios relacionan la presencia de PCV-3 con síntomas clínicos en lechones recién nacidos y con problemas reproductivos, como abortos.
 |
De acuerdo con la bibliografía existente, parece claro que:

2) La clínica que se describe se asocia bastante a la observada a nivel práctico en la granja, con incremento de abortos y lechones momificados, y una fuerte reducción de la vitalidad de los lechones nacidos vivos.
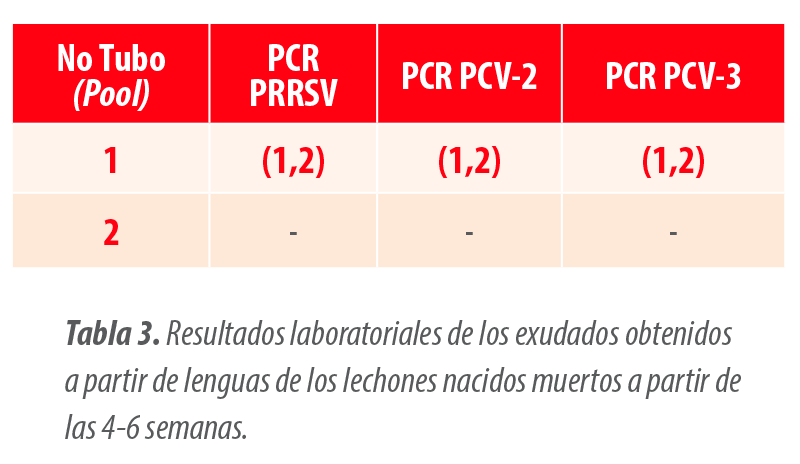
3) En este caso, la viremia no persistió en la granja, sino que a partir de las 4-6 semanas se dejaban de encontrar lechones con falta de vitalidad, hecho que coincidía con un descenso en los resultados positivos a PCR hasta obtener resultados negativos frente a PCV-3 (Tabla 3).
4) Independientemente de las pérdidas productivas asociadas al incremento de abortos y nacidos muertos, lo más preocupante de las infecciones por PCV-3 es la pérdida de vitalidad de los lechones, dado que ello ocasiona que no tengan un buen desarrollo productivo a lo largo del resto de su vida productiva.
5) Es necesario realizar un buen diagnóstico diferencial con procesos que producen síntomas similares, no debiendo descartar al PCV-3 como agente involucrado en cuadros que cursen con abortos y lechones nacidos débiles.
| CONCLUSIONES |
Te puede interesar: Optimización de los protocolos vacunales en la producción porcina
BIBLIOGRAFÍA
Dal Santo, A. C., Cezario, K. C., Bennemann, P. E., Machado, S. A., Martins, M. Full genome sequences of porcine circovirus 3 (PCV3) and high prevalence in mummified fetuses from commercial farms in Brazil. Microbial Pathogenesis (2020). 141.
Molossi FA., de Almeida BA., de Cecco BS., da Silva MS., Mósena ACS., Brandalise L., et al. A putative PCV3-associated disease in piglets from southern Brazil. Braz J Microbiol. (2022) 53:491–8.
Arruda B., Piñeyro P., Derscheid R., Hause B., Byers E., Dion K., Lond, D., Sievers, C., Tangen, J, Willians, T., Schwartz, K. PCV3-associated disease in the United States swine herd. Emerg Microb Infect. (2019) 8:684–98.
Saporiti V., Valls L., Maldonado J., Perez M., Correa-Fiz F., Segalés J., Sibila, M. Porcine circovirus 3 detection in aborted fetuses and stillborn piglets from swine reproductive failure cases. Viruses. (2021) 13:264.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en porciNews
REGISTRARME






















