DESARROLLO DE VACUNAS
Patología & Diagnóstico
Avances en el conocimiento del Síndrome Respiratorio Reproductivo Porcino
GUARDAR EN LA LIBRERÍA PDFPara leer más contenidos de porciNews Marzo 2018
Patología & Diagnóstico
Para leer más contenidos de porciNews Marzo 2018
A principios de los años 90 apareció la enfermedad misteriosa, aborto azul o Síndrome Respiratorio Reproductivo Porcino (SRRP o PRRS) y, desde entonces, ha producido grandes cambios en la producción porcina moderna. Como ejemplo, tenemos el cambio de producción en ciclo cerrado a producción en 2 o 3 fases, que a su vez supuso un importante aumento del censo de animales en algunas áreas de producción.
DESARROLLO DE VACUNAS
La primera vacuna frente a la enfermedad, CYBLUE, apareció en España en 1994. Esta fue una vacuna inactivada con genotipo europeo y con adyuvante oleoso, que partía de un aislamiento vírico con cultivo sobre macrófagos alveolares de porcino con genotipo 1 (cepa europea) y registro para reproductoras. Unos meses después, se registró en Estados Unidos la primera vacuna atenuada con genotipo 2 (cepa americana). El cultivo del virus se había conseguido sobre una línea celular de riñón de mono, MA-104.
En 1996 aparece una vacuna atenuada con genotipo europeo que también se atenúa sobre células de riñón de mono, obteniendo registro solamente en cerdos de engorde. Desde entonces se han registrado varias vacunas, tanto atenuadas como inactivadas, con genotipo europeo o americano, pero teniendo en común el medio de cultivo MA-104 o líneas celulares derivadas de este. (Tabla 1).
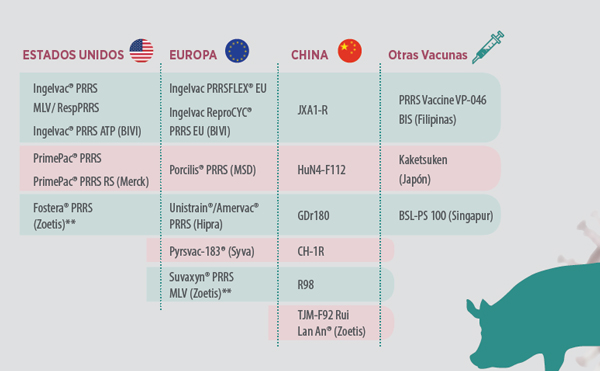
Tabla 1. Vacunas de PRRS (virus vivo modificado en cultivo celular)* * Jay Calvert 2018 (datos recogidos por Zoetis) ** Fostera® PRRS y Suvaxyn® PRRS MLV utilizan un medio de cultivo diferente BHK21-CD163
Desde hace más de 20 años, aparecen numerosos estudios que ayudan a combatir el virus PRRS, de los que nombraremos algunos de ellos.
1996
Así, Scott Dee (JSHAP, 1996) detecta subpoblaciones después de una infección de PRRS en granjas de reproductoras de gran tamaño usando diferentes test serológicos. Las subpoblaciones explican la persistencia de la transmisión vírica en granjas crónicamente infectadas.
1998
De nuevo Scott Dee (JSHAP, 1998) explica la importancia de la vacunación en sábana y el movimiento unidireccional de los animales para controlar la transmisión del virus, cuestionando la despoblación parcial de las granjas para controlar la transmisión del virus PRRS.
2002
Torremorell (JSHAP, 2002) demuestra la posibilidad de crear una nueva granja negativa al virus de PRRS a partir de orígenes positivos al virus. Se consiguió preservar el valor genético de granjas positivas a la enfermedad, creando granjas negativas con ausencia de seroconversión en la descendencia. Al mismo tiempo Mengeling (JSHAP, 2002) explica el papel potencial de la recombinación genética en la aparición de nuevas cepas de PRRS, ya sea entre cepas virulentas, entre cepas atenuadas o incluso cepas virulentas con atenuadas.
2005
La capacidad de diagnóstico también ha conseguido clarificar la eficacia de las vacunas, y Opriessnig-Halbur (JSHAP, 2005) hacen un estudio donde la homología genética de ORF5 entre la cepa vacunal y la cepa virulenta no tiene valor predictivo de su capacidad protectiva en la granja.
2007
Posteriormente, Cano (AJVR, 2007; Vaccine J, 2007) valora el efecto de la vacunación con vacuna atenuada en la dinámica de la infección, tanto con cepas homólogas como heterólogas. La vacunación no previene la infección ni elimina el virus PRRS, pero reduce la transmisión del virus virulento entre animales y reduce los signos clínicos consecuencia de nuevas infecciones de campo. En 2007, se publica un estudio de campo donde Schaefer-Morrison (JSHAP, 2007) consiguen la eliminación del virus PRRS mediante el cierre de granja (“herd closure”) midiendo su efecto económico en la producción de lechones.
2014
Recientemente, Linhares (Preventive Vet Med J, 2014) compara el tiempo para alcanzar la estabilidad en PRRS y las pérdidas de producción asociadas a dos programas de control en granjas de reproductoras: eficacia y seguridad de la vacunación con virus vivo o con virus atenuado para la exposición de los animales seguido de cierre de granja para eliminar el virus PRRS de la granja. El estudio concluye que el ratio de éxito es similar entre ambos tratamientos y la relación coste – beneficio es superior cuando se usa virus vacunal atenuado. Jeong (Am J Vet Res 2014) hace un modelo estocástico sobre estrategias de control de PRRS en Estados Unidos donde concluye que la repetida inmunización en sábana con vacuna de virus atenuado junto al cierre de granja y la adaptación de nulíparas es el protocolo con más posibilidades de conseguir la estabilización de la granja. (Tabla 2).
La estrategia basada en el cierre de la granja y adapatación de nulíparas, en combinación con dos sábanas de vacunación resultó ser lo más efectivo, independientemente de la virulencia y el tamaño de la explotación.
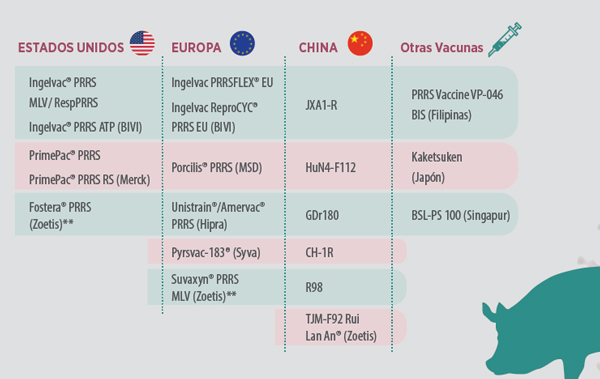
Tabla 2. Porcentaje de simulaciones que consiguen el estatus “estable” (PCR negativos a PRRS en lechones de 3 semanas de vida) según el tamaño de granja y nivel de virulencia, dependiendo de las estrategias de control del PRRS. a Cierre de granja, una sábana de vacunación con vacuna atenuada b Cierre de granja, dos sábanas de vacunación con vacuna atenuada, adaptación de nulíparas c Una sábana de vacunación con vacuna atenuada, adaptación de nulíparas d Dos sábanas de vacunación con vacuna atenuada, adaptación de nulíparas
AVANCES EN DIAGNÓSTICO DEL VIRUS PRRS
GERARD MARTÍN
2016 North American PRRS Symposium
Gerard Martín presenta un avance en la identificación del virus PRRS en cordones umbilicales como una excelente muestra para lechones en el momento del nacimiento para identificar la transmisión vertical del virus PRRS, sin comprometer la vida de animales recién nacidos al tomar muestras de sangre.
CARLES VILALTA
2017 Leman Conference
Carles Vilalta presenta un estudio, que complementa el anterior, con alternativas de muestreo. Aprovechando los momentos de manejo del lechón, demuestra que los testículos o las colas de los lechones son útiles para el diagnóstico del virus PRRS.
Las vacunas atenuadas tienen el potencial de replicar durante un largo período de tiempo en los animales vacunados, y la duración de esta replicación puede ser importante para el desarrollo de anticuerpos neutralizantes, incluso más para el PRRS que para otros virus (Mengeling, JSHAP 2005).
Esto provoca que los animales puedan excretar vía oronasal el virus vacunal atenuado, dificultando el diagnóstico mediante fluidos orales, ya que una PCR no diferenciará entre virus vacunal o virus de campo. Para poder realizar el diagnóstico mediante fluidos orales se ha desarrollado un ELISA, que detecta IgM-IgA específicas de PRRS para demostrar la infección en presencia de anticuerpos maternales (Rotolo et al, Veterinary Microbiology 2018).
El diagnóstico laboratorial combinando ELISA y PCR, anticuerpos y antígeno, evita posibles errores frente a resultados con un único método
INVESTIGACIÓN LABORATORIAL DEL VIRUS PRRS
Al mismo tiempo que se hacen progresos en el conocimiento de la epidemiología del virus PRRS, Jay Calvert, investigador de Zoetis, descubre en 2004 (Journal of Virology 2007) la existencia del receptor CD163 en las líneas celulares de varias especies como factor necesario para la infección del virus PRRS.
El medio de cultivo utilizado hasta el momento para la producción de vacunas de PRRS vivas atenuadas (MA-104 o líneas celulares derivadas de este) expresa un receptor CD163 similar al receptor porcino, hecho que exige al virus un proceso de adaptación durante los pases celulares para su atenuación, y una re-adaptación del mismo cuando es inoculado en los cerdos, dificultando la multiplicación del virus vacunal en el cerdo
Calvert diseña una nueva línea celular de riñón de cría de hámster modificada genéticamente (BHK-21) que expresa el receptor CD163 porcino, fenotípicamente estable y susceptible a la infección de PRRS, produciendo altos títulos de virus de progenie al evitar adaptaciones y readaptaciones del virus vacunal. Con esta nueva línea celular Zoetis consigue desarrollar una nueva vacuna de PRRS, una vacuna atenuada de PRRS para reposición y cerdas, que además demuestra superar los anticuerpos maternales, vacunando lechones de 1 día de vida, mejorando los resultados productivos en condiciones de campo (Jeong, Vet Micro 2018).
CONCLUSIONES
El virus PRRS está siendo muy costoso en la producción porcina a nivel mundial, por lo que se invierten elevados recursos en su control, y muchos grupos de investigación están involucrados en mejorar el conocimiento de este virus. Estos avances en epidemiología y en diagnóstico permiten alcanzar un mejor control del virus, y en algunos casos, la eliminación de PRRS de la granja.
También vemos un progreso en la investigación laboratorial, donde el descubrimiento del receptor CD163 por Jay Calvert (Zoetis) está permitiendo el desarrollo de nuevas vacunas con alto potencial de multiplicación y abre el campo a nuevas investigaciones.