H. parasuis, una bacteria muy común en el cerdo que coloniza a los lechones a una edad muy temprana.
La enfermedad de Glässer se observa en granjas porcinas de todo el mundo y normalmente está relacionada con eventos estresantes como el destete temprano o el movimiento y la mezcla de animales, pero su aparición también está favorecida por infecciones con otros patógenos.
Esta enfermedad tiene un gran impacto económico en el sector porcino, afectando principalmente a los lechones en transición.
H. parasuis coloniza el tracto respiratorio superior de los lechones por contacto con sus madres tras el nacimiento. A los 2 días de vida ya se detecta H. parasuis en la cavidad nasal de los lechones, aunque la prevalencia máxima de colonización se observa a los 60 días de edad (Cerdá-Cuéllar et al., 2010).
Normalmente, los lechones están colonizados por más de una cepa de H. parasuis, y es fácil aislar cuatro o cinco cepas a partir de los lechones en transición de una única granja.
La detección de H. parasuis en los lechones no es un dato significativo para diagnosticar o pronosticar la enfermedad de Glässer.
La colonización por H. parasuis se desarrolla simultáneamente a la toma de calostro consiguiendo así un equilibrio entre colonización e inmunidad. Cuando este equilibrio se desestabiliza puede aparecer un brote de enfermedad (Figura 1).
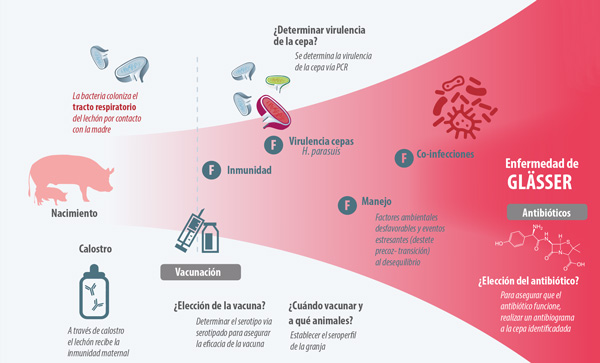
Figura 1. Factores -F- que alteran el equilibrio entre colonización e inmunidad y favorecen la aparición de la enfermedad de Glässer.
El laboratorio puede realizar pruebas, que facilitan la adecuación de las medidas de control
Es importante asegurar que se colonicen y tomen suficiente calostro de su madre. El manejo de maternidades debe ser correcto para asegurar que los lechones llegan al destete protegidos.
El destete es un momento crucial de muchos cambios para los lechones, que además coincide con un declive en la inmunidad maternal.
En este momento también se mezclan los lechones de distintas madres y surgen conflictos jerárquicos entre ellos, que junto con el cambio de alimentación y la separación de sus madres, provocan estrés.
Además, otros factores pueden influir en la aparición de la enfermedad, incluyendo factores ambientales como temperatura inestable o ventilación insuficiente, la presencia de otros patógenos en la granja y la virulencia de las cepas de H. parasuis presentes en los lechones (Figura 1).
DIAGNÓSTICO
El diagnóstico correcto de la enfermedad debe tener en consideración las observaciones en la granja (signos clínicos, edad de los animales afectados…), las lesiones observadas en las necropsias y los hallazgos en el laboratorio (Figura 2).
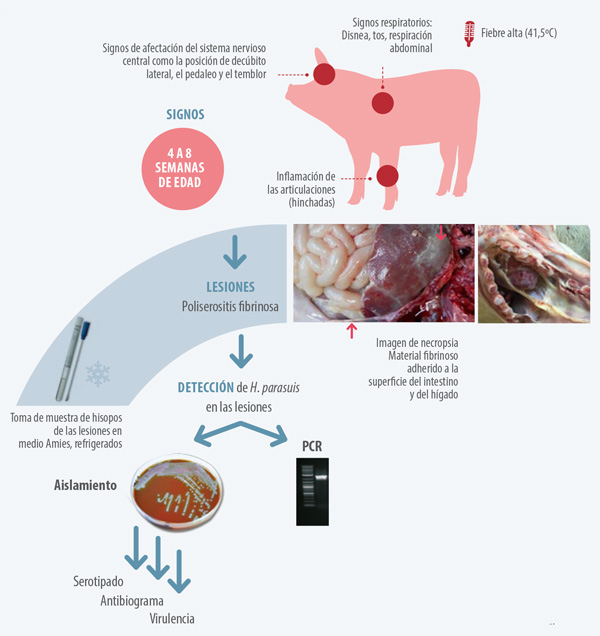
Figura 2. El diagnóstico de la enfermedad de Glässer comienza con la observación de los signos clínicos en la granja y se completa con la detección de Haemophilus parasuis en las lesiones características de poliserositis fibrinosa.
Los signos clínicos se observan principalmente en cerdos de 4 a 8 semanas de edad, aunque la edad de los animales afectados puede variar dependiendo del nivel de inmunidad materna adquirida y de colonización por la bacteria. Además, casos de enfermedad de Glässer pueden observarse esporádicamente en cerdos adultos.
Los signos clínicos típicos de la enfermedad de Glässer son poco característicos (ver Figura 2). Estos signos pueden observarse de manera conjunta o independiente.
Los animales con enfermedad de Glässer muestran las lesiones características de esta enfermedad en la necropsia: poliserositis fibrinosa o fibrinopurulenta, poliartritis y meningitis. En algunos casos, también se puede observar broncopneumonia catarralpurulenta.
La gravedad de la enfermedad depende de la virulencia de la cepa de H. parasuis, la inmunidad de los lechones, la presencia concomitante de otros patógenos en la granja y la resistencia genética del huésped. Aunque las lesiones de poliserositis son características de la enfermedad de Glässer, no son exclusivas de H. parasuis, y otros patógenos deben ser considerados en el diagnóstico diferencial.
Tanto Streptococcus suis como Mycoplasma hyorhinis causan las mismas lesiones de poliserositis y afectan a lechones en transición, donde pueden encontrarse en co-infecciones junto con H. parasuis. Además, Escherichia coli no hemolítico también puede causar lesiones similares.
Las mejores muestras para el diagnóstico de la enfermedad de Glässer son las obtenidas de las lesiones sistémicas, ya que las muestras del tracto respiratorio pueden estar contaminadas con cepas colonizadoras apatógenas.
La variedad de cepas de H. parasuis durante un ciclo completo de producción es bastante alta (se han aislado hasta 16 cepas diferentes en una sola granja), pero por lo general una sola cepa se asocia con un brote de enfermedad.
La cepa implicada en cada brote debe identificarse de forma específica, ya que es a la que deben dirigirse las medidas de control.
Es recomendable tomar varias muestras del mismo animal, y muestras de varios animales. Esto nos permite aumentar las posibilidades de aislamiento y la comprobación por genotipado de que en efecto encontramos una única cepa en todas las muestras.
Los animales muestreados deben ser lechones con enfermedad aguda, y sin tratamiento antibiótico que pueda impedir el crecimiento bacteriano.
Para la toma de muestras se recomienda el uso de hisopos, que deben transportarse rápidamente al laboratorio en medio de transporte Amies y refrigeración para aumentar las posibilidades de éxito del aislamiento, ya que H. parasuis es un microorganismo fastidioso con una supervivencia limitada fuera del animal (del Rio et al., 2003).
Es muy importante tomar las muestras de manera aséptica y evitar contaminación con la piel del animal o el entorno, ya que sería muy probable que la contaminación enmascarara el crecimiento de H. parasuis.
Aunque el aislamiento de H. parasuis puede ser una tarea difícil, es importante realizarlo para permitir la tipificación de la cepa aislada, incluyendo su sensibilidad a los antibióticos.
IDENTIFICACIÓN POR PCR
Identificación
La identificación de H. parasuis puede realizarse de forma rápida mediante PCR. Esta técnica es útil para la identificación de la bacteria aislada o directamente confirmar su presencia en las muestras de diagnóstico. Existen PCR convencionales y a tiempo real para el diagnóstico de H. parasuis.
La mayor ventaja de la PCR, además de la rapidez diagnóstica, es la detección de H. parasuis aun cuando el organismo ya no es viable.
Caracterización
Una vez confirmada la identidad del agente causante de las lesiones podemos realizar técnicas complementarias de caracterización de las cepas, que nos proporcionarán información para el control adecuado de la enfermedad.
Las cepas de H. parasuis presentan grados variable de virulencia, que se pueden demostrar claramente en infecciones experimentales y ensayos de virulencia in vitro. Además, recientemente se han diseñado técnicas de PCR que permiten obtener información sobre la virulencia de las cepas.
En la actualidad la PCR basada en los genes vtaA ha demostrado ser de gran ayuda para pronosticar la virulencia de las cepas (Olvera et al., 2012). Sin embargo, dada la complejidad de la patogenia de la enfermedad y los distintos genes implicados en mecanismos de virulencia es esperable que la determinación de la presencia/ausencia de más de un gen contribuya a definir de manera más precisa el grado de virulencia de las cepas.
La presencia de varias cepas en cada granja hace necesario poder diferenciarlas. Así, las técnicas de genotipado, como la ERIC-PCR, permiten la discriminación de las distintas cepas de H. parasuis aisladas.
Co-infección
En los casos en que H. parasuis actúa como patógeno primario se espera detectar una única cepa en todas las muestras que hemos tomado de las lesiones.
Sin embargo, en los casos en los que actúa como patógeno secundario existen más probabilidades de que distintas cepas, no necesariamente muy virulentas, puedan aprovechar la situación de inmunodepresión de los lechones y ser encontradas en lesiones que por ellas mismas no hubieran podido producir.
Esta última situación suele estar asociada principalmente a co-infecciones por virus, como el PRRS, PCV2 o el virus de la gripe, que afectan el sistema inmune y hacen a los animales más susceptibles a infecciones bacterianas secundarias.
De manera opuesta, aunque las cepas más virulentas pueden actuar como agentes primarios, también las podemos encontrar como colonizadoras del tracto respiratorio superior de los lechones sin causar problemas clínicos.
En este último caso estarían controladas por la inmunidad de los lechones.
CONTROL
La transmisión de la enfermedad de Glässer se produce por contacto de cerdos portadores o enfermos con animales susceptibles. Por lo tanto, mezclar cerdos de diferentes orígenes y edades es un factor de riesgo que debe tenerse en cuenta al controlar la enfermedad.
La aparición de un brote de enfermedad de Glässer puede controlarse con un tratamiento antibiótico rápido. Para asegurar que es efectivo, debe realizarse un antibiograma a la cepa identificada como causante de los problemas clínicos.
Hay que tener siempre en mente la gran resistencias descrita en esta especie bacteriana, y la recomendación de reducir en lo posible el consumo de antibióticos.
Cuando los brotes son recurrentes es recomendable tomar medidas preventivas, que vayan desde la mejora del manejo y la bioseguridad en la granja hasta la posibilidad de vacunar.
Los tratamientos metafilácticos perinatales con antibióticos deben evitarse, ya que interfieren con la correcta colonización de los lechones; esta colonización puede ser una garantía de protección frente a la exposición posterior a cepas virulentas (Brockmeier et al., 2013).
Estas observaciones apoyan la opción de usar la colonización nasal con cepas no virulentas como medida de control. Además, se ha mostrado que la microbiota nasal puede ser un factor relacionado con la salud o con la predisposición a sufrir la enfermedad de Glässer (Correa-Fiz et al., 2016). Así, una mayor variedad bacteriana en la microbiota nasal está relacionada con una mejor salud de los lechones, y esta variedad se ve reducida con los tratamientos antibióticos.
Es bien sabido que los anticuerpos específicos frente a H. parasuis protegen a los lechones frente a la enfermedad de Glässer. Estos anticuerpos se pueden adquirir de forma natural o mediante vacunación.
Inmunidad maternal
Las madres, a través del calostro, transfieren a sus lechones anticuerpos protectivos. A su vez, las madres son fuente de bacterias colonizadoras, que posteriormente inducirán inmunidad propia en los lechones
Si las madres no tienen un buen nivel de anticuerpos, o los lechones no llegan a colonizarse bien para producir sus propios anticuerpos, se puede intervenir con vacunas.
Vacunas comerciales
Las vacunas comerciales consisten en bacterinas, que proporcionan un cierto grado de protección dependiendo del serotipo. La cepa causante del cuadro clínico puede serotiparse para confirmar si la vacuna comercial cubriría ese serotipo.
Los laboratorios que realizan la serotipación en el mundo son muy limitados, pero recientemente se ha descrito un método de serotipación molecular mediante PCR que permite determinar el serotipo de forma fácil (Howell et al., 2015).
La serotipación nos permitirá evaluar la conveniencia de usar una vacuna comercial o la posibilidad de producir una auto-vacuna, aunque estas últimas carecen de la garantía de seguridad y eficacia que requiere el registro comercial.
Dada esta situación, varios grupos de investigación se han centrado en diseñar vacunas universales, independientemente del serotipo, frente a todas las cepas de H. parasuis o específicamente frente a las cepas virulentas. Las vacunas específicas frente a las cepas virulentas supondrían una reducción del riesgo de sufrir la enfermedad de Glässer por eliminación de las cepas virulentas, a la vez que no interferirían en la colonización con cepas no virulentas, que también confieren una cierta protección frente a la enfermedad.
Un aspecto importante a la hora de realizar la vacunación es decidir el momento oportuno de la administración de la vacuna elegida. Por un lado, los anticuerpos maternales interfieren en la eficacia vacunal (Pomorska-Mol et al., 2011).
Por otro lado, la vacunación no puede retrasarse demasiado debido a que los lechones de entre 4 y 8 semanas son los más afectados por la enfermedad de Glässer.
Aunque las pruebas de ELISA son poco utilizadas en el diagnóstico de la enfermedad de Glässer, pueden proporcionar información relevante del seroperfil de las granjas para establecer un régimen adecuado de vacunación.
La vacunación de lechones debería realizarse cuando los anticuerpos maternales sean bajos, pero lo suficientemente pronto para que la vacuna induzca un nivel suficiente de anticuerpos en los lechones en transición.
La vacunación de las madres es una alternativa a tener en cuenta para garantizar la transferencia de un nivel adecuado de anticuerpos a los lechones a través del calostro
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en porciNews
REGISTRARME