Para leer más contenidos de porciNews Nov 2015
Para leer más contenidos de porciNews Nov 2015
Por Álvaro Aguarón & Clara Farré. Servicios Técnicos de Porcino de Laboratorios Syva, S.A.U.
Parecería obvio definir la leptospirosis porcina como la infección causada por este microorganismo en el cerdo. Pero son muchas las especies de Leptospira que, de manera saprófita, están presentes en muchos medios y no provocan, en manera alguna, patología relevante en los posibles huéspedes. Son las especies patógenas las que sí que tienen un interés cada vez más creciente en la producción porcina actual.
Leptospira, junto con los géneros Leptonema y Turneriella, es un microorganismo perteneciente a la familia Leptospiraceae dentro del orden de los Spirochaetales siendo, por tanto, espiroquetas.
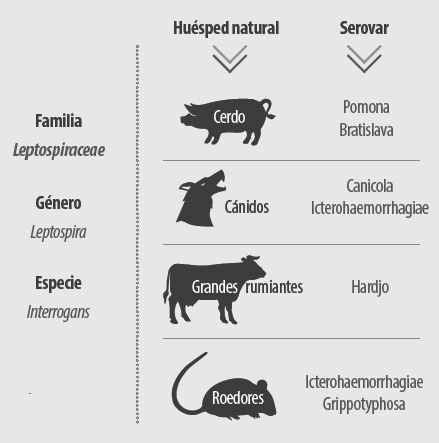
El género Leptospira se divide en 20 especies en base a estudios de hibridación de ADN. A su vez, estas 20 especies, pueden dividirse en 3 grupos:
Según su relación antigénica, los miembros del género Leptospira, se agrupan en serovares. Actualmente hay más de 200 serotipos reconocidos
En los cerdos, y en mayoría de especies domésticas, la patología causada por esta bacteria está asociada a la especie Leptospira interrogans.
Leptospira interrogans es una espiroqueta Gram negativa, aeróbica obligada y con flagelos periplásmicos que le confieren movilidad. Es una especie difícil de cultivar que requiere medios especiales y periodos de incubación bastante prolongados.
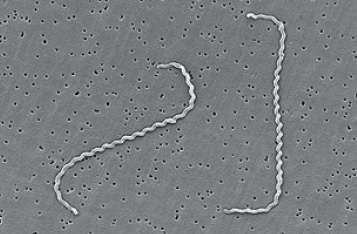
Imagen 1. Leptospira interrogans
El cerdo es el huésped natural de Leptospira interrogans serovar Bratislava y Leptospira interrogans serovar Pomona. Cuando el cerdo está infectado por estas serovariedades se dice que lo está por serovares adaptados.
Esto no excluye que una especie, en este caso la porcina, pueda verse afectada por serovares propios de otras especies animales como Leptospira interrogans serovar Canicola o serovar Icterohaemorrhagiae, ambos adaptados a los cánidos, serovar Hardjo, adaptado a los grandes rumiantes, o serovar Grippotyphosa, junto con Icterohaemorrhagiae, presente en roedores.
En estos casos nos referiremos a infecciones por serovares no adaptados. Esta última circunstancia se produce de manera habitual por el estrecho contacto que hay sobre todo con roedores en la práctica totalidad de las granjas a pesar de las medidas de desratización establecidas.

La leptospirosis es una enfermedad zoonótica
Hasta hace poco, esta enfermedad carecía de relevancia en el modelo productivo porcino establecido.
Con el aumento de la tecnificación de las explotaciones, las pautas de higiene y la educación de ganaderos y cuidantes, se dejaron atrás enfermedades como la que describimos en el presente artículo.
Ha sido, sin duda, la entrada en vigor de la nueva normativa relativa al bienestar animal la que ha propiciado en las granjas el ambiente ideal, no sólo para la supervivencia de la Leptospira, sino también las condiciones óptimas para su diseminación y vía de contagio.
El alojamiento en grupo de las cerdas gestantes constituye un punto clave en la dinámica de infección de esta enfermedad.
A un estrecho contacto con los principales fómites de la enfermedad, orina y fetos y anejos en caso de abortos, se une que las peleas entre cerdas provocan heridas en la barrera epitelial permitiendo la entrada del patógeno en el organismo animal.

Es preciso señalar que la diseminación y progreso de la infección en una granja dista mucho de lo que estamos acostumbrados en el caso de recirculaciones víricas.
La leptospirosis requiere contacto directo, estrecho y con cantidad infectiva suficiente entre la bacteria y el cerdo infectado. Esto hace que el deterioro de los ratios reproductivos asociados a Leptospira, en muchas ocasiones, sean tan progresivos que se acabe produciendo con su lastre sin que haya motivos de excesiva alarma.
Aunque no existen referencias exactas de la prevalencia de la enfermedad en España, se estima que cerca de un 85% de las explotaciones testadas a nivel nacional son positivas a algún serovar patógeno de Leptospira.
Sin embargo, estos datos se han obtenido a través de análisis serológicos mediante microaglutinación de explotaciones sospechosas que muestran un cuadro de fallo reproductivo compatible con la leptospirosis porcina por lo que, previsiblemente, en términos globales la prevalencia sea menor.
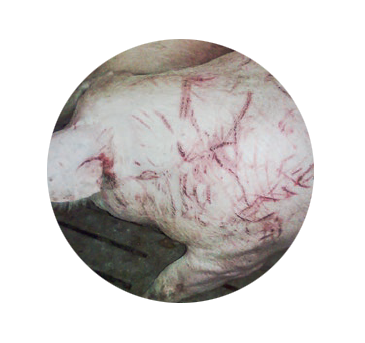
Imagen 2. Las lesiones cutáneas provocadas por las peleas constituyen una de las principales vías de entrada de las leptospiras
Leptospira no dispone de una membrana impermeable, por lo que su supervivencia depende en gran medida de la humedad del ambiente.
En condiciones con una alta actividad de agua, caso de los parques para cerdas gestantes, Leptospira conserva su capacidad infectiva.

Una vez el animal ha sido infectado, Leptospira pasa al torrente sanguíneo, produciéndose una fase de leptospiremia que suele durar entre 7 y 10 días, periodo durante el cual se desarrollará el cuadro clínico propio de cada serovar.
La infección del cerdo por parte de serovares propios de otras especies animales -serovares no adaptados-, desencadena un cuadro clínico agudo caracterizado por estados febriles, anorexia, diarrea, hipoagalaxia en cerdas lactantes, cierta ictericia y hemoglobinuria, y un violento cuadro de fallo reproductivo que cursa con tormentas de abortos, aumento de las repeticiones, aparición de cerdas sucias, mortinatos, momias y mortalidad perinatal.
SEROVARES ADAPTADOS
Por otro lado, el cuadro clínico ocasionado por la infección por los serovares adaptados al cerdo, Pomona y Bratislava, puede presentarse de igual manera pero, por lo general, de forma menos virulenta.
INFECCIÓN
Cuando se trata de la primo-infección de una granja negativa se suele dar un cuadro clínico subagudo muy parecido al propio de los serovares no adaptados al cerdo. En cambio, cuando la infección ocurre en una granja positiva, la sintomatología es mucho menos evidente pudiendo parecer, incluso, un proceso asintomático.
En el caso de infecciones por serovares adaptados, el patrón de fallo reproductivo es más insidioso que abrupto. Se caracteriza por un aumento del valor “litter scatter” o camadas anormalmente cortas.
Aunque un aumento de este parámetro conlleve importantes repercusiones económicas, puede pasar desapercibido sobre todo en explotaciones con genéticas poco prolíficas o poco tecnificadas, asumiéndose como una producción sub-óptima.
Las líneas rojas que no se deben superar y que pueden constituir una pista sobre un proceso de leptospirosis por serovares adaptados se establecen en un 15% de “litter scatter” en cerdas multíparas y un 18% de las camadas procedentes de primerizas.

Imagen 3. Las camadas anormalmente cortas son el principal signo de alarma de infección por serovares adaptados.
Las infecciones por serovares adaptados se caracterizan por un aumento de “litter scatter” o camadas anormalmente cortas
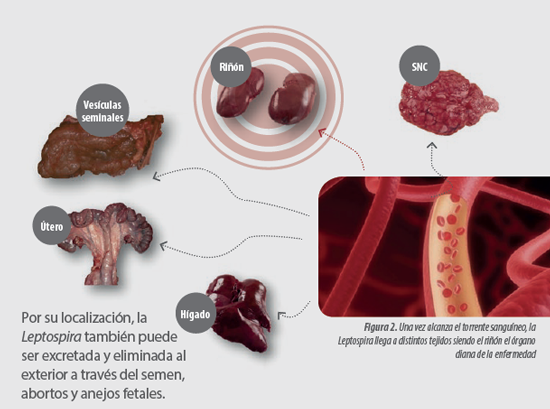
A continuación de la fase de leptospiremia, la bacteria coloniza distintos órganos como el hígado, estructuras del sistema nervioso central, útero en hembras y vesículas seminales en machos y riñón.
El riñón constituye el auténtico órgano diana de la enfermedad y punto clave en el ciclo biológico de Leptospira ya que, después de su división dentro del organismo del cerdo, Leptospira necesita ser excretada al exterior a través de la orina (leptospiruria) para ocasionar nuevas infecciones.
En el caso de los serovares no adaptados la fase de leptospiruria tiene una corta duración, mientras que los serovares adaptados establecen un acantonamiento en el tejido renal que prolonga la fase de leptospiruria prácticamente de por vida.
Ha sido muy común el realizar un diagnóstico de Leptospira en las explotaciones por simple descarte de otras enfermedades causantes de fallo reproductivo tales como PRRS, Parvovirosis porcina o Mal Rojo, entre otras.
Una vez excluida la posibilidad de que dichas enfermedades estuviesen involucradas, y con el fin de poner remedio al cuadro sintomático, se optaba por un blanqueo con un antibacteriano del grupo de las tetraciclinas y si la clínica remitía se daba por diagnosticada Leptospira sin ninguna prueba laboratorial que así lo ratificase.
Actualmente el diagnóstico de Leptospira es posible de modo directo, existiendo distintas técnicas para ello:
El aislamiento microbiológico de Leptospira es muy complicado y prácticamente inviable en laboratorios convencionales de diagnóstico. De esta manera, no es posible descartar la infección debido a resultados negativos del cultivo in vitro de muestras biológicas.
TÉCNICAS DE BIOLOGÍA MOLECULAR -PCR A TIEMPO REAL
Se han utilizado en muchos casos técnicas de biología molecular en tejidos, como fetos de cerdas abortadas o riñón. Es lógico pensar que un resultado positivo a dichas técnicas es definitivo en el diagnóstico de la enfermedad pero un resultado negativo no excluye la presencia de la misma.
 La leptospirosis no suele producir bajas en el colectivo reproductivo, de manera que la obtención de riñones para el diagnóstico resulta difícil.
La leptospirosis no suele producir bajas en el colectivo reproductivo, de manera que la obtención de riñones para el diagnóstico resulta difícil.
Por otro lado, la detección de Leptospira en fetos conlleva el riesgo de obtener resultados falsos negativos debido a que en una misma gestación porcina pueden coexistir fetos infectados y fetos sanos y así encontrarlos en un mismo aborto.
La aplicación de estas técnicas en orina y sangre también es factible aunque no resulten ser muestras de elección por distintos motivos.
Por una parte, como ya se ha explicado anteriormente, la fase de leptospiremia tiene una duración relativamente corta por lo que la posibilidad de obtener resultados falsos negativos en animales realmente infectados es elevada.
Por otro lado, la obtención y procesado de muestras de orina puede entrañar algunas dificultades técnicas que compliquen el diagnóstico.
MICROAGLUTINACIÓN EN PLACA
Se considera la técnica serológica de elección para el diagnóstico de Leptospira ya que, a pesar de su especificidad, descarta la posibilidad de detectar falsos positivos, circunstancia bastante habitual en los ELISA actualmente disponibles para la enfermedad.
Se trata de una técnica no automatizada, lenta, costosa y que requiere una alta especialización en su realización y es por ello que tan sólo se lleva a cabo en centros especializados en el diagnóstico y estudio de esta patología. Confiere la posibilidad de distinguir entre serovares, hecho de gran importancia en el futuro tratamiento y plan de control de la enfermedad en la explotación. De manera descriptiva se puede decir que esta técnica serológica se basa en enfrentar diferentes diluciones del suero problema a cultivos vivos de Leptospira.
Para el diagnóstico de leptospira se recomienda la microaglutinación en placa
En la placa se identifican los serovares inoculados y, pasado un tiempo de incubación determinado, se analiza el resultado con la ayuda de un microscopio de campo oscuro. Debido a que los anticuerpos generados frente Leptospira son aglutinantes, la observación de leptospiras aglutinadas en el microscopio indica un resultado positivo a la infección.
Se trata pues de una técnica muy específica que permite discernir entre serovares. Las titulaciones obtenidas, reflejan la máxima dilución del suero problema a la que todavía puede observarse algún grado de aglutinación.
Es la interpretación de estas titulaciones la que catalogará el proceso en agudo o crónico y dará una idea de la prevalencia que tiene la infección en la explotación. Todos ellos, datos necesarios para implementar un programa de control global.
Leptospira spp. es altamente sensible a desinfectantes y a antibacterianos como la estreptomicina o a principios activos de la familia de las tetraciclinas.
Cuando el tratamiento se efectúa vía inyectable se obtienen buenos resultados con cualquiera de los antibióticos citados.
Es la dificultad de un tratamiento individualizado lo que hace más práctico y efectivo medicar todo el colectivo de animales a través de la incorporación del antibiótico en el pienso.
Es muy importante tener en consideración las características farmacológicas de los distintos miembros de la familia de las tetraciclinas a la hora de establecer una dosificación eficaz para la bajada de presión de infección.
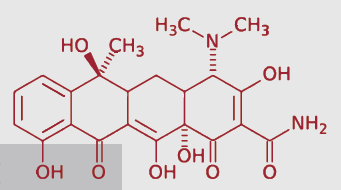
Figura 3. Las tetraciclinas se posicionan como el grupo antibiótico de elección en los programas de control farmacológico de la Leptospirosis.
Mientras que algunas moléculas como la oxitetraciclina y la clortetraciclina tienen absorciones intestinales del orden del 8-25%, la doxiciclina y la tetraciclina presentan una absorción del 65-70%.
Otra característica a tener en cuenta, son los parámetros farmacocinéticos de cada antibiótico. En este aspecto, la doxiciclina presenta una alta tasa de unión a proteínas plasmáticas, lo que hace que quede una menor fracción de fármaco libre y activo en circulación y su dosificación sea poco precisa.
Se puede considerar la tetraciclina como molécula de elección, debido a su elevada absorción intestinal y su poca unión a proteínas plasmáticas, hecho que contribuye a aumentar el volumen de distribución y permite una mayor concentración del fármaco en tejido renal
Aunque Leptospira sea altamente sensible a la acción de las tetraciclinas, cabe recordar que la infección por serovares adaptados suele ser crónica debido a su permanencia en riñón.
Por este motivo, en cuadros producidos por los serovares Pomona o Bratislava las recidivas son un hecho común.
Las experiencias en vacunación frente Leptospira llegan a la conclusión de que se confiere una alta inmunidad de base celular que estimula la síntesis de anticuerpos aglutinantes por parte del organismo del cerdo.
De este modo, las leptospiras son excretadas de forma aglutinada perdiendo su capacidad de movimiento.
Debido a que la viabilidad de Leptospira en el ambiente se ve altamente influenciada por su capacidad móvil, la presencia de anticuerpos aglutinantes circulantes, es suficiente para impedir nuevas infecciones a nivel de piara.