Nutrición porcina
Optimización de la vitalidad porcina: conexión con la riboflavina (Vitamina B2)
GUARDAR EN LA LIBRERÍA PDFPara leer más contenidos de Revista porciNews Junio 2025
Nutrición porcina
Para leer más contenidos de Revista porciNews Junio 2025
Las vitaminas B son esenciales para diversos procesos fisiológicos y la riboflavina (vitamina B2) es clave para mantener el equilibrio metabólico, promover el crecimiento y favorecer el bienestar animal(1,2).
Actúa como precursor de coenzimas que impulsan reacciones redox esenciales para la producción de energía, el crecimiento y la regulación inmunitaria(3,4).

La riboflavina es precursora de dos coenzimas esenciales:


Estas coenzimas son fundamentales para el transporte mitocondrial de electrones que son vitales para metabolizar carbohidratos, grasas y proteínas, lo que conduce a la producción de trifosfato de adenosina (ATP), el principal vector energético de las células(2,9,10).
Sin suficiente riboflavina, las funciones metabólicas se alteran, lo que provoca retrasos en el crecimiento, problemas reproductivos y una menor eficiencia alimentaria(2,11).
Las plantas son las principales productoras de vitamina B2, por lo tanto, los piensos de origen vegetal son la principal fuente de riboflavina en las dietas porcinas(12,13).


FUNDAMENTOS BIOQUÍMICOS
La riboflavina tiene una estructura única que incluye un anillo de isoalloxazina y una cadena de ribitol(4), lo que le permite convertirse en FMN y FAD.
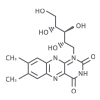
|
La riboflavina también contribuye al metabolismo de otras vitaminas:



CAPTACIÓN Y DISTRIBUCIÓN DE LA RIBOFLAVINA
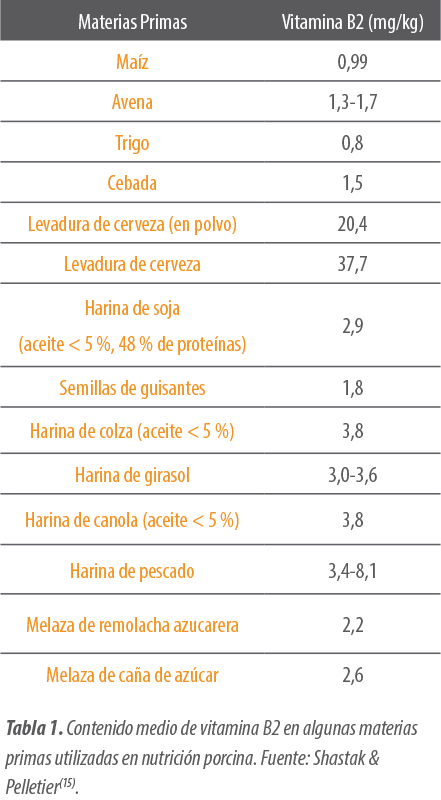
Las dietas para cerdos incluyen cereales y harinas proteicas con diferentes niveles de riboflavina(14,15)(Tabla 1). Debido a las variaciones naturales, la baja biodisponibilidad y la degradación de estos ingredientes, es necesario suplementar con riboflavina producida por fermentación a través de premezclas para satisfacer los requerimientos en la nutrición porcina(14,27).
|
|
 |
 |

NECESIDADES DE RIBOFLAVINA
Investigaciones centrándose en los niveles óptimos para cada fase de producción porcina han mejorado nuestra comprensión sobre las necesidades vitamínicas de los cerdos.

|
 |
Estudios con riboflavina no muestran efectos adversos incluso a dosis elevadas, lo que confirma su seguridad, especialmente cuando se usa a niveles recomendados(38,39).

CONSECUENCIAS DEL DÉFICIT DE RIBOFLAVINA (ARIBOFLAVINOSIS)

EFECTOS DE LA SUPLEMENTACIÓN CON RIBOFLAVINA
La riboflavina es crucial para el sistema glutatión peroxidasa (GSH-Px), que protege los tejidos en contra del estrés oxidativo(51).
|
|
Brady et al.(51) demostraron que la deficiencia de riboflavina en lechones reducía la actividad de las enzimas antioxidantes y los niveles de selenio.



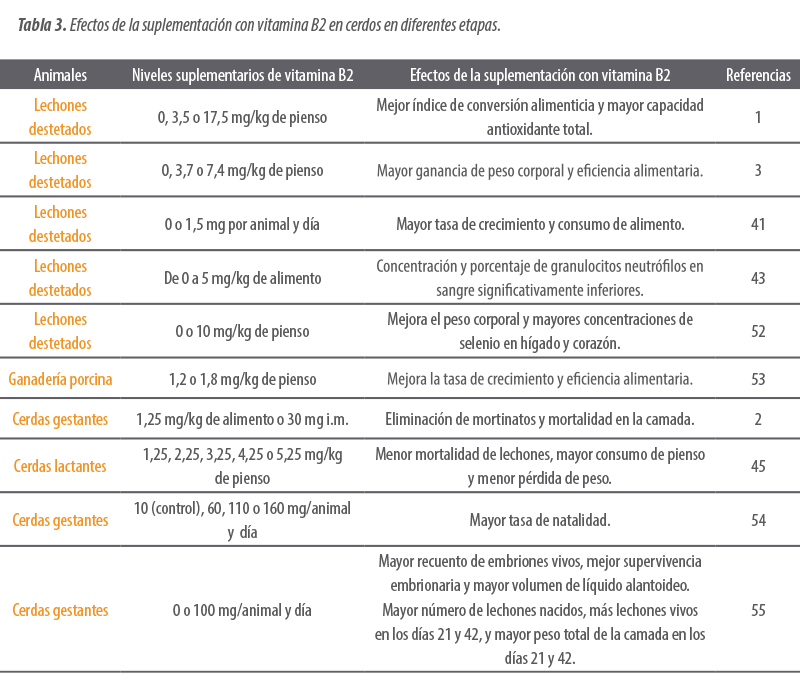
La Tabla 3 resume los efectos de la suplementación con riboflavina en cerdos.

En el proceso de fermentación, Ashbya gossypii produce riboflavina de gran pureza y estabilidad.






 |
Este artículo se basa en la publicación: Shastak, Y., & Pelletier, W. (2024). Exploring the role of riboflavin in swine well-being: A literature review. Porcine Health Management, 10, 46. https://doi. org/10.1186/s40813-024-00399-1
1. Qin Y., Zhou J., Xiong X., Huang J., Li J., Wang Q., Yang H., and Y. Yin. Effect of riboflavinon intestinal development and intestinal epithelial cell function of weaned piglets. J. Anim. Physiol. Anim. Nutr. 2023;107(2):518–28.
2. Torreggiani C., Maes D., Franchi L., Raffi V., Borri E., Prosperi A., Chiapponi C., and A. Luppi. Premature farrowing and stillbirths in two organic sow farms due toriboflavin deficiency. Porcine Health Manag. 2023;9(1):12.
3. Lutz T.R., and T.S. Stahly. Dietary riboflavin needs for body maintenance and body protein and fat accretion in pigs. Iowa State University Animal Industry Report 1(1), 1999.
4. Suwannasom N., Kao I., Pruß A., Georgieva R., and H. Bäumler. Riboflavin: the health benefits of a forgotten natural vitamin Int. J. Mol. Sci. 2020;21(3):950.
5. Shastak Y., and W. Pelletier. Vitamin a supply in swine production: a review of current science and practical considerations. Appl. Anim. Sci. 2023;39(5):289–305.
6. van Kempen T.A.T.G., and R.T. Zijlstra. Eat like a pig to combat obesity. Metabolites 2023;13(3):420.
7. Giguère G., and M. Matte. Erythrocyte glutathione reductase activity and riboflavin nutritional status in early-weaned piglets. Int. J. Vitam. Nutr. Res. 2002;72(6):383–7.
8. Abbas C.A., and A.A. Sibirny. Genetic control of biosynthesis and transport of riboflavin and flavin nucleotides and construction of robust biotechnological producers. Microbiol. Mol. Biol. Rev. 2011;75(2):321–60.
9. Udhayabanu T., Manole A., Rajeshwari M., Varalakshmi P., Houlden H., and B. Ashokkumar. Riboflavin responsive mitochondrial dysfunction in neurodegenerative diseases. J. Clin. Med. 2017;6(5):52.
10. Shastak Y., and W. Pelletier. From metabolism to vitality: uncovering riboflavin’s importance in poultry nutrition. Animals. 2023b;13(22):3554.
11. Patek A.J., Post J., and J. Victor. Riboflavin deficiency in the pig. Am. J. Physiol 1941;133(1):47–55.
12. Supplee G.C., Jensen O.G., Bender R.C., and O.J. Kahlenberg. Factors affecting the riboflavin content of the liver. J. Biol. Chem. 1942;144(1):79–85.
13. Fischer M., and A. Bacher. Biosynthesis of vitamin B2 in plants. Physiol. Plant. 2006;126:304–18.
14. Witten S. Characterization of organic cereals and grain legumes as feedstuffs for monogastric animals: Effects of variety and environmental conditions on the contents of crude nutrients, amino acids, thiamine, riboflavin, and in vitro digestibility of crude protein and amino acids. PhD Thesis, Georg-August-Universität Göttingen, Germany, 2018.
15. Shastak Y., and W. Pelletier. Exploring the role of riboflavin in swine well-being: A literature review. Porcine Health Manag. 2024;10:46.
16. Leone P., Galluccio M., Brizio C., Barbiroli A., Iametti S., Indiveri C., and M. Barile. The hidden side of the human FAD synthase 2. Int. J. Biol. Macromol. 2019;138:986–95.
17. Rivero M., Boneta S., Novo N., Velázquez-Campoy A., Polo V., and M. Medina. Riboflavin kinase and pyridoxine 5’-phosphate oxidase complex formation envisages transient interactions for FMN cofactor delivery. Front. Mol. Biosci. 2023;10:1167348.
18. Balasubramaniam S., and J. Yaplito-Lee. Riboflavin metabolism: role in mitochondrial function. J. Translat. Genet. Genom. 2020;4(4):285–306.
19. Curtabbi A., and J.A. Enríquez. The ins and outs of the flavin mononucleotide cofactor of respiratory complex I. IUBMB Life. 2022;74:629–44.
20. Kohlmeier M. Chapter 10 – Water-soluble vitamins and non-nutrients. In: M. Kohlmeier, Nutrient Metabolism (Second Edition), Academic Press. 2015; 567–671.
21. McCormick D.B. Two interconnected B vitamins: Riboflavin and pyridoxine. Physiol Rev. 1989;69:1170–98.
22. Mic F.A., Molotkov A., Fan X., Cuenca A.E., and G. Duester. RALDH3, a retinaldehy de dehydrogenase that generates retinoic acid, is expressed in the ventral retina, otic vesicle and olfactory pit during mouse development. Mech. Dev. 2000;97(1– 2):227–30.
23. Napoli J.L. Post-natal all-trans-retinoic acid biosynthesis. Methods Enzymol. 2020;637:27–54.
24. Shastak Y., Gordillo A., and W. Pelletier. The relationship between vitamin A status and oxidative stress in animal production. J. Appl. Anim. Res. 2023;51(1):546–53.
25. Shastak Y., and W. Pelletier. The role of vitamin A in non-ruminant immunology. Front. Anim. Sci. 2023d;4:1197802.
26. Wan L., Li Y., Zhang Z.Z., Sun Y., and R. Li. Methylenetetrahydrofolate reductase and psychiatric diseases. Transl. Psychiatry. 2018;8:242.
27. Dove R., and D.A. Cook. Water-soluble vitamins in swine nutrition. In: Lewis A.J., Southern L.L. Swine Nutrition. New York, NY, USA: CRC. 2000; 315–56.
28. NAS (National Academy of Sciences). Dietary reference intakes for thiamin, riboflavin, niacin, vitamin B6, folate, vitamin B12, pantothenic acid, biotin, and choline. Institute of Medicine (US). Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its panel on Vitamins, and Choline. Washington (DC): National Academies Press (US); 1998.
29. Peechakara B.V., Sina R.E., and M. Gupta. Vitamin B2 (riboflavin). Treasure Island (FL):StatPearls Publishing, 2024.
30. Barile M., Giancaspero T.A., Leone P., Galluccio M., and C. Indiveri Riboflavin transport and metabolism in humans. J. Inherit. Metab. Dis. 2016;39(4):545–57.
31. McCormick, D.B. Riboflavin. In: Wexler P. Encyclopedia of Toxicology (Third Edition), Academic Press. 2014;128-129.
32. Cho J.H., Lu N., and M.D. Lindemann. Effects of vitamin supplementation on growth performance and carcass characteristics in pigs. Livest. Sci. 2017;204:25–32.
33. Santos R.K., Novais A., Borges D., Alves J., Dario J., Frederico G., Pierozan C.R., Batista J.P., Pereira M. Jr, and C. Silva. Increased vitamin supplement to sows, piglets and finishers and the effect in productivity. Animal. 2020;4:86–94.
34. Yang P., Zhao J., Wang H., Li L., and Y. Ma. Effects of vitamin forms and levels on vitamin bioavailability and growth performance in piglets. Appl Sci.2020;10:4903.
35. NASEM (National Academies of Sciences, Engineering, and Medicine). Nutrient Requirements of Swine. 12th rev. ed. National Academy Press, 2012.
36. Hinson R.B., McCormick K.A., Moser R.L., Ackerman M.A., Main R.G., and J.A. Mahoney. Reduced vitamin supplementation with fat-soluble vitamins A, D, and E added at National Research Council requirements may not be adequate for optimal sow and progeny performance. J. Swine Health Prod. 2022;30:79–94.
37. Dalólio F.S., Oliveira J.P., Rostagno H.S., Albino L.F.T., Silva C.C., and C. Lozano. Effect of increasing levels of fat-soluble and water- soluble vitamins on improving performance and plasma vitamin concentration in modern hybrids pig’s growth and finishing phase. Arq. Bras. Med. Vet. Zootec. 2023;75(2):303–12.
38. EFSA FEEDAP Panel (EFSA Panel on Additives and Products or Substances used in Animal Feed). 2014. Scientific Opinion on the safety and efficacy of vitamin B2 (80%) as riboflavin produced by Bacillus subtilis for all animal species, based on a dossier submitted by VITAC EEIG. EFSA J. 2014;12(1):3531.
39. EFSA FEEDAP Panel (EFSA Panel on Additives and Products or Substances used in Animal Feed), Rychen G, Aquilina G, Azimonti G, Bampidis V, Bastos ML, Bories G, Chesson A, Cocconcelli PS, Flachowsky G, Gropp J, Kolar B, Kouba M, López-Alonso M, López Puente S, Mantovani A, Mayo B, Ramos F, Saarela M, Villa RE, Wester P, Costa L, Dierick N, Glandorf B, Herman L, Kärenlampi S, Leng L, Tebbe C, Aguilera J, Manini P, Tarrés-Call J, Wallace RJ. 2018. Scientific Opinion on the safety and efficacy of vitamin B2 (riboflavin) produced by Ashbya gossypii DSM 23096 for all animal species based on a dossier submitted by BASF SE. EFSA J. 2018;16(7):5337.
40. Krider J.L., Terrill S.W., and R.F. VanPoucke. Response of weanling pigs to various levels of riboflavin. J. Anim. Sci. 1949;8:121–5.
41. Lehrer W.P., and A.C. Wiese. Riboflavin deficiency in baby pigs. J. Anim. Sci. 1952;11(2):244–50.
42. Hughes E.H. The minimum requirement of riboflavin for the growing pig: two figures. J. Nutr. 1940;20(3):233–8.
43. Mitchell H.H., Johnson B.C., Hamilton T.S., and W.T. Haines. The riboflavin requirement of the growing pig at two environmental temperatures. J. Nutr. 1950;41:317–37.
44. Miller C.O., Ellis N.R., Stevenson J.W., and R.W. Davey. The riboflavin requirement of swine for reproduction. J. Nutr. 1953;51:163.
45. Frank G.R., Bahr J.M., and R.A. Easter. Riboflavin requirement of lactating swine. J. Anim. Sci. 1988;66(1):47–52.
46. NASEM (National Academies of Sciences, Engineering, and Medicine). Nutrient Requirements of Swine. 11th rev. ed. National Academy Press,1998.
47. Ensminger ME, Bowland JP, Cunha TJ. Observations on the thiamine, riboflavin, and choline needs of sows for reproduction. J. Anim. Sci. 1947;6(4):409–23.
48. Manole A., Jaunmuktane Z., Hargreaves I., Ludtmann M.H.R., Salpietro V., Bello O.D., et al. Clinical, pathological and functional characterization of riboflavin responsive neuropathy. Brain. 2017;140(11):2820–37.
49. Anonymous. Riboflavin deficiency in swine. Nutr. Rev. 1945;3(5):141–2.
50. Ellis N.R. Riboflavin in swine nutrition. Nutr. Rev. 1955;13(11):330–1.
51. Brady P.S., Brady L.J., Parsons M.J., Ullreyand D.E., Miller E.R. Effects of riboflavin deficiency on growth and giutathione peroxidase system enzymes in the baby pig. J. Nutr. 1979;109:1615.
52. Parsons M.J., Ku P.K., Ullrey D.E., Stowe H.D., Whetter P.A., and E.R. Miller. Effects of Riboflavin supplementation and selenium source on selenium metabolism in the young pig. J. Anim. Sci. 1985;60(2):451–61.
53. Miller C.O., and N.R. Ellis. The riboflavin requirements of growing swine. J. Anim. Sci.1951;10(4):807–12.
54. Pettigrew J.E., El-Kandelgy S.M., Johnston L.J., and G.C. Shurson. Riboflavin nutrition of sows. J. Anim. Sci. 1996;74(9):2226–30.
55. Bazer F.W. Use of supplemental dietary riboflavin to increase fertility and/or prolificacy in animals. US patent US5063226A. IFI CLAIMS Patent Services;1990.