Los circovirus porcinos comprenden cuatro especies (PCV1-PCV4). El PCV1 se considera no patógeno, mientras que el papel del PCV4 en la etiología de enfermedades clínicas aún se está investigando. El PCV2 y el PCV3 son reconocidamente patógenos, aunque causan enfermedades distintas. En comparación con el PCV2, el PCV3 presenta una baja identidad de aminoácidos en ORF1 (48 %) y ORF2 (26 %) (Palinski et al., 2017; Phan et al., 2016).
El PCV3 presenta un amplio tropismo tisular, ya que se detecta en múltiples órganos y fluidos biológicos, como el corazón, los pulmones, los ganglios linfáticos, el cerebro, el suero, el semen (Ku et al., 2017) y el calostro (Kedkovid et al., 2018).
La presencia del virus en el semen, el calostro, los fetos abortados o momificados y la placenta facilita tanto la transmisión horizontal como la vertical.
La detección de una gran cantidad del virus presente en los fluidos orales (Qi et al. 2023) puede representar una herramienta para el monitoreo en las granjas. Estos hallazgos indican que el PCV3, además de presentar una amplia distribución sistémica, tiene el potencial de persistir y propagarse rápidamente en las granjas, contribuyendo a la aparición de casos clínicos y subclínicos.
El PCV3 se asoció por primera vez con la enfermedad clínica en cerdos en 2015, en cerdos con casos de dermatitis, síndrome de nefropatía porcina y fallos reproductivos (abortos) (Palinski et al., 2017), aunque hay pruebas de la circulación del virus muchos años antes.
En los últimos años, la aparición del PCV-3 ha suscitado preocupación debido a los informes sobre su asociación con trastornos reproductivos y en lechones, especialmente los recién nacidos (Palinski et al., 2017; Arruda et al., 2019). En 2015, se detectó el PCV-3 en una explotación con alta mortalidad de cerdas, abortos y signos clínicos compatibles con el síndrome de dermatitis y nefropatía porcina. El genoma viral se identificó inicialmente en fetos momificados y abortados (Palinski et al., 2017). El PCV-3 también se detectó en lechones recién nacidos afectados por temblor congénito mediante PCR en tiempo real (qPCR) y análisis filogenético (Chen et al., 2017). En estudios realizados en Brasil utilizando qPCR, se analizaron fetos momificados para detectar la presencia de PCV-2, PCV-3, parvovirus porcino y Leptospira spp. El PCV-3 fue el agente detectado con mayor frecuencia, presente en el 96,75 % (298/308) y el 97 % (270/276) de las muestras (Cezario et al., 2021; Dal Santo et al., 2020).
En Brasil, el virus fue diagnosticado como causante de abortos y lechones momificados mediante examen histopatológico, qPCR e hibridación in situ de los tejidos fetales. Se observó que la recolección del mayor número posible de fetos abortados maximiza la posibilidad de un diagnóstico definitivo, ya que se pueden encontrar fetos de la misma camada que dan negativo al virus y no presentan lesiones.
Otro signo clínico que llama la atención cuando hay una infección viral circulante es que la tasa de mortinatos aumenta, pudiendo alcanzar el 10-15 % (observación práctica) (Figura 1).


Algunos lechones pueden no presentar orejas giradas caudalmente, debilidad muscular y/o neumonía intersticial, pero dan positivo en la qPCR y presentan lesiones histopatológicas discretas.
Aunque aún no se ha demostrado, se hipotetiza que la presentación de neumonía, así como los lechones débiles y las orejas giradas hacia atrás, pueden estar correlacionados con la carga viral y/o la cronicidad de la infección y, especialmente, con la intensidad de las lesiones musculares e incluso neurológicas.
En observaciones de campo, se ha observado que los lechones que presentan una menor intensidad de lesiones, especialmente signos clínicos respiratorios en los primeros días de vida, tienden a sobrevivir, pero presentan un desarrollo inferior en comparación con lechones de edades similares.
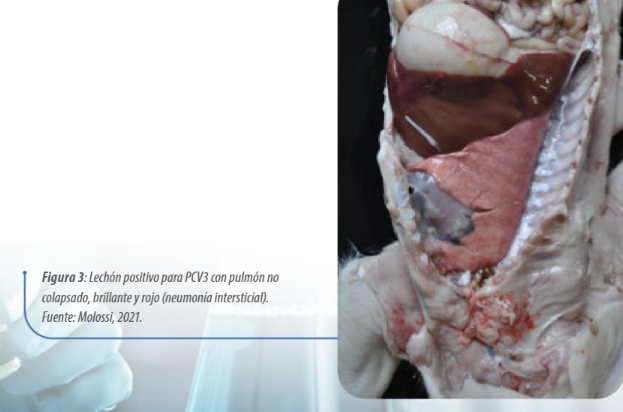
Macroscópicamente, los hallazgos que llaman la atención son la oreja girada caudalmente y la neumonía intersticial, caracterizada por pulmones no colapsados, brillantes, pesados y rojos (Figura 3).
Figura 3: Lechón positivo para PCV3 con pulmón no colapsado, brillante y rojo (neumonía intersticial).
Microscópicamente, se observa neumonía intersticial (Figura 4), miocarditis (Figura 5), miositis en varios músculos esqueléticos (Figura 6), encefalitis e inflamación perivascular, a veces asociada con vasculitis multisistémica (Figura 7).
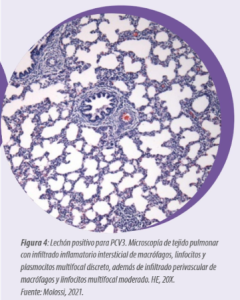
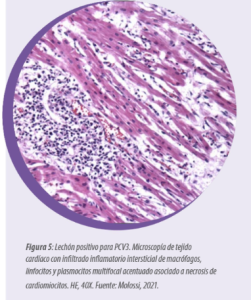
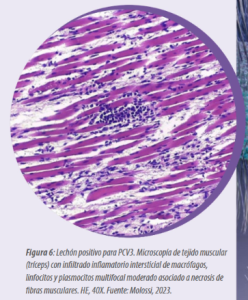
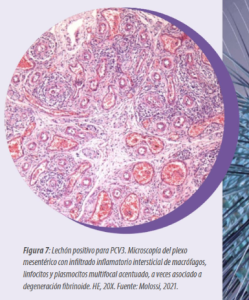
Las células inflamatorias implicadas son macrófagos, linfocitos y plasmocitos. Es importante destacar que estas lesiones varían de discretas a acentuadas, por lo que es necesaria una evaluación minuciosa de todos los tejidos. Estas lesiones microscópicas se observan en fetos abortados por PCV3 y en lechones recién nacidos y destetados.
El diagnóstico de la enfermedad es complicado, ya que el material genético del virus ya se ha detectado en cerdos sanos. Sin embargo, es posible realizar un diagnóstico preciso asociando el historial de la granja (abortos, momias, mortinatos, lechones con oreja girada caudalmente), cuadro clínico, lesiones macro y microscópicas asociadas a qPCR.
La hibridación in situ se considera una técnica confirmatoria, sin embargo, su implementación para el PCV3 aún no se ha producido en Brasil.
Otra técnica diagnóstica que se puede utilizar es la inmunohistoquímica, ya disponible en Brasil, que presenta una buena especificidad, pero cuya sensibilidad aún puede mejorarse. Es importante destacar que, para realizar el diagnóstico, se recomienda la recolección de todos los órganos para histopatología, especialmente:
- plexo mesentérico,
- sistema nervioso central,
- hígado,
- corazón,
- pulmones,
- músculos esqueléticos,
- riñones y
- bazo.
Para la realización de qPCR, existen controversias en la literatura, sin embargo, estudios previos brasileños han demostrado que no existe una diferencia significativa en la recolección de estos órganos de forma aislada o en forma de pool.
La recolección en forma de pool de tejidos acaba siendo la más recomendada debido a la maximización de la posibilidad de obtener un resultado más fiable.
La enfermedad causada por el PCV3 debe diferenciarse de otras que provocan abortos, momias, mortinatos, neumonía, miositis, miocarditis, inflamación perivascular y vasculitis multisistémica y encefalitis. Entre las causas se incluyen el circovirus porcino tipo 2, el parvovirus porcino, el pestivirus porcino atípico y el virus del síndrome reproductivo y respiratorio porcino.
El signo clínico de la oreja girada caudalmente puede confundirse con una afección denominada retraso del crecimiento intrauterino (RCIU). El RCIU se caracteriza por el crecimiento y desarrollo deficientes de los embriones y fetos y sus órganos, lo que se nota por un crecimiento desproporcionado del cerebro en relación con otros órganos fetales, cuando la camada es grande. El tamaño desproporcionado de la cabeza puede dar la impresión de orejas más grandes e insertadas caudalmente.
Aún quedan muchas cuestiones por resolver sobre la patogenia de la enfermedad, los impactos de la infección viral en los sistemas orgánicos de los cerdos y sus consecuencias, sin embargo, cabe destacar la importancia de realizar estudios que demuestren la prevalencia de la enfermedad causada por el PCV3 tanto en lechones como en animales adultos, así como su impacto económico, para que se desarrollen y apliquen medidas de prevención y control de la enfermedad.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en porciNews
REGISTRARME
















