La diarrea postdestete (DPD) en lechones tiene un enorme impacto económico a nivel mundial. Se caracteriza por un aumento de la mortalidad, pérdidas de peso significativas y retraso en el crecimiento, en combinación con un aumento de los costes de tratamiento, un mayor uso de antimicrobianos y una heterogeneidad de lotes más pronunciada2-8.
Se ha demostrado que Escherichia coli (E. coli) enterotoxigénico (ETEC) es la causa más importante de la DPD9,10. El patotipo ETEC se caracteriza por tener dos tipos de factores de virulencia:
 Fimbrias o adhesinas: permiten la adhesión a los enterocitos porcinos.
Fimbrias o adhesinas: permiten la adhesión a los enterocitos porcinos.
Las fimbrias que aparecen con más frecuencia en E. coli ETEC aislado de lechones con DPD son la F4 (K88) y la F189-11. Las fimbrias F5 (K99), F6 (987P) y F41 rara vez aparecen en los aislados de E. coli procedentes de la DPD9-14.
 Enterotoxinas: alteran la homeostasis de los fluidos en el intestino delgado. Esto da lugar a diarrea en los días posteriores al destete, lo que se traduce en deshidratación, pérdida de condición corporal y mortalidad1.
Enterotoxinas: alteran la homeostasis de los fluidos en el intestino delgado. Esto da lugar a diarrea en los días posteriores al destete, lo que se traduce en deshidratación, pérdida de condición corporal y mortalidad1.
Las principales enterotoxinas asociadas a ETEC en los cerdos son la toxina termolábil (LT), la toxina termoestable a (STa) y la toxina termoestable b (STb). En algunos casos excepcionales, las cepas patógenas producen ambas enterotoxinas y la toxina Shiga (Stx2e)9-11.
Si bien, la DPD se suele controlar mediante el uso de antimicrobianos, el desarrollo de resistencias de las cepas de E. coli y las nuevas regulaciones de la UE hacen necesario adoptar medidas de control alternativas, como la adaptación de las estrategias de alimentación o la inmunización.
Se ha estudiado la eficacia de diferentes estrategias nutricionales, como la adición de fibra dietética, la reducción de los niveles de proteína bruta, los cambios en la consistencia y el tamaño de las partículas del pienso, la suplementación de prebióticos, probióticos y ácidos Grasos de Cadena Media (AGCM) para minimizar la incidencia y la gravedad de la DPD y para mejorar la salud intestinal.
Además de las estrategias nutricionales, se están explorando otras estrategias preventivas1,15, entre ellas, la vacunación oral frente a E. coli.
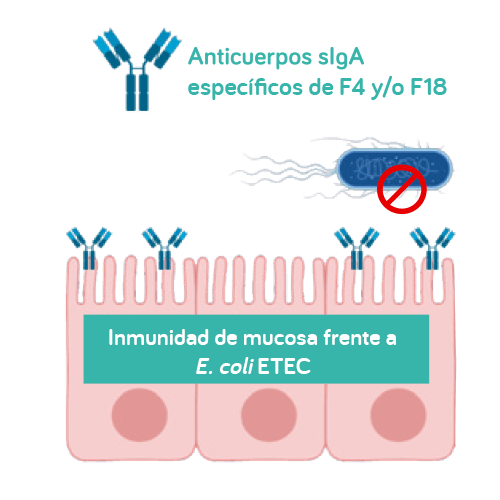
Para la vacunación frente a E. coli F4-ETEC y F18-ETEC, es esencial que se desarrolle una respuesta inmunitaria activa en la mucosa frente a F4 y F18. Esto implica la producción local de anticuerpos sIgA específicos de F4 y/o F18 que impidan que las F4-ETEC y F18-ETEC patógenas se adhieran a los receptores intestinales de F4 y F18, reduciendo así los signos clínicos de la DPD15.
| Recientemente, la vacunación con una vacuna viva no patógena de E. coli F4, o de E. coli F4 y F18, ha demostrado su eficacia frente a la DPD asociada a E. coli F4-ETEC, y a F4-ETEC + F18-ETEC16,17. |
Se llevó a cabo la vacunación oral de lechones utilizando una vacuna viva no patógena de E. coli F4/F18 (Coliprotec® F4/F8; Elanco Animal Health) en 10 granjas de ciclo cerrado con un número variable de cerdas (160-1.200 cerdas/ granja) en Bélgica y Países Bajos (abril 2018 – diciembre 2020) para prevenir la DPD asociada a E. coli enterotoxigénica F4 (ETEC) o F18-ETEC.
El análisis de los patotipos de E. coli presentes en las granjas reveló que 6 granjas eran positivas para E. coli F18-ETEC y 4 granjas eran positivas para E. coli F4-ETEC.
A lo largo del estudio, se distribuyeron 49.936 y 46.929 lechones en los grupos Control y Vacunado, respectivamente.
La vacuna viva no patógena frente a E. coli F4/F18 induce un rápido inicio de la inmunidad (7 días postvacunación) con una duración de 21 días postvacunación, lo que permite cubrir el período más crítico de la DPD1.
Un estudio de eficacia en el que se realizó un desafío experimental con E. coli F4, o con E. coli F4 y/o F18 a los 3 días del destete, mostró una reducción de la gravedad y la duración de la DPD y una reducción de la excreción fecal de F4-ETEC y F18- ETEC patógenos16,17.
Por ello, se vacunó a los lechones a partir de los 18 días de vida, durante la fase de lactación, para generar una inmunidad local protectora suficiente en el intestino en el momento de la aparición de los signos clínicos de la DPD.
|
La estrategia de vacunación se comparó con el enfoque terapéutico estándar en cada granja, recopilando al mismo tiempo datos sobre la ganancia media diaria (GMD), el índice de conversión (IC), la tasa de mortalidad y la incidencia del tratamiento con medicamentos antimicrobianos (TI100 = número de inyecciones individuales/ tratamiento para un total de 100 lechones durante 100 días) durante el periodo postdestete.
Las estrategias de alimentación específicas de la granja se mantuvieron, tanto en el grupo Control como en el tratado con la vacuna, con la única excepción de que la inclusión de ZnO se suspendió en ambos grupos de tratamiento. Dependiendo de la granja, se utilizaron programas de alimentación de una, dos o tres fases durante el periodo postdestete.
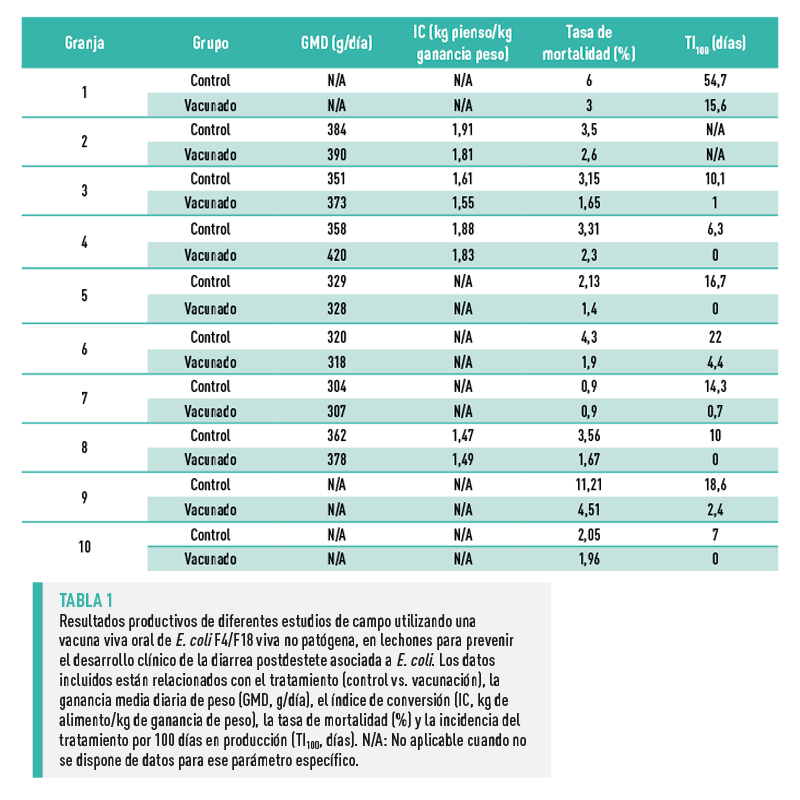
En la Tabla 1 se resumen los resultados productivos del estudio.
Los lechones de los grupos tratados con la vacuna presentaron una mejora significativa en IC, la tasa de mortalidad y la TI100 en comparación con el grupo de control. La GMD mejoró ligeramente y de forma no significativa en el grupo tratado con la vacuna.
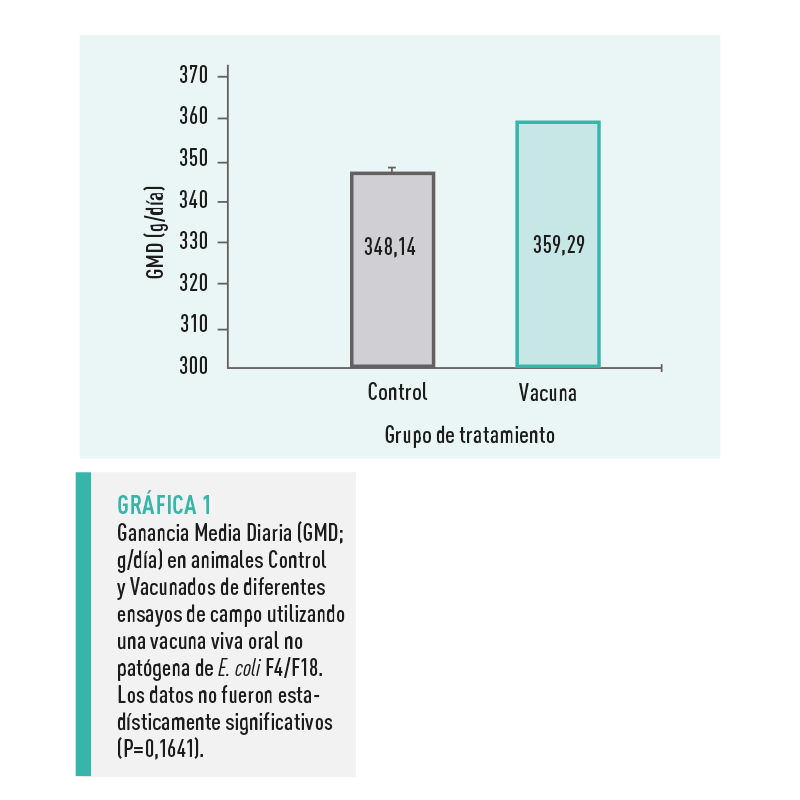
La GMD no fue significativamente mayor (359,29 ± 15,83 g/d; P=0,1641) en el grupo Vacunado en comparación con el grupo Control (348,14 ± 10,25 g/d) (Gráfica 1).
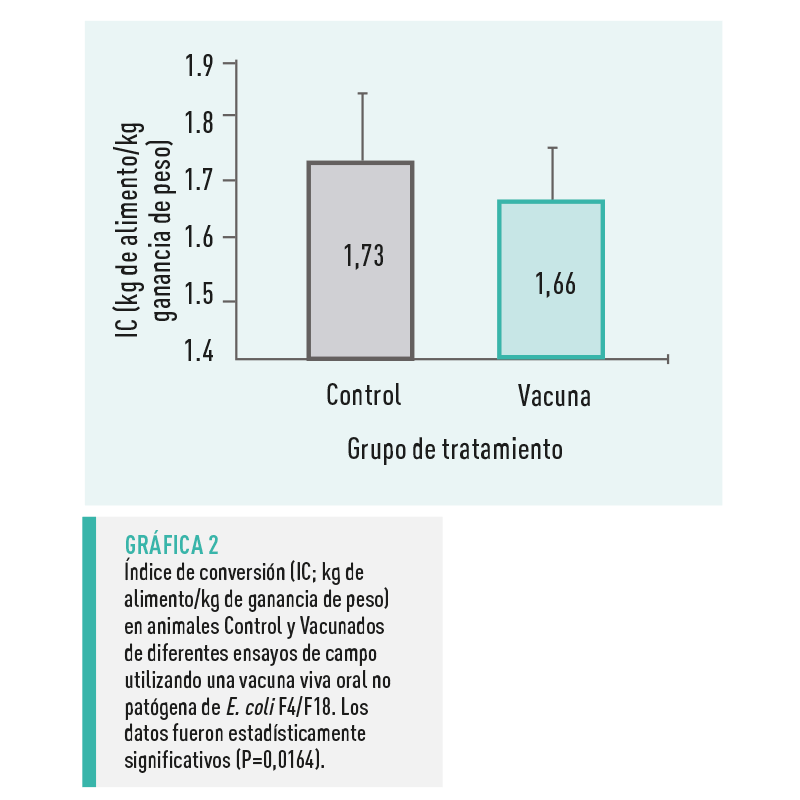
El IC fue significativamente menor (1,66 ± 0,09 kg de alimento/kg de ganancia; P=0,0164) en el grupo Vacunado en comparación con el grupo Control (1,72 ± 0,10 kg de alimento/kg de ganancia) (Gráfica 2).
Esta mejora de 0,06 en el rendimiento de los lechones supuso una ventaja económica aproximada de unos 3,7 céntimos de €/kg de ganancia o 1,05 kg menos de pienso/lechón para la misma ganancia de peso tras el destete.
| Teniendo en cuenta que el coste de la alimentación es uno de los aspectos más importantes en la producción, esto puede tener un impacto significativo en los ingresos netos de la granja durante la fase postdestete. |
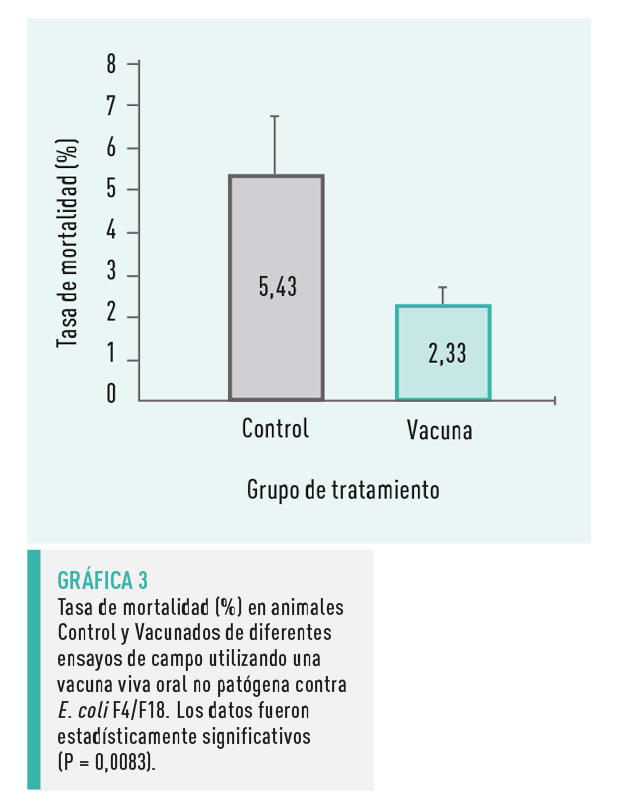
MORTALIDAD
La tasa de mortalidad fue significativamente menor (2,33 ± 0,42 %; P=0,0083) en el grupo Vacunado en comparación con el grupo de control (5,43 ± 1,39 %) (Gráfica 3).
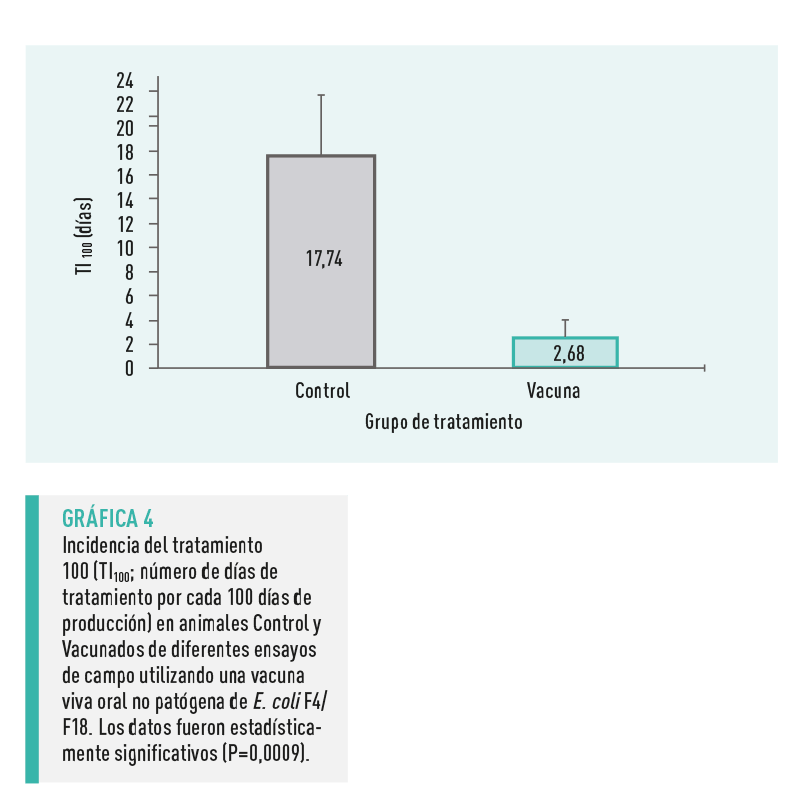
INCIDENCIA DE TRATAMIENTO
La T100 fue significativamente menor (2,68 ± 1,69 días; P=0,0009) en el grupo Vacunado en comparación con el grupo Control (17,74 ± 4,95) (Gráfica 4).
Esta reducción en el uso de antimicrobianos, unido al hecho de que no hubiera un descenso en la GMD, es un logro importante porque en la práctica muchos productores y veterinarios temen que se reduzca el rendimiento de los lechones cuando se reducen o suprimen los tratamientos con antimicrobianos y se sustituyen por tratamientos individuales.
Teniendo en cuenta las recientes decisiones del Parlamento Europeo y del Consejo (Reglamento 2019/6 de 11 de diciembre de 201818), la reducción del uso de antimicrobianos es un tema candente en la Unión Europea.
| El presente estudio demostró claramente que la reducción del uso de antimicrobianos, combinada con medidas preventivas adecuadas como la vacunación frente a patógenos específicos, permite mantener el mismo rendimiento de los lechones. |
El presente estudio demuestra la eficacia de una vacuna viva oral no patógena de E. coli F4/F18 (Coliprotec® F4/F8; Elanco Animal Health) para la inmunización activa de lechones frente a la DPD asociada a E. coli F4-ETEC y/o F18-ETEC en condiciones de campo.
Para varios parámetros productivos económicamente importantes, como el IC, la tasa de mortalidad y la TI100, la vacunación frente a E. coli resultó significativamente mejor en comparación con el enfoque terapéutico estándar.
La vacunación frente a la DPD asociada a E. coli F4-ETEC o F18-ETEC utilizando una vacuna viva oral no patógena de E. coli F4/F18 puede considerarse una buena alternativa para mejorar los resultados de rendimiento de los lechones tras el destete, al tiempo que se cumplen los nuevos requisitos europeos relativos al uso prudente de antimicrobianos en la producción porcina intensiva.
1. Fairbrother JM, Nadeau É, Gyles CL. Escherichia coli in postweaning diarrhoea in pigs: an update on bacterial types, pathogenesis, and prevention strategies. Anim Heal Res Rev. 2005; 6: 17-39.
2. Hoa NX, Kalhoro DH, Lu C. Distribution of serogroups and virulence genes of E. coli strains isolated from porcine post weaning diarrhoea in Thua Thien Hue province Vietnam. Tạp chí Công ngh Sinh học. 2013; 11: 665-672.
3. Lyutskanov M. Epidemiological characteristics of post-weaning diarrhoea associated with toxin-producing Escherichia coli in large intensive pig farms. Trakia J Sci. 2011; 9: 68-73.
4. Svensmark B, Jorsal SE, Nielsen K, Willeberg P. Epidemiological studies of piglet diarrhoea in intensively managed Danish sow herds. I. Pre-weaning diarrhoea. Acta Vet Scand. 1989; 30: 43-53.
5. Svensmark B, Nielsen K, Willeberg P, Jorsal SE. Epidemiological studies of piglet diarrhoea in intensively managed Danish sow herds. II. Post-weaning diarrhoea. Acta Vet Scand. 1989; 30: 55-62.
6. Tubbs RC, Hurd HS, Dargatz D, Hill G. Preweaning morbidity and mortality in the United States swine herd. Swine Heal Prod. 1993; 1: 21-28.
7. USDA. Part II. Reference of Swine Health and Health Management in the United States, 2000. USDA:APHIS:VS, CEAH, National Animal Health Monitoring System, Fort Collins, CO. 2002.
8. Zhang W, Zhao M, Ruesch L, Omot A, Francis D. Prevalence of virulence genes in Escherichia coli strains recently isolated from young pigs with diarrhoea in the US. Vet Microbiol. 2007; 123: 145-152.
9. Luppi A, Gibellini M, Gin T, Vangroenweghe F, Vandenbroucke V, Bauerfeind R, et al. Prevalence of virulence factors in enterotoxigenic Escherichia coli isolated from pigs with post-weaning diarrhoea in Europe. Porcine Health Manag. 2016; 2: 20-25.
10. Vangroenweghe F, Luppi A, Thas O. Prevalence of enterotoxigenic Escherichia coli pathotypes and virotypes isolated from piglets suffering from post-weaning diarrhea in Belgium and the Netherlands. Arch Vet Anim Sci. 2020; 2: 1-8.
11. Fairbrother JM, Gyles CL. Chapter 53: Colibacillosis. In: Diseases of Swine. 10th Edition. Eds. Zimmerman JJ, Karriker LA, Ramirez A, Schwartz KJ, Stevenson GW. Wiley-Blackwell. 2012; 723-749.
12. Chen X, Gao S, Jiao X, Liu XF. Prevalence of serogroups and virulence factors of Escherichia coli strains isolated from pigs with postweaning diarrhoea in eastern China. Vet Microbiol. 2004; 103: 13-20.
13. Frydendahl K. Prevalence of serogroups and virulence genes in Escherichia coli associated with postweaning diarrhoea and edema disease in pigs and a comparison of diagnostic approaches. Vet Microbiol. 2002; 85: 169-182.
14. Vu-Khac H, Holoda E, Pilipcinec E, Blanco M, Blanco JE, Mora A, et al. Serotypes, virulence genes, and PFGE profiles of Escherichia coli isolated from pigs with postweaning diarrhoea in Slovakia. BMC Vet Res. 2006; 2:13-20.
15. Melkebeek V, Goddeeris BM, Cox E. ETEC vaccination in pigs. Vet Immunol Immunopathol. 2013; 152: 37-42.
16. Fairbrother JM, Nadeau E, Bélanger L, Tremblay C-L, Tremblay D, Brunelle M, et al. Immunogenicity and protective efficacy of a single-dose live nonpathogenic Escherichia coli oral vaccine against F4-positive enterotoxigenic Escherichia coli challenge in pigs. Vaccine. 2017; 35: 353-360.
17. Nadeau E, Fairbrother JM, Zentek J, Bélanger L, Tremblay D, Tremblay C-L, et al. Efficacy of a single oral dose of a live bivalent E. coli vaccine against post-weaning diarrhoea due to F4 and F18-positive enterotoxigenic E. coli. Vet J. 2017; 226: 32-39.
18. Regulation (EU) 2019/6 of the European Parliament and of the Council of 11 December 2018 on veterinary medicinal products and repealing Directive 2001/82/EC. Official Journal of the European Union L. 4/43.