Vacunas frente a la Enfermedad de Glässer
Para leer más contenidos de Revista porciSapiens Octubre 2023
Para leer más contenidos de Revista porciSapiens Octubre 2023
| A lo largo de este artículo se revisa la práctica totalidad de las vacunas estudiadas para prevenir la enfermedad de Glässer y se comenta su eficacia o ineficacia, después de una breve descripción de la enfermedad y su agente etiológico, Glaesserella parasuis. |
LA ENFERMEDAD DE GLÄSSER
Entre los agentes patógenos secundarios habituales que integran el Complejo Respiratorio Porcino (término acuñado por Dee en 1996) se encuentra Glaesserella parasuis, una bacteria Gram negativa de la familia Pasteurellaceae, que suele comportarse como comensal de la cavidad nasal y las tonsilas, lugares anatómicos que coloniza rápidamente después del nacimiento de los lechones.
No se considera un patógeno per se, sino que el peligro aparece cuando se difunde a otras localizaciones, desencadenando cuadros septicémicos.

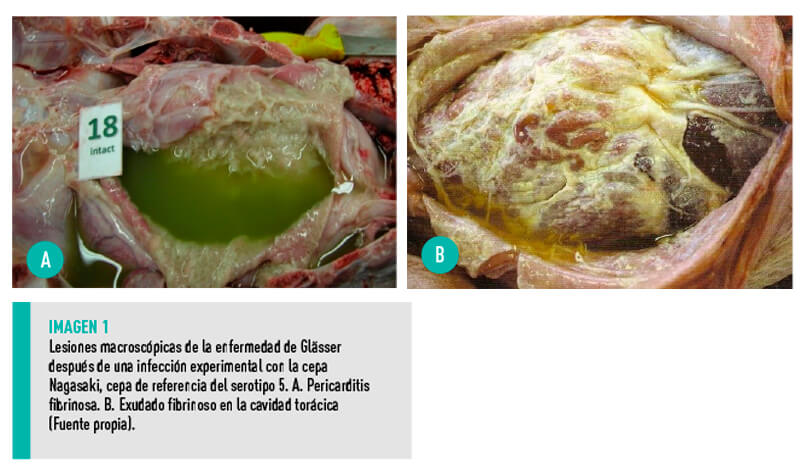
Es entonces cuando aparece la enfermedad de Glässer, que cursa con:
GLAESSERELLA PARASUIS DE CERCA
La enfermedad de Glässer se ha relacionado exclusivamente con la especie porcina hasta la primera década del siglo XXI, cuando fue descrita en jabalíes (Olvera y cols., 2007), una especie sinantrópica cada vez más habitual en las zonas metropolitanas, especialmente desde la pandemia del Coronavirus (SARS-CoV-2).

| No ha podido establecerse en G. parasuis una vinculación tan estrecha entre serotipo y virulencia como en Actinobacillus pleuropneumoniae, ya que una vez identificado el serotipo en esta última especie puede presumirse su grado de patogenicidad, mientras que en el caso de G. parasuis coexisten cepas de virulencia muy diversa dentro de cada serotipo, incluso aislados avirulentos. Por ello, el concepto de serotipo se encuentra en desuso, en favor del de patotipo, que se refiere a la virulencia de cada cepa. |
G. parasuis se adhiere a las células epiteliales, para lo que las cepas virulentas forman biopelículas que favorecen la colonización de la mucosa respiratoria porcina previa a la invasión. Además, cuenta con proteasas que degradan las IgAs de los epitelios respiratorios, al tiempo que soportan la fagocitosis.
Se ha relacionado el bloqueo de los mecanismos celulares de la inmunidad innata porcina con las características capsulares de G. parasuis, habiéndose observado concretamente la evasión de la fagocitosis por parte de los macrófagos alveolares, circunstancia que permite su persistencia en estas células y su posterior multiplicación en el parénquima pulmonar.
Se ha documentado la inducción de la “muerte celular programada” o apoptosis de las células epiteliales traqueales, con el daño tisular consiguiente. Asimismo, se ha comprobado igualmente la invasión de los endotelios vasculares, lo que permite el fenómeno septicémico posterior. Si a ello unimos la resistencia de la bacteria al sistema del complemento porcino, también debido a las características de su cápsula, se explica el desarrollo de las poliserositis, especialmente de las poliartritis.
Nuestro grupo de investigación (BACRESPI, nº 443 de los de la Universidad de León) ha descrito con detalle el sistema de captación del hierro porcino por parte de G. parasuis, un oligoelemento que debe obtener a partir de su hospedador, para lo que se sirve de dos proteínas de la membrana externa (Omps) de su pared celular.

NO SE HA DESCRITO HASTA LA FECHA NINGUNA HEMOLISINA PRODUCIDA POR G. PARASUIS
ANÁLISIS LABORATORIAL DE GLAESSERELLA PARASUIS
PREVENCIÓN Y CONTROL DE LA ENFERMEDAD DE GLÄSSER
Respecto a las medidas de prevención y control, debe recurrirse a las medidas habituales:


Cobra gran relevancia la apuesta por las vacunas, aunque no existe en el mercado una opción totalmente eficaz que proteja frente a todos los casos de enfermedad de Glässer, a pesar de los numerosos ensayos realizados.
| En el contexto global actual del uso restringido y racional de los antibióticos, el control de la enfermedad de Glässer debe asentarse en unas estrategias de manejo correctas y en unas medidas de bioseguridad estrictas. |
SE RECOMIENDA UN ENFOQUE HOLÍSTICO, QUE INTEGRE ESTAS MEDIDAS CON MÉTODOS DE DIAGNÓSTICO RÁPIDOS Y EFICACES QUE PERMITAN EL CONOCIMIENTO DE LAS CARACTERÍSTICAS ANTIGÉNICAS DE G. PARASUIS
VACUNACIÓN FRENTE A LA ENFERMEDAD DE GLÄSSER
Se ha barajado una gran cantidad de posibilidades sin que ninguna de las vacunas haya ofrecido unos resultados óptimos de protección absoluta, habiéndose relacionado los fallos, principalmente, con un nivel de protección insuficiente o con la ausencia total de protección cruzada entre los 15 serotipos.
Podemos clasificar las vacunas propuestas en cinco grupos:
VACUNAS INACTIVADAS O BACTERINAS
Las vacunas inactivadas o bacterinas fueron las primeras desarrolladas, como frente a casi cualquier enfermedad infecciosa.

Algunas bacterinas comerciales contienen hasta cuatro serotipos diferentes, los más prevalentes en una región determinada. Esto se debe a que proporcionan una protección cruzada escasa, que mejora incorporando los principales serotipos de una zona concreta.
Pires Espíndola y cols. (2019) demostraron que el polisacárido capsular representa el antígeno dominante de estos productos.

Entre sus limitaciones cabe destacar que:




A continuación, se resumen tres ensayos realizados con bacterinas:
|
VACUNAS “FANTASMA” (GHOST VACCINES)
Se ha ensayado una vacuna con bacterias completas de la cepa Nagasaki (de referencia del serotipo 5 y virulencia demostrada) desprovistas de sus cromosomas (ghost vaccines), generándose una respuesta humoral mayor que con la de las bacterinas tradicionales (Hu y cols., 2013).
VACUNAS ATENUADAS
El desarrollo de las vacunas atenuadas frente a G. parasuis no comenzó hasta la década pasada, debido a la escasa información disponible sobre sus factores de virulencia, lo que dificultó ostensiblemente su diseño.
LAS VACUNAS ATENUADAS SUELEN INDUCIR UNA PROTECCIÓN MÁS PROLONGADA QUE LA DE LAS VACUNAS INACTIVADAS
Las cepas utilizadas son mutantes para algún factor de virulencia demostrada, por ejemplo:
Estas bacterias mutantes perdieron patogenicidad, pero en ninguna publicación se aludió a la respuesta inmunitaria desarrollada.
VACUNAS DE ADN
Las vacunas de ADN son más seguras y estables que las anteriores ya que solo contienen este material genético en su composición.
Solo existen dos estudios sobre vacunas de ADN frente a G. parasuis (Fu y cols., 2012a,b), ambos con el material genético de la enzima gliceraldehído-3-fosfato deshidrogenasa (GAPDH).

VACUNAS DE SUBUNIDADES
Al no utilizar bacterias completas, las vacunas de subunidades también evitan cualquier riesgo de infección derivada de la vacunación.

Con diferencia, son las vacunas más estudiadas, con una treintena de publicaciones desde 2009. Sin embargo, solo unas pocas formulaciones han conseguido inducir niveles suficientes de anticuerpos protectores. Eso sí, nunca se ha pasado de un abordaje meramente experimental, en algunos casos ni siquiera sobre cerdos, sino sobre animales de experimentación.
| Los resultados aceptables de algunas moléculas sobre estos modelos deben ser confirmados necesariamente en cerdos, puesto que nuestro grupo cuenta con la amarga experiencia de que algunas Omps (Omp2, Omp5 y OmpD15), eficaces en un modelo murino, no funcionaron como inmunógenos en cerdos (Álvarez-Estrada y cols., 2018b) (Imagen 6). |
A continuación, repasamos algunas de las investigaciones con vacunas de subunidades.
Lo más reseñable de este estudio fue que por primera vez se afirmó que los roedores no constituían un modelo experimental adecuado para la reproducción experimental de la enfermedad de Glässer, lo que invalidaba la mayoría de los estudios vacunales así efectuados.
Entre las vacunas de subunidades basadas en las Omps destacan los estudios de dos grupos españoles.
| El equipo constituido por la Facultad de Veterinaria de León (César B. Gutiérrez Martín y colaboradores), junto con las Universidades de Calgary (grupo de Anthony B. Schryvers) y Passo Fundo (grupo de Rafael Frandoloso) han estudiado exhaustivamente las TbpA y TbpB, principalmente la segunda.
Potenciado el mutante con un aceite comercial, se obtuvo una protección total frente al desafío experimental de cerdos con la cepa silvestre, con activación de las dos ramas de la respuesta específica, lo que convertía esta cepa mutante en un candidato prometedor para una vacuna de subunidades, al funcionar mejor que algunas vacunas comerciales (Frandoloso y cols., 2015). |
McCaig y cols. (2016) consiguieron resultados similares al trabajar con vesículas de la membrana externa de G. parasuis.
Al analizar la estructura molecular de la TbpB en G. parasuis y en otras especies de la familia Pasteurellaceae, se clasificó en tres grupos (1, 2 y 3) como punto de partida de un experimento publicado el año pasado (Ramos Prigol y cols., 2022).

SE CONCLUYÓ POR PRIMERA VEZ QUE UNA VACUNA BASADA EN EL MUTANTE Y167 PODÍA RESULTAR EFICAZ FRENTE A OTRAS CEPAS CON Tbps ADSCRITAS A OTROS GRUPOS MOLECULARES, LO QUE SUPONDRÍA UN CIERTO GRADO DE PROTECCIÓN FRENTE A SEROTIPOS DIFERENTES, NO SOLO FRENTE AL HOMÓLOGO
En línea con el estudio anterior, González Fernández y cols. (2023) analizaron bioinformáticamente cepas clínicas castellanoleonesas adscritas a los grupos 1 o 3 de la TbpB, pero ninguna al grupo 2.

Existen ocho investigaciones relacionadas con la protección cruzada.

INMUNIDAD DE MUCOSAS FRENTE A LA ENFERMEDAD DE GLÄSSER
Debido a las características de transmisión de G. parasuis, junto con la inmunidad sistémica resulta fundamental la inmunidad de mucosas, especialmente la de la mucosa respiratoria.

Te puede interesar: Uso racional de antimicrobianos en porcino: Inhibidores de la síntesis proteica – Parte I
BIBLIOGRAFÍA
Álvarez-Estrada, Á., Gutiérrez-Martín, C.B., Rodríguez-Ferri E.F., Martínez-Martínez S. 2018a. Development of a quick and easy molecular method for differentiating Haemophilus (Glaesserella) parasuis from species belonging to the genus Actinobacillus. Int. J. Appl. Res. Vet. Med. 16: 180-185.
Álvarez-Estrada Á., Martínez-Martínez S., Gutiérrez-Martín C.B., García-Iglesias M.J., Pérez Martínez C., Yubero-Delgado S., Guizzo, J.A., Frandoloso R., Rodríguez-Ferri E.F. 2018b. Immunogenic characterization of vaccines based on Haemophilus parasuis Nagasaki strain, OmpP2, OmpP5 and OmpD15, in colostrum-deprived pigs experimentally challenged with the same strain. Res. Vet. Sci. 119: 292-301.
Álvarez-Estrada Á., Gutiérrez-Martín C.B., Rodríguez-Ferri E.F., Martínez-Martínez S. 2018c. Transcriptomics of Haemophilus (Gläesserella) parasuis serovar 5 subjected to culture conditions partially mimetic to natural infection for the search of new vaccine antigens. BMC Vet Res. 14: 326. An J., Cai J., Zhang B, Li Y. 2023. Pili subunit PilA contributes to the cytoadhesion of Glaesserell parasuis to host cells and provides immunoprotection. Appl. Environ. Microbiol. 26: e0200222.
Blanco-Fuertes M., Correa-Fiz F., López-Serrano S., Sibila M., Aragón V. 2022. Sow vaccination against virulent Glaesserella parasuis shapes the nasal microbiota of their offspring. Sci. Reports 12: 3357.
Bregón-Villahoz M., Gutiérrez-Martín C.B., Álvarez-Estrada Á., Rodríguez-Ferri E.F., Frandoloso R., Martínez-Martínez. 2017. Molecular study of an outer fragment of Haemophilus parasuis neuraminidase and utility with diagnostic and immunogen purposes. Res. Vet. Sci. 115: 463-469.
Dee SA. 1996. The porcine respiratory disease complex. Are subpopulations important? J. Swine Health Prod. 4: 147-149.
Dellagostin D., Klein R.L, Giacobbo I., Guizzo JA., Cerutti Dazzi C., Ramos Prigol, S., Gutiérrez- Martín C.B., Kreutz, L.C., Schryvers A.B., Frandoloso. 2023. TbPBY167A-based vaccine is safe in pregnant sows and induces high titers of maternal derived antibodies that reduce Glaesserella parasuis colonization in piglets. Vet. Microbiol. 276: 109630.
Frandoloso R., Martínez-Martínez S., Rodríguez-Ferri E.F., Yubero S., Rodríguez-Lázaro D., Hernández M., Gutiérrez-Martín C.B. 2013. Haemophilus parasuis subunit vaccines based on native proteins with affinity to porcine transferrin prevent the expression of proinflammatory chemokines and cytokines in pigs. Clin. Develop. Immunol. doi: 10.1155/2013/132432.
Frandoloso R., Martínez-Martínez S., Calmettes C., Fegan J., Costa E., Curran D., Yu R.H., Gutiérrez Martín C.B., Rodríguez-Ferri E.F., Moraes T., Schryvers A.B. 2015. Nonbinding site-directed mutants of transferrin binding protein B exhibit enhanced immunogenicity and protective capabilities. Infect Immun. 83: 1010-1038.
Frandoloso R., Chaudhuri S., Paraboni Frandoloso G.C., Yu R.H., Schryvers A.B. 2020. Proof of concept for prevention of natural colonization by oral needle-free administration of a microparticle vaccine. Front. Immunol. 11: 595320.
Fu S., Yuan F., Zhang M., Tan C., Chen H., Bei W. 2012a. Cloning, expression, and characterization of a cell wall surface protein, 6-phosphogluconate dehydrogenase, of Haemophilus parasuis. Res. Vet. Sci. 93: 57-62.
Fu S., Zhang M., Ou J., Liu H., Tan C., Liu J., Chen H., Bei W. 2012b. Construction and immune effect of Haemophilus parasuis DNA vaccine encoding glyceraldehyde-3-phosphate dehydrogenase (GAPDH) in mice. Vaccine 30: 6839-6841.
González-Fernández A., Gutiérrez-Martín C.B., Petrocchi-Rilo M., Pérez-Fernández E., Miguélez Pérez R., Frandoloso R., Martínez-Martínez S. 2023. Phylogenetic study and comparison of different TbpBs obtained from Glaesserella parasuis present in Spanish clinical isolates. Res. Vet. Sci. (aceptado).
Guo L., Xu L., Wu T., Fu S., Qiu Y., Hu C.A., Ren X., Liu R., Ye M. 2017. Evaluation of recombinant protein superoxide dismutase of Haemophilus parasuis strain SH0165 as vaccine candidate in a mouse model. Can. J. Microbiol. 63: 312-320.
Hau S.J., Luan S.L., Loving C.L., Nicholson T.L., Wang J., Peters S.E., Seilly D., Weinert L.A., Langford P.R., Rycroft A.N., Wren B.W., Maskell D.J., Tucker A.W., Brockmeier S.L. and on behalf of the BRaDP1T Consortium. 2020. Evaluation of the recombinant proteins RlpB and VacJ as a vaccine for protection against Glaesserella parasuis in pigs. BMC Vet. Res. 16: 167.
Hau S.J., Eberle K.C., Brockmeir S.L. 2021. Importance of strain selection in the generation of heterologous immunity to Glaesserella (Haemophilus) parasuis. Vet. Immunol. Immunophatol. 234: 110205.
He L., Wen X., Yan X., Ding L., Cao S., Huang X., Wu R., Wen Y. 2016. Effect of cheY deletion on growth and colonization in a Haemophilus parasuis serovar 13 clinical strain EP3. Gene 577: 96-100.
Hu M., Zhang Y., Xie F., Li G., Li J. Si W., Liu S., Hu S., Zhang Z, Shen N., Wang. 2013. Protection of piglets by a Haemophilus parasuis ghost vaccine against homologous challenge. Clin. Vaccine Immunol. 20: 795-802.
Kang L., Li J.X., Wang Y.C., Yuan X.F., Xu L.H., Jiang J., Min Z.Y., Jiang J.Y. 2015. Construction and biological characteristics of Wza-deficient mutant of Haemophilus parasuis. J. Agric.Biotechnol. 23: 806-815.
Li X-H., Zhao G.Z., Qiu L.X., Dai A.L., Wu W.W., Yang X.Y. 2015a. Protective efficacy of an inactive vaccine based on LY02 isolate against acute Haemophilus parasuis infection in piglets. Biomed. Res. International. http://dx.doi.org/10.1155/2015/649878.
Li M., Song S., Yang D., Li C., Li G. 2015b. Identification of secreted proteins as novel antigenic vaccine candidates of Haemophilus parasuis serovar 5. Vaccine 33: 1695-1701.
Li M., Li, C., Song, S., Kang, H., Yang, D., Li G. 2016. Development and antigenic characterization of three recombinant proteins with potential for Glässer´s disease prevention. Vaccine 34: 2251-2258.
Li M., Cai R.J., Song S., Jiang Z.Y., Li Y., Gou H.C., Chu P.P., Li C.L., Qiu H.J. 2017a. Evaluation of immmunogenicity and protective efficacy of recombinant outer membranae proteins of Haemophilus parasuis serovar 5 in a murine model. PLoS One 12: e0176537.
Li G., Xie F., Li J., Liu J., Li D., Zhang Y., Langford P.R., Li Y., Liu S., Wang C. 2017b. Identification of novel Haemophilus parasuis serovar 5 candidates using an immunoproteomic approach. J. Proteomics 163: 111-117.
Liu H., Xue Q., Zeng Q., Zhao Z. 2016. Haemophilus parasuis vaccines. Vet. Immunol. Immunopathol. 180: 53-58.
López-Serrano S., Neila-Ibáñez C., Costa-Hurtado M., Mahmmod Y., Martínez-Martínez J., Galindo Cardiel I.J., Darji A., Rodríguez F., Sibila M., Aragón V. 2021. Sow vaccination with a protein fragment against virulent Glaesserella (Haemophilus) parasuis modulates immunity traits in their offspring. Vaccines (Basel) 20: 534.
López-Serrano S., Mahmmod Y., Christensen D., Ebensen T., Guzmán C.A., Rodríguez F., Segalés J., Aragón V. 2023. Immune responses following neonatal vaccination with conserved F4 fragment of VtaA proteins from virulent Glaesserella parasuis aduvanted with CAF 01 or CDA. Vaccine 14: 100330.
Macedo N., Oliveira S., Torremorrell M., Rovira A. 2016. Immune response to oligopeptide permease A (OppA) protein in pigs naturally and experimentally infected with Haemophilus parasuis. Res. Vet. Sci. 107: 62-67.
Martín de la Fuente A.J., Tucker A.W., Navas J., Blanco M., Morris S.J, Gutiérrez-Martín C.B. 2007. Antimicrobial susceptibility patterns of Haemophilus parasuis from pigs in the United Kingdom and Spain. Vet. Microbiol. 120: 184-191.
McCaig W.D., Loving C.L., Hughers H.R., Brockmeier S.L. 2016. Characterization and vaccine potential of outer membrane vesicles produced by Haemophilus parasuis. Plos One 11: e0149132.
Olvera A., Segalés J., Aragón V. 2007. Update on the diagnosis of Haemophilus parasuis infection in pigs and novel genotyping methods. Vet. J. 174: 522-529.
Olvera A., Pina S., Pérez-Simó M., Aragón V., Segalés J. 2011. Immunogenicity and protection against Haemophilus parasuis infection after vaccination with recombinant virulence associated trimeric autotransporters. Vaccine 29: 2797-2802.
Pires Espíndola J., Balbinott N., Trevisan Gresller L., Machado G., Silene Klein C., Rebelatto R., Gutiérrez-Martín C.B., Kreutz L.C., Schryvers A.B., Frandoloso R. 2019. Molecular serotyping of clinical strains of Haemophilus (Glaesserella) parasuis brings new insights regarding Glässer´s disease outbreaks in Brazil. Peer J. doi 10.7717/peerj.6817.
Ramos Prigol S., Klein R., Chaudhuri S., Paraboni Frandoloso G., Guizzo J.A., Gutiérrez-Martín C.B., Schryvers A.B., Kreutz L.C., Frandoloso R. 2022. TbPBY167A-based vaccine can protect pigs against Glässer´s disease triggered by Glaesserella parasuis SV7 expressing TbpB cluster I. Pathogens 11: 766.
Rodrigues Peres M., Ebdon J., Purnell S., Taylor H. Potential microbial transmission pathways in rural communities using multiple alternative water sources in semiarid Brazil. Int. J. Hyg. Environ. Health 224: 113431.
Ren M.S., Wang Y., Yang Z.X., Yao X.P., Zeng X.J., Leng Y.Y., Zhang P.F. 2016. Construction and identification of Hfq deletion strain of Haemophilus parasuis. Chin. Vet. Sci. 46: 203-209.
Susan I.B., Crytal L.L., Michael A.M., Karen B.R., Tracy L.N., Barry S.W., Rodney B.B., Marcus Jr E.K. 2013. Virulence, transmission, and heterologous protection of four isolates of Haemophilus parasuis. Clin. Vaccine Immunol. 20: 7.
Wang X., Xu X., Wu Y., Li L., Cao R., Cai X., Chen H. 2013. Polysaccharide biosynthesis protein CapD is a novel pathogenicity-associated determinant of Haemophilus parasuis involved in serum resistance ability? Vet. Microbiol. 164: 184-189.
Wen Y., Yan X., Wen Y., Cao S., He L., Ding L., Zhang L, Zhou P., Wu R., Wen X. 2016. Immunogenicity of the recombinant HxuCBA proteins encoded by hxuCBA gene cluster of Haemophilus parasuis in mice. Gene 591: 478-483.
Zhang B., Yu Y., Zeng Z., Yupeng R., Yue H. 2014. Deletion of the rfa gene in Haemophilus parasuis SCo96 strain attenuates serum resistance, adhesion and invasion. Microb. Pathog. 74: 33-37.
Zhang Y., Li G., Xie F., Liu S., Wang C. 2017. Evaluation of glutathione-binding protein A of Haemophilus parasuis as a vaccine candidate in a mouse model. J. Vet. Med. Sci. 79: 184-187.
Zhao Z., Liu H., Xue Y., Chen K., Liu Z., Xue Q., Wang C. 2017. Analysis of efficacy obtained with a trivalent inactivated Haemophilus parasuis serovars 4, 5 and 12 vaccine and commercial vaccines against Glässer´s disease in piglets. Can. J. Vet. Res. 81: 22-27.
Zheng X., Yang X., Li X., Qiu G.H., Dai A., Huang Q., Huang C., Guo X. 2017. Omp16-based vaccine encapsulated by alginate-chitosan microspheres provides significant protection against Haemophilus parasuis in mice. Vaccine 35: 1417-1423.
[/registrados]
