Patología & Diagnóstico
10 Reglas para un programa integral de control del PRRS: El modelo del queso suizo – Parte 2
GUARDAR EN LA LIBRERÍA PDFPara leer más contenidos de Revista porciNews Noviembre 2022
Patología & Diagnóstico
Para leer más contenidos de Revista porciNews Noviembre 2022
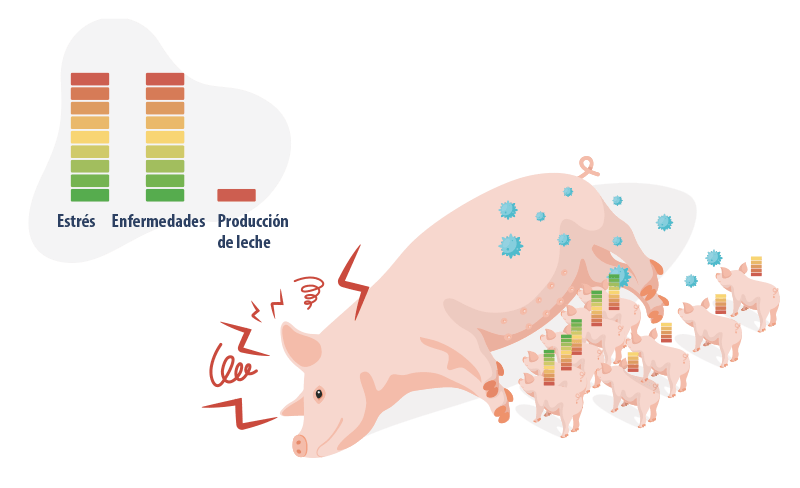
La prevención y el control de enfermedades como el PRRS depende de la ejecución de varias prácticas y estrategias en conjunto. Ninguna medida de protección es perfecta, pero cada una juega un papel fundamental en la reducción de los riesgos.
Durante años, este enfoque se ha conocido como el MODELO DEL QUESO SUIZO y fue propuesto originalmente por James T. Reason de la Universidad de Mánchester. Este modelo utiliza la imagen de las lonchas del queso para demostrar que cada capa tiene sus imperfecciones, representadas por sus agujeros. Sin embargo, la combinación de todas las capas (en el caso del PRRS, de una serie de reglas relacionadas con la bioseguridad interna) actúa como una barrera eficaz, protegiendo de forma más eficiente las explotaciones.
| En la primera parte de este artículo, se abordaron las primeras 5 reglas para lograr un control integral del PRRS en las granjas porcinas. En la segunda parte, repasamos las 5 reglas restantes para alcanzar este objetivo. |

El flujo correcto de animales comienza en la sala de partos cuando los lechones nacidos en el mismo grupo se destetan a la vez para crear lotes de animales con una edad similar.



| El movimiento de lechones de mayor edad de un lote a otro aumenta la probabilidad de transmisión de enfermedades entre animales de diferentes edades y con diferentes estatus inmunológicos para PRRS y otros patógenos3. |

Los sistemas Todo Dentro/Todo Fuera mantienen a los cerdos dentro del mismo lote a medida que avanzan por las diferentes fases de producción.

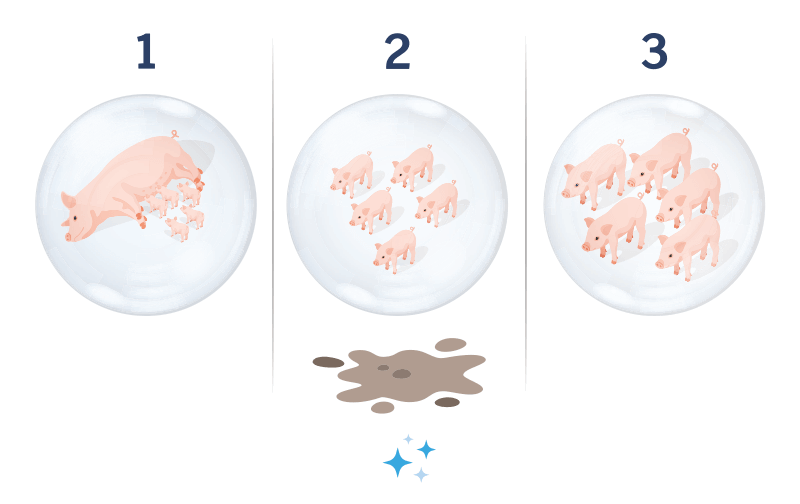
El método de manejo de cerdos Todo Dentro/Todo Fuera parece simple, pero es una de las reglas más difíciles de implementar debido a la variabilidad en los parámetros de producción, como el número de cerdos por lote, el rango de peso y las tasas de crecimiento.




En sistemas de producción bien diseñados, unas instalaciones correctamente dimensionadas permiten a los productores alojar cada lote de producción en naves o salas separadas con la densidad de animales adecuada, realizando así una gestión correcta del flujo Todo Dentro/Todo Fuera.

El flujo Todo Dentro/Todo Fuera puede verse afectado por factores como una fuerte variación en el tamaño del lote o por la presencia de enfermedades.
 |




Después del parto, los lechones reciben inmunidad por parte de la cerda a través del calostro y de la leche, lo que los hace inmunes a la mayoría de patógenos a los que ha estado expuesta la madre. Sin embargo, esta protección inmunitaria comienza a disminuir en los lechones inmediatamente después del destete.

Varios factores pueden inhibir o desafiar la respuesta inmunitaria del lechón en crecimiento, entre ellos:



| Asegurar la separación de los lotes de lechones en crecimiento de las cerdas protege a éstas de posibles enfermedades. |


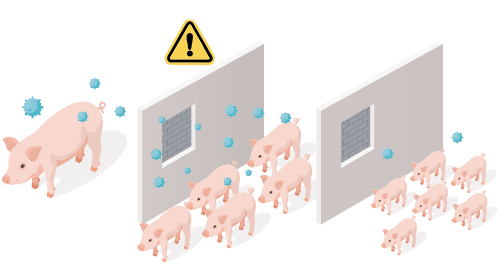

Es necesario mantener un flujo de entrada de cerdas de reposición para mantener el censo de la granja con una media de edad equilibrada, lo que repercute en la productividad. Como resultado, una de las estrategias más importantes para un correcto desarrollo de las primerizas es un buen proceso de aclimatación sanitaria de las mismas.

Asegurar una inmunización bien controlada frente al PRRS y la exposición de las primerizas durante su período de cuarentena o adaptación es clave para protegerlas frente a los virus de campo y prepararlas para las infecciones naturales que probablemente experimentarán en las granjas endémicas.


| La protección que ofrecen las vacunas vivas modifi cadas se considera parcial frente a cepas heterólogas de PRRSV. Sin embargo, en general, los cerdos vacunados experimentan menos signos clínicos y una viremia de menor duración en comparación con los lechones que se infectan con cepas de campo12. |

REFERENCIAS BIBLIOGRÁFICAS
1. Kraft, C. et al. 2019. PLoS ONE 14 (10): e0223060.
2. Geldhof, M.F. et al., 2013. Vet Microbiol. 167(3–4):260–71.
3. Maes, D. et al., 2009. Vet. Microbiology, 126 (4), pp.297.
4. Clark, L. et al., 1991. Vet. Med. 86, 539 543-550.
5. Rathkjen, P. et al., 2017. Acta Vet Scand. 59:4
6. Filippitzi, M.E., 2017. Transbound Emerg Dis. 00:1–18.
7. Nathues, H. et al., 2014. Transbound Emerg Dis. Aug;61(4):316-28.
8. Klinge, K.L., 2009. Virol J. 6:177.
9. Cho, J.G. et al., 2006. Can J Vet Res. 70:297–301
10. Evans, C.M. et al., 2010. Prev Vet Med. 93:248–257.
11. Pileri, E., & Mateu, E. 2016. Vet Res 47:108
12. Cano, J.P. et al., 2007. Vaccine 462;25(22):4382–91.