Para leer más contenidos de Revista porciSapiens Julio 2025
Para leer más contenidos de Revista porciSapiens Julio 2025
Las diarreas en lactación siguen siendo uno de los principales desafíos sanitarios en maternidad, debido a su compleja etiología y al impacto económico que conllevan. En su aparición confluyen patógenos clásicos y emergentes, cuya relevancia se ve acentuada por los cambios en el manejo, la genética y la medicación. Estos factores han modificado el equilibrio previo, dificultando el control eficaz de la enfermedad.
PATOLOGÍA ENTÉRICA DIGESTIVA Y CONDICIONES CAMBIANTES QUE FAVORECEN AL PATÓGENO
La condición dinámica de la producción porcina, con cambios legislativos, de manejo, genética o medicación, altera las reglas del juego en el control de diferentes patologías, entre ellas las infecciosas.
En este sentido, la restricción y limitación del uso de antimicrobianos ha supuesto un nuevo paradigma en el impacto de las enfermedades digestivas, con un incremento de la incidencia y gravedad de las patologías en todas las fases productivas.
Más específico de la lactación es el impacto de nuevas genéticas hiperprolíficas, que aumentan el tamaño de camada, pero limitan la disponibilidad de calostro y la viabilidad de los lechones, comprometiendo su resistencia a infecciones en edades tempranas.
| En este artículo, aprovechando datos recientes de estudios del grupo DIGESPORC y, basándonos en la experiencia acumulada por nuestro equipo, revisamos la situación actual del Complejo Entérico Porcino (CEP) en la fase de lactación, haciendo hincapié en aquellas patologías clave y ofreciendo información contrastada de aquellas que puede que no lo sean tanto. |

EL COMPLEJO ENTÉRICO PORCINO EN EL PERIODO DE LACTACIÓN
La diarrea neonatal es la enfermedad más frecuente y con mayor impacto económico en las salas de maternidad, pudiendo alcanzar un coste económico de hasta 20 € por camada afectada.
La enfermedad entérica en esta etapa está, generalmente, causada por más de un microorganismo, principalmente virus y bacterias que interactúan entre sí, así como con factores ambientales, nutricionales y prácticas de manejo inadecuadas que facilitan su aparición.
CUANDO HABLAMOS CEP NOS REFERIMOS AL CONJUNTO DE PATÓGENOS QUE INTERACTÚAN Y SE ASOCIAN CAUSANDO INFECCIONES QUE DESEMBOCAN EN DIARREAS, ANOREXIA, FIEBRE Y/O PÉRDIDA DE PESO EN LOS CERDOS
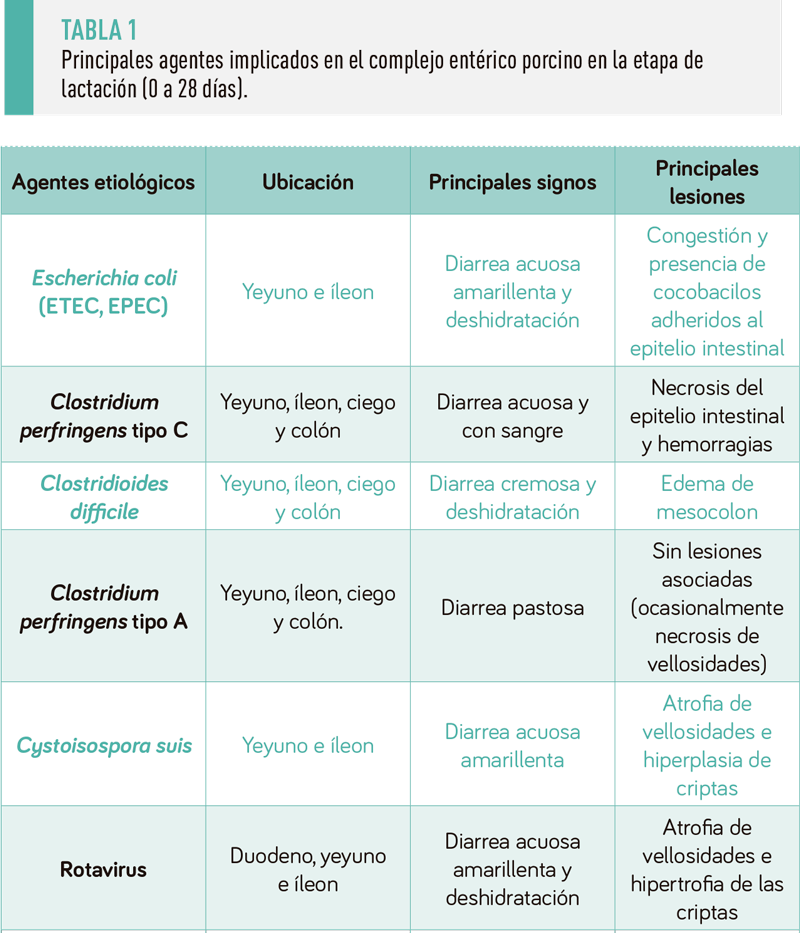
Entre los agentes etiológicos del complejo entérico relevantes en esta etapa se encuentran Escherichia coli enterotoxigénica (ETEC) y Clostridium perfringens tipo C, ambos patógenos controlables mediante la profilaxis vacunal en las reproductoras.
También se dispone de vacunas para madres frente a Rotavirus A, aunque no frente a otros Rotavirus, particularmente frente a Rotavirus C, especie implicada con frecuencia en brotes de diarrea en los primeros días de vida.
Otros agentes etiológicos relevantes en esta etapa incluyen E. coli enteropatógeno (EPEC), Cystoisospora suis, Clostridioides difficile y distintos coronavirus entéricos (Tabla 1), siendo más discutible la implicación de C. perfringens tipo A, un microorganismo que se detecta con gran frecuencia en las heces de los lechones con independencia de la presencia de signos clínicos entéricos.
Más recientemente, se han asociado al CEP en esta etapa otros microorganismos cómo Enterococcus hirae y virus como los kobuvirus, astrovirus o adenovirus, entre otros.
A continuación, nos pararemos analizar de forma individual cada uno de estos agentes etiológicos.
DIARREAS POR ESCHERICHIA COLI
E. coli es uno de los principales agentes etiológicos del CEP, colonizando el tracto digestivo de los lechones desde las primeras horas de vida. Algunos aislados de E. coli disponen de factores de virulencia que les confieren carácter patógeno.
Desde el punto de vista del CEP en lactación, los patotipos de E. coli implicados incluyen los denominados:
ETEC
![]()
Los aislados de ETEC disponen, como principales factores de virulencia, de:
LA DISPONIBILIDAD DE RECEPTORES ESPECÍFICOS PARA LAS ADHESINAS DETERMINA LA RECEPTIVIDAD A LA INFECCIÓN POR AISLADOS DE ETEC PROVISTOS DE DIFERENTES FIMBRIAS
Las principales adhesinas y toxinas que se identifican en los ETEC implicados en el CEP en la etapa neonatal se muestran en la Tabla 2.

| Las diarreas asociadas a ETEC son de tipo secretor, provocadas por cambios en el funcionamiento de los canales de intercambio iónico en la membrana del enterocito maduro a consecuencia de la acción de las toxinas producidas por estos aislados. |
EPEC
![]()
El patotipo EPEC se caracteriza por disponer del factor de adhesión y borrado de las vellosidades (adhesina EAE o intimina) que favorece la unión a los enterocitos y la desaparición de las microvellosidades del extremo apical de estas células.

Cabe destacar que, aunque los estudios más clásicos identificaban a EPEC como causa de procesos entéricos a partir del destete, las investigaciones más recientes indican que su identificación es frecuente en las primeras semanas de vida, ocupando, muy probablemente, el nicho que ha dejado libre ETEC a consecuencia del uso rutinario de vacunas en las madres.
| La diarrea asociada a aislados EPEC es una diarrea osmótica causada por la acción de borrado de las microvellosidades que limita la absorción. |
Los datos más recientes, tanto de nuestro grupo (Gráfica 1) como de otros investigadores, indican que en la actualidad rara vez se identifican cepas de ETEC dotadas de las fimbrias clásicamente asociadas a diarreas neonatales en porcino (F4, F5, F6 o F41) en esta etapa, hecho que permite concluir el éxito de los programas de vacunación en reproductoras.
Si bien estos datos hay que tomarlos con cautela y seguir evaluando el riesgo de ETEC en diarreas neonatales, incluyéndolos en el diagnóstico diferencial.


DIARREAS POR ROTAVIRUS
principales patógenos entéricos en el hombre y los animales, incluidos los cerdos, causando un cuadro clínico caracterizado por diarrea, deshidratación y anorexia, que puede verse agravado por coinfecciones con otros enteropatógenos.

EN LA ACTUALIDAD, SE RECONOCEN 9 ESPECIES DE RV (A-D Y F-J)
Los Rotavirus A (RVA), Rotavirus B (RVB), Rotavirus C (RVC) y Rotavirus H (RVH) han sido descritos en cerdos y pueden tener un impacto significativo en la salud y la productividad.
Clásicamente, los RVA se han considerado los más prevalentes y patógenos en las granjas de cerdos, pero los RVC se han identificado también como causa importante de enteritis en cerdos, particularmente en los lechones en los primeros días de vida (Gráfica 2).

| Los RV se replican en los enterocitos maduros del yeyuno e íleon, provocando acortamiento de las vellosidades y, consiguientemente, diarrea por malabsorción. |
La presentación clínica varía de subclínica a enfermedad entérica grave, en función de:
LOS ROTAVIRUS A Y C SON CADA VEZ MÁS RELEVANTES COMO AGENTES ETIOLÓGICOS DE DIARREAS NEONATALES EN LAS EXPLOTACIONES PORCINAS
El diagnóstico directo, generalmente mediante técnicas moleculares, debe incluir al menos estas dos especies virales y, si es posible, se acompañará de estudios histopatológicos que permitan demostrar la presencia de lesiones de acortamiento de las vellosidades.
| Recientemente se han introducido en el mercado europeo vacunas específicas de rotavirus para cerdas, mono o bivalentes, que protegen frente a las infecciones por Rotavirus A en las primeras semanas de vida de los lechones. |

DIARREAS POR CORONAVIRUS
En la actualidad conocemos cinco coronavirus entéricos que producen cuadros clínicos indistinguibles en los cerdos.

Los coronavirus entéricos porcinos clásicamente conocidos -Virus de la gastroenteritis transmisible porcina (VGET) y Virus de la diarrea epidémica porcina (VDEP), son Alphacoronavirus, al igual que el Coronavirus del síndrome de diarrea aguda (SADSCoV), un virus recientemente adaptado al hospedador porcino a partir de un coronavirus de murciélagos y que se ha identificado en un número limitado de brotes de enfermedad entérica en granjas porcinas de China.
El Coronavirus entérico porcino (SeCoV) es un virus quimérico generado por la recombinación del VGET y el VDEP que ha circulado desde los años 90 y hasta la actualidad por explotaciones porcinas del continente europeo.
Finalmente, el Delta coronavirus porcino (PDCoV) ha sido detectado en explotaciones porcinas de Asia y del continente americano, pero no en Europa, siendo un virus de origen aviar adaptado recientemente al cerdo.
| En todas estas infecciones, la presentación clínica característica se inicia tras la entrada del virus en una granja previamente negativa, provocando brotes epidémicos muy evidentes, con elevada morbilidad, y afectando a cerdos de todas las edades. La malabsorción asociada a la destrucción de los enterocitos maduros de la vellosidad intestinal es consecuencia de la replicación viral, que produce lesiones de acortamiento de las vellosidades, generalmente más graves que las asociadas a rotavirus. |
Ocasionalmente, estos coronavirus son capaces de persistir en las granjas tras el brote epidémico inicial, danto lugar a presentaciones endémicas.

DIARREAS POR CLOSTRIDIOS
Hay dos especies de clostridios que se han implicado en el CEP:
C. PERFRINGENS
![]()
Los aislados de C. perfringens se clasifican en tipos, A, B, C o D, en función de la presencia de las denominadas toxinas principales (α, β, ε y ι).
| C. PERFRINGENS TIPO C C. perfringens tipo C produce las toxinas principales α y β. La toxina β es una potente enterotoxina que provoca una reacción inflamatoria a nivel local y genera un cuadro clínico y lesional de enteritis hemorrágica con elevada letalidad.
|
C. PERFRINGENS TIPO A Los aislados de C. perfringens tipo A se detectan con mucha más frecuencia, puesto que son componentes mayoritarios de la microbiota. Producen una única toxina principal, la toxina α, con escasa relevancia a nivel entérico y, adicionalmente, en muchos casos, la enterotoxina β2. |

Las investigaciones más recientes cuestionan la relevancia de estos clostridios tipo A en la etiología de cuadros clínicos de diarrea en lechones, dado que se detectan de forma habitual y en concentraciones similares en lechones sanos y enfermos.
C. DIFFICILE
![]()
C. difficile también coloniza el tracto digestivo de los lechones en las primeras horas de vida, siendo un componente minoritario de la microbiota intestinal.
Cuando esta especie se multiplica en exceso en los lechones durante los primeros días de vida, las toxinas que produce (A y B), inducen un cuadro entérico caracterizado por heces pastosas y de color naranja-amarillento, así como signos de edema a nivel sistémico, particularmente evidentes en escroto y mesocolon.
SÍNDROME DE DIARREA NEONATAL DE ETIOLOGÍA DESCONOCIDA
En la última década se ha acuñado el término “síndrome de diarrea neonatal de etiología desconocida” para referirnos a brotes de diarrea donde no se demuestra la participación de ninguno de los agentes etiológicos mencionados anteriormente, pero con una etiología presumiblemente infecciosa.
Aunque no existen muchos estudios, este síndrome se ha descrito en varios países europeos, asociándose a procesos de disbiosis, con claras diferencias en la composición de la microbiota entre los lechones sanos, sin diarrea, y los afectados.
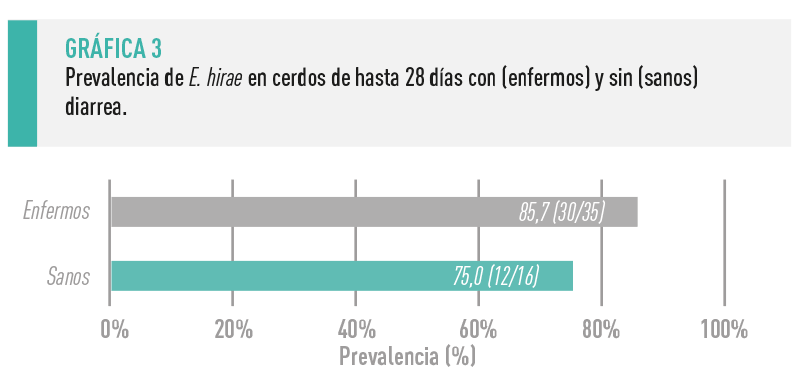
SE HA SEÑALADO A ENTEROCOCCUS HIRAE, COMENSAL DEL TRACTO DIGESTIVO DE LOS CERDOS, INCLUIDOS LOS LECHONES, COMO POTENCIAL AGENTE ETIOLÓGICO DE ALGUNOS DE ESTOS BROTES
De forma similar a lo que ocurre con otros potenciales patógenos entéricos, la mera detección de E. hirae en las heces de los lechones tiene escaso valor diagnóstico, siendo necesarias más investigaciones que permitan identificar factores de virulencia que puedan discriminar las cepas implicadas en cuadros entéricos (Gráfica 3).
Más allá de los rotavirus y los coronavirus, existen otros virus entéricos cuya implicación en el CEP está aún por esclarecer. Entre ellos se incluyen, entre otros:
| Nuestro grupo ha llevado a cabo estudios para conocer la prevalencia de estos virus y su asociación con otros agentes etiológicos del CEP. |
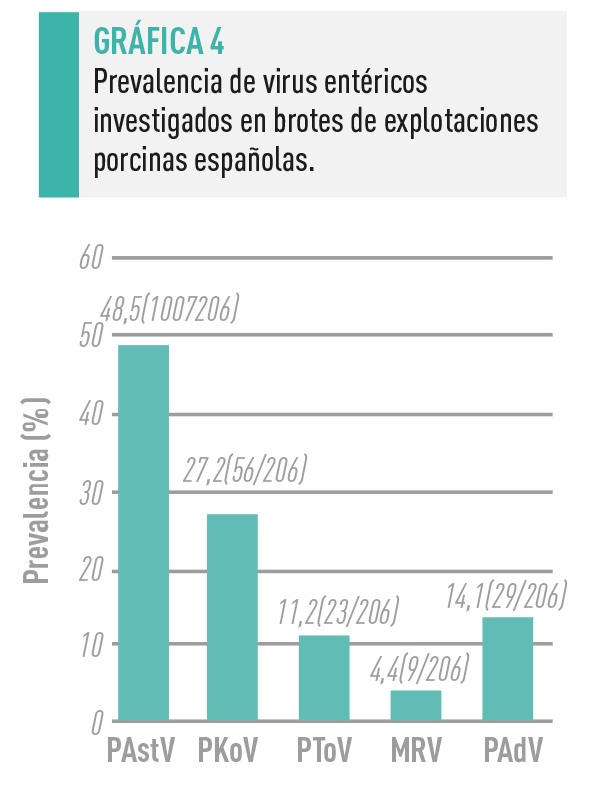
Hemos demostrado una alta prevalencia de algunos de estos virus entéricos en brotes de diarrea, particularmente PAstV y PKoV, detectados en casi el 50 % y el 30 % de las granjas investigadas (Gráfica 4).
Estos virus entéricos se implican frecuentemente en coinfecciones, tanto entre sí como con rotavirus y coronavirus, siendo necesarios estudios de vigilancia y caracterización, así como investigaciones que permitan determinar su potencial patógeno, tanto en infecciones experimentales como naturales.
| A modo de conclusión podemos señalar que los problemas infecciosos en lactación son cada vez más complejos, siendo fundamental realizar un diagnóstico completo y preciso. La identificación correcta de la etiología, la corrección de los factores predisponentes, la mejora en el manejo de los animales y el adecuado uso de las herramientas de prevención y control que nos ofrece el mercado son vitales para el control de esta enfermedad. |
BIBLIOGRAFÍA
1. Arias, C. A., Robredo, B., Singh, K. V,Torres, C., Panesso, D. and Murray, B. E.(2006) “Rapid Identification of Enterococcus hirae and Enterococcus durans by PCRand Detection of a Homologue of the E.hirae mur-2 Gene in E. durans”, JOURNALOF CLINICAL MICROBIOLOGY, 44(4), pp.1567–1570. doi:10.1128/JCM.44.4.1567-1570.2006.
2. Broes, A., Taylor, D. J. & Martine, G.,2019. Miscellaneous Bacterial Infection.En: J. J. Zimmerman, y otros edits. Diseases of Swine. 11 ed. Hoboken: Wiley-Blackwell, p. 992.
3. Bollam, R., Yassin, M. and Phan, T. (2021)”Detection of Enterococcus hirae in a caseof acute osteomyelitis”, Radiology casereports. Radiol Case Rep, 16(9), pp. 2366–2369. doi:10.1016/J.RADCR.2021.06.016.
4. Carvajal, A., Argüello, H., Martínez-Lobo,F.J., Costillas, S., Miranda, R., de Nova,P. J. G. and Rubio, P. (2015) “Porcineepidemic diarrhoea: new insights into anold disease”, Porcine Health Management.BioMed Central, 1. doi:10.1186/S40813-015-0007-9.
5. Carvajal, A., Rubio, P., Argüello, H., Gómez Laguna, J. y Miranda Hevia, R. (2018)Diarrea neonatal. 1.a ed. Zaragoza: GrupoAsís Biomedia.
6. Casanova, C. (2015) “Enfermedad de losEdemas Actualización”, PorciNews, July,pp. 103–110.
7. Chan, T. S., Wu, M. S., Suk, F. M., Chen,C.N., Chen, Y. F., Hou, Y. H. and Lien, G.S.(2012) “Enterococcus hirae-relatedacute pyelonephritis and cholangitiswith bacteremia: An unusual infection inhumans”, Kaohsiung Journal of MedicalSciences. 28(2), pp. 111–114. doi:10.1016/J.KJMS.2011.06.027.
8. Cheon, D. S. and Chae, C. (1996)”Outbreak of diarrhea associated withEnterococcus durans in piglets”, Journal ofveterinary diagnostic investigation : officialpublication of the American Associationof Veterinary Laboratory Diagnosticians,Inc. J Vet Diagn Invest, 8(1), pp. 123–124.doi:10.1177/104063879600800123.
9. Dicpinigaitis, P. V., De Aguirre, M. and Divito, J. (2015) “Enterococcus hirae Bacteremia Associated with Acute Pancreatitis andSeptic Shock “, Case Reports in InfectiousDiseases. Hindawi Limited, 2015, pp. 1–3.doi:10.1155/2015/123852.
10. Fiore, E., Van Tyne, D. and Gilmore, M.S.(2019) “Pathogenicity of Enterococci”,Microbiology spectrum. Microbiol Spectr,7(4). doi:10.1128/MICROBIOLSPEC.GPP3-0053-2018.
11. Fleckenstein, J. M., Hardwidge, P. R.,Munson, G. P., Rasko, D. A., Sommerfelt,H.and Steinsland, H. (2009) “Molecularmechanisms of enterotoxigenic Escherichia coli infection”. doi:10.1016/j.micinf.2009.10.002.
12. García-Meniño, I., García, V., Mora, A.,Díaz-Jiménez, D., Flament-Simon, S. C.,Alonso, M. P., Blanco, J. E., Blanco, M. andBlanco, J. (2018) “Swine enteric colibacillosis in Spain: Pathogenic potential ofmcr-1 ST10 and ST131 E. Coli Isolates”,Frontiers in Microbiology. Frontiers MediaS.A., 9(NOV), p. 420699. doi:10.3389/FMICB.2018.02659/BIBTEX.
13. Gohari, I. M., Navarro, M. A., Li, J.,Shrestha, A., Uzal, F. and Mcclane, B. A.(2021) “Pathogenicity and virulence ofClostridium perfringens”, Virulence, 12. doi:10.1080/21505594.2021.1886777.
14. Gryaznova, M. V., Dvoretskaya, Y. D.,Syromyatnikov, M. Y., Shabunin, S. V.,Parshin, P. A., Mikhaylov, E. V., Strelnikov,N. A. and Popov, V. N. (2022) “Changes inthe Microbiome Profile in Different Partsof the Intestine in Piglets with Diarrhea”,Animals. MDPI, 12(3), p. 320. doi:10.3390/ANI12030320/S1.
15. Hermann-Bank, M. L., Skovgaard, K.,Stockmarr, A., Strube, M. L., Larsen, N.,Kongsted, H., Ingerslev, H. C., Mølbak,L.and Boye, M. (2015) “Characterizationof the bacterial gut microbiota of pigletssuffering from new neonatal porcine diarrhoea”, BMC Veterinary Research. BioMedCentral Ltd., 11(1), pp. 1–19. doi:10.1186/S12917-015-0419-4/FIGURES/4.
16. Jang, S., Shin, S., Kim, S.-H., Kim, H.and Moon, C. (2019) “Diagnosis of Enterococcus hirae infection in association withpiglet diarrhea”, Journal of Biomedicaland Translational Research. ResearchInstitute of Veterinary Medicine, ChungbukNational University, 20(4), pp. 115–120.doi:10.12729/JBTR.2019.20.4.115.
17. Karuppannan, A. K. and Opriessnig, T.(2018) “Lawsonia intracellularis: Revisiting the Disease Ecology and Controlof This Fastidious Pathogen in Pigs”,Frontiers in Veterinary Science. FrontiersMedia SA, 5(AUG), p. 181. doi:10.3389/FVETS.2018.00181.
18. Knijff, E., Dellaglio, F., Lombardi, A., Andrighetto, C. and Torriani, S. (2001) “Rapididentification of Enterococcus durans andEnterococcus hirae by PCR with primerstargeted to the ddl genes”, Journal ofMicrobiological Methods, 47, pp. 35–40.Available at: www.elsevier.comrlocaterjmicmeth (Accessed: June 7, 2023).
19. Kongsted, H., Toft, N. and Nielsen, J. P.(2014) “Risk factors and epidemiologicalcharacteristics of new neonatal porcinediarrhoea syndrome in four Danish herds”,BMC Veterinary Research. BioMed CentralLtd., 10. doi:10.1186/1746-6148-10-151.
20. Larsson, J., Lindberg, R., Aspán, A.,Grandon, R., Westergren, E. and Jacobson,M.(2014) “Neonatal Piglet Diarrhoea Associated with Enteroadherent Enterococcushirae”, Journal of Comparative Pathology.W.B. Saunders, 151(2–3), pp. 137–147.doi:10.1016/J.JCPA.2014.04.003.
21. Larsson, J. (2016) Neonatal PorcineDiarrhoea Aspects on Aetiology and Pathology. Tesis Doctoral. University of Uppsala.
22. Luppi, A. (2017) “Swine enteric colibacillosis: diagnosis, therapy and antimicrobialresistance”, Porcine health management.Porcine Health Manag, 3. doi:10.1186/S40813-017-0063-4.
23. Malik A, Nagy B, Kugler R, SzmolkaA.Pathogenic potential and virulence genotypes of intestinal and faecalisolates of porcine post-weaning enteropathogenic Escherichia coli. Res VetSci. 2017 Dec;115:102-108. doi: 10.1016/j.rvsc.2017.02.002.
24. Marthaler, D., Rossow, K., Culhane,M., Goyal, S., Collins, J., Matthijnssens, J.,Nelson, M. and Ciarlet, M. (2014) “Widespread Rotavirus H in Commercially RaisedPigs, United States”, Emerging InfectiousDiseases. Centers for Disease Control andPrevention, 20(7), p. 1203. doi:10.3201/EID2007.140034.
25. Nakamura, T., Ishikawa, K., Matsuo, T.,Kawai, F., Uehara, Y. and Mori, N. (2021)”Enterococcus hirae bacteremia associated with acute pyelonephritis in a patientwith alcoholic cirrhosis: a case reportand literature review”, BMC InfectiousDiseases. BioMed Central Ltd, 21(1), pp.1–10. doi:10.1186/S12879-021-06707-2/TABLES/3.
26. de Nova, P. J. G., Cortey, M., Díaz,I., Puente, H., Rubio, P., Martín, M. andCarvajal, A. (2020) “A retrospective study ofporcine epidemic diarrhoea virus (PEDV)reveals the presence of swine enteric coronavirus (SeCoV) since 1993 and the recentintroduction of a recombinant PEDV-SeCoVin Spain”, Transboundary and EmergingDiseases. John Wiley & Sons, Ltd, 67(6),pp. 2911–2922. doi:10.1111/TBED.13666.
27. Pinkes, M. E., White, C. and Wong, C.S.(2019) “Native-valve Enterococcus hiraeendocarditis: A case report and review ofthe literature”, BMC Infectious Diseases. BioMed Central Ltd., 19(1), pp. 1–5.doi:10.1186/S12879-019-4532-Z/TABLES/1.
28. Prieto, C., Martínez, F., Segalés, J.and Carvajal, A. M. (2017) Enfermedadesinfecciosas del ganado porcino. 1st ed.Zaragoza: Grupo Asís Biomedia.
29. Puente, H., Argüello, H., Mencía-Ares,Ó., Gómez-García, M., Rubio, P. andCarvajal, A. (2021) “Detection and GeneticDiversity of Porcine Coronavirus Involved inDiarrhea Outbreaks in Spain”, Frontiers inVeterinary Science. Frontiers Media S.A., 8,p.651999. doi:10.3389/FVETS.2021.651999/BIBTEX.
30. Puente H, Arguello H, Cortey M, Gómez-García M, Mencía-Ares O, Pérez-Perez L, Díaz I, Carvajal A. Detection andgenetic characterization of enteric virusesin diarrhoea outbreaks from swine farms in Spain. Porcine Health Manag. 2023Jun 22;9(1):29. doi: 10.1186/s40813-023-00326-w.
31. Puente, H. (2023) Diarreas de etiologíavírica en el ganado porcino: aportacionesal diagnóstico y control. Tesis Doctoral.Universidad de León.
32. Ramig, R. F. (2004) “Pathogenesis ofIntestinal and Systemic Rotavirus Infection”, Journal of Virology. American Societyfor Microbiology (ASM), 78(19), p. 10213.doi:10.1128/JVI.78.19.10213-10220.2004.
33. Selleck, E. M., Van Tyne, D. and Gilmore,M.S. (2019) “Pathogenicity of Enterococci”,Microbiol Spectr., 7(4). doi:10.1128/microbiolspec.GPP3-0053-2018.
34. Shepherd, F. K., Freeman, M. J.,Culhane, M. R. & Marthaler, D. G., 2019.Reoviruses (Rotaviruses and Reoviruses).In: J. J. Zimmerman, et al. eds. Diseasesof Swine. 11 ed. Hoboken: Wiley-Blackwell,pp. 715-727.
35. Uzal, F. A., Navarro, M. A., Asin, J.,Boix, O., Ballarà-Rodriguez, I. and Gibert,X.(2023) “Clostridial diarrheas in piglets: A review”, Veterinary microbiology.Vet Microbiol, 280. doi:10.1016/J.VETMIC.2023.109691.
36. Uzal, F. A. & Songer, J. G., 2019. Clostridial Diseases. In: J. Zimmerman, et al.eds. Diseases of Swine. 11 ed. Hoboken:Wiley-Blackwell, pp. 792-806.
37. Vlasova, A. N., Amimo, J. O. and Saif, L.J.(2017) “Porcine Rotaviruses: Epidemiology, Immune Responses and ControlStrategies”, Viruses. MultidisciplinaryDigital Publishing Institute (MDPI), 9(3).doi:10.3390/V9030048.
38. Wang, Q., Vlasova, A. N., Kenney, S.P.and Saif, L. J. (2019) “Emerging andre-emerging coronaviruses in pigs”,Current opinion in virology. Curr OpinVirol, 34, pp. 39–49. doi:10.1016/J.COVIRO.2018.12.001.
39. Yang, Q., Huang, X., Zhao, S., Sun, W.,Yan, Z., Wang, P., Li, S., Huang, W., Zhang,S., Liu, L. and Gun, S. (2017) “Structure andfunction of the fecal microbiota in diarrheicneonatal piglets”, Frontiers in Microbiology. Frontiers Research Foundation, 8(MAR),p.502. doi:10.3389/FMICB.2017.00502/BIBTEX.
40. Zimmerman, J., Karriker, L., Ramirez, A., Schwartz, K., Stevenson, G. and Zhang, J. (2019) “Diseases of swine”, in. Hoboken: John Wiley & Sons.
