Estrategias de bioseguridad frente a virus porcinos en los piensos
Para leer más contenidos de Revista porciSapiens Octubre 2023
Para leer más contenidos de Revista porciSapiens Octubre 2023
| El comercio global de ingredientes para piensos susceptibles de estar contaminados con concentraciones significativas de virus porcinos es motivo de preocupación por la posible transmisión de enfermedades porcinas, ya que las partículas víricas viables pueden sobrevivir en los ingredientes de los piensos y en los piensos completos durante varias semanas o meses. Sin embargo, no existe un sistema mundial de vigilancia y monitorización de virus porcinos en los ingredientes de los piensos. Por ello, se deben desarrollar e implementar protocolos de bioseguridad basados en el Análisis de Peligros y en Controles Preventivos en función del Riesgo en las cadenas de suministro de ingredientes para piensos, con el fin de prevenir la contaminación vírica. |
EL RETO DE MONITORIZAR LA CONTAMINACIÓN VÍRICA EN LOS PIENSOS
Sin embargo, la preocupación por la transmisión transfronteriza de virus porcinos a través del comercio y los viajes internacionales1 ha conducido a la realización de numerosas investigaciones para evaluar:
Los principales virus porcinos que suscitan preocupación por su posible transmisión a través de las cadenas mundiales de suministro de piensos son:
Si bien, algunos informes han aportado pruebas de la contaminación en piensos e ingredientes para piensos con algunos virus (VPPA3, VPPC4 y SVA5,6) en granjas comerciales y fábricas de piensos, otros estudios no han logrado relacionar definitivamente los piensos potencialmente contaminados con la transmisión del VPPA3, el PEDV7-10 y el VPRRS11.

Debido a esta gran incertidumbre, se han desarrollado modelos matemáticos para evaluar la probabilidad de transmisión del virus a través de los piensos.
Galvis et al.11 evaluaron la probabilidad relativa de transmisión del VPRRS a partir de nueve vías de transmisión y mostraron una asociación mínima entre la alimentación con subproductos animales y los brotes de VPRRS en granjas.
Schambow et al.12 desarrollaron un modelo cuantitativo de evaluación de riesgos para estimar la probabilidad de que se importaran anualmente a EE.UU. uno o más contenedores con harina de soja o maíz contaminados con VPPA.
Estimaron que la probabilidad de que se importara un contenedor de maíz contaminado con VPPA era de 1 vez cada 50 años, pero para la harina de soja la probabilidad era de 1 vez cada 21-1.563 años.
RIESGO DE TRANSMISIÓN DE VIRUS PORCINOS EN LAS MATERIAS PRIMAS
Varios estudios de inoculación en laboratorio han demostrado que la mayoría de los virus porcinos de interés pueden sobrevivir en algunos ingredientes de piensos durante varias semanas o meses6,13-18. Sin embargo, el riesgo de transmisión del virus se basa en:
Para que los piensos puedan ser una fuente de infección:
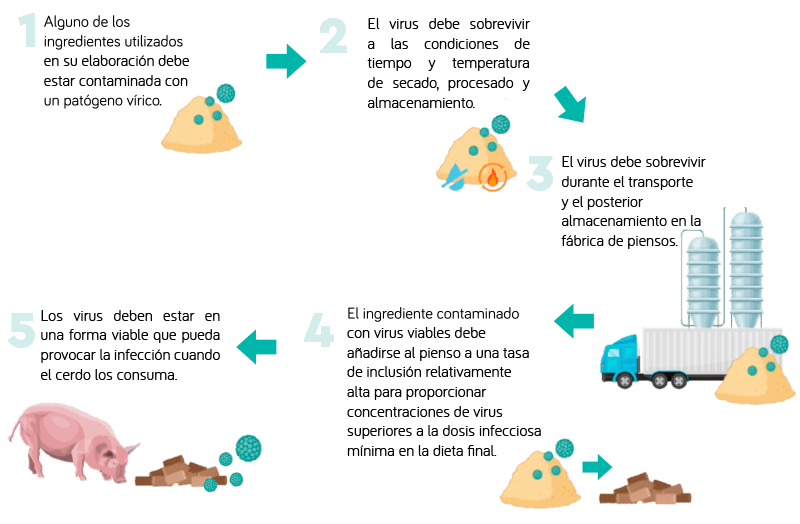
Por tanto, son muchas las condiciones de supervivencia de los virus que deben mantenerse desde el momento de la contaminación inicial de un ingrediente hasta que los cerdos consuman cantidades suficientes de virus viables para que se produzca la infección y, posteriormente, la enfermedad. No obstante, también es importante tener en cuenta que los virus pueden causar infecciones asintomáticas en los cerdos, lo que los convierte en portadores, existiendo una distinción importante entre infección y enfermedad.
PROTOCOLOS DE BIOSEGURIDAD PARA MINIMIZAR EL RIESGO DE TRANSMISIÓN DE VIRUS PORCINOS EN LOS PIENSOS
Debido al comercio global de ingredientes para piensos y al movimiento de ingredientes importados a fábricas de piensos y granjas porcinas, los programas de bioseguridad de los piensos para minimizar el riesgo de contaminación y transmisión de virus han surgido como un nuevo componente de los protocolos de seguridad y bioseguridad de piensos.
Antes del 2022, la Administración de Alimentos y Medicamentos de los EE.UU. (FDA) no consideraba a los virus como un peligro razonablemente previsible en la alimentación animal, a diferencia de las bacterias patógenas, los hongos y los parásitos. Sin embargo, la Guía de Análisis de Peligros y Controles Preventivos Basado en Riesgos (HARPC) para la industria alimentaria de la FDA ahora incluye [registrados]a los virus como peligros razonablemente previsibles en las cadenas de suministro de piensos, lo que exige desarrollar un plan de control preventivo para evitar y vigilar la contaminación de los piensos con virus.
Según esta reciente guía, no está claro si los fabricantes de piensos necesitan un plan de control preventivo del VPPA o de cualquier otro virus porcino.

En cualquier caso, no existen sistemas ni procedimientos analíticos estandarizados en los laboratorios comerciales para medir con facilidad y precisión la contaminación de los ingredientes y piensos con virus viables, para poder cumplir con los requisitos de seguimiento y acción correctiva de los planes HARPC.
Existen muchas lagunas de conocimiento que deben abordarse para mejorar nuestra capacidad de prevenir y controlar la contaminación por virus en la alimentación porcina, incluyendo:
|
A continuación, se resume el estado actual de los conocimientos sobre:
2. Los retos de determinar la inactivación de los virus.
3. La supervivencia de los virus en los ingredientes para piensos durante el transporte y el almacenamiento.
4. Las dosis infectiva mínima.
5. Inactivación de virus porcinos mediante procesos térmicos y de irradiación, y atenuantes químicos en los ingredientes y piensos.
6. Eficacia de las estrategias de descontaminación vírica en fábricas de piensos.
CONDICIONES DE PRODUCCIÓN, PROCESAMIENTO, ALMACENAMIENTO Y TRANSPORTE QUE PUEDEN CAUSAR CONTAMINACIÓN VÍRICA EN INGREDIENTES Y PIENSOS
La bioseguridad de las explotaciones porcinas es un componente esencial para prevenir la introducción y propagación de los patógenos causantes de enfermedades foráneas y endémicas, así como para mantener un alto nivel sanitario que optimice la productividad.
En este sentido, se han desarrollado directrices internacionales de bioseguridad encaminadas a minimizar la exposición de los animales a peligros externos que son rutas potenciales de transmisión de patógenos19.
Sin embargo, los protocolos de bioseguridad de las cadenas de suministro de piensos no se han incluido de forma rutinaria en los planes generales de bioseguridad de las explotaciones porcinas, a pesar de que los piensos son uno de los principales insumos externos y presentan cierto riesgo inherente de contaminación y transmisión de patógenos a las explotaciones.
Las instalaciones de fabricación de piensos son un punto de recogida, almacenamiento, dosificación, mezcla y procesamiento de diversos tipos de ingredientes procedentes de muchas regiones antes de que los piensos acabados se suministren a múltiples granjas.

Cochrane et al.20 describieron los componentes clave del desarrollo de planes de bioseguridad para fábricas de piensos que incluyen:
Si bien, los procedimientos de bioseguridad pueden variar en función del tipo de pienso producido, de la situación sanitaria del país o región donde se encuentre la instalación de fabricación de piensos y del origen de los ingredientes utilizados en la instalación, todo plan de bioseguridad para una instalación de fabricación de piensos debe incluir:







TRANSPORTE BIOSEGURO
El transporte suele pasarse por alto en los protocolos de bioseguridad. Sin embargo, los camiones, el calzado de los conductores, las bolsas y los contenedores han sido identificados como la principal vía de transmisión de patógenos asociados a los piensos en varios estudios3,7,8,11.
LA LIMPIEZA, DESINFECCIÓN Y CALENTAMIENTO DE LOS CAMIONES UTILIZADOS PARA EL TRANSPORTE DE PIENSOS DEBEN SER PRÁCTICAS ESENCIALES EN LOS PROTOCOLOS DE BIOSEGURIDAD DE LA CADENA DE SUMINISTRO DE PIENSOS
Los componentes clave de los protocolos de transporte bioseguro son:










DETERMINACIÓN DE LA INACTIVACIÓN DE LOS VIRUS
MUESTREO
La determinación precisa de las concentraciones de virus en los ingredientes para piensos comienza con la recogida de muestras representativas, pero los virus en piensos contaminados pueden no estar distribuidos uniformemente y estar presentes en bajas concentraciones.
Sin embargo, no se han validado métodos de muestreo para la recogida de muestras representativas de piensos para el análisis de virus.
Jones et al.23 inocularon muestras de harina de soja con 103 DICT50/g o 105 DICT50/g de PEDV y recogieron muestras mediante sondas individuales o muestreo combinado.

Elijah et al.24 evaluaron el uso de un procedimiento de muestreo de “patrón de doble X” para recoger submuestras con el fin de determinar las concentraciones del virus de la PPA en ingredientes a granel utilizando el procedimiento descrito por Jones et al.23 y también sugirieron que la recogida de 10 submuestras era necesaria para obtener resultados precisos.

Para poder cuantificar con precisión la cantidad de partículas víricas viables capaces de causar infección si son ingeridas por los cerdos los métodos específicos de diagnóstico de virus deben tener25:



A pesar de que las pruebas qPCR convencionales se utilizan habitualmente para determinar la cantidad de copias de ácido nucleico viral (ARN o ADN) por unidad de volumen o peso en una muestra de pienso, se corre el riesgo de malinterpretar sus resultados.
Los estudios de investigación suelen proporcionar valores Ct (ciclo umbral), que es el número de ciclos de PCR necesarios para detectar ARN o ADN viral, momento en el que los resultados pasan de negativos (no detectables) a positivos (detectables).
PARA LA CUANTIFICACIÓN, SOLO LOS VALORES DE CT INFERIORES A 35 SE CONSIDERAN FIABLES
Aunque existe una relación entre los valores de Ct y la cantidad de virus en una muestra, no son equivalentes porque muchas variables analíticas y de obtención de muestras de piensos afectan a estos valores.
VARIABLES RELACIONADAS CON LA OBTENCIÓN DE MUESTRAS DE PIENSOS
|
VARIABLES RELACIONADAS CON EL ANÁLISIS
|
Por otro lado, las pruebas qPCR:
Asimismo, dado que los valores Ct son específicos de cada prueba, la comparación de los valores Ct puede dar lugar a interpretaciones erróneas.
DETERMINACIÓN DE LA INFECTIVIDAD
![]()
Las pruebas de aislamiento viral se utilizan con frecuencia en estudios de investigación14 para evaluar su infectividad en cultivos celulares, pero no permiten inferir su infectividad si son ingeridos por cerdos29.
PRUEBA DE HEMADSORCIÓN
![]()
La prueba de hemadsorción (HAD50/ml) es comúnmente utilizada para calcular las concentraciones de virus mediante la incubación de una suspensión de glóbulos rojos con un cultivo celular infectado para medir el 50% de las réplicas que muestran la cantidad de hemadsorción de virus/ml de sangre30. Sin embargo, este método no ha demostrado ser suficientemente sensible para el diagnóstico definitivo del VPPA31.
DICT50
![]()
El ensayo más común para evaluar la infectividad de los virus es la determinación de la dosis infecciosa en cultivo de células 50% (DICT50)/g de muestra, que mide la cantidad de virus capaz de infectar el 50% de las réplicas en cultivo celular, pero esta técnica tampoco permite inferir directamente la infectividad en los cerdos.
ENSAYOS DE SUSTITUCIÓN
![]()
Recientemente, se han desarrollado ensayos de sustitución para algunos virus porcinos y, aunque resultan prometedores desde el punto de vista de la rentabilidad y la rapidez, aún no se han implementado de forma generalizada y, por tanto, no se han probado para garantizar que su sensibilidad y aplicabilidad a la hora de evaluar la infecciosidad de los virus específicos que pretenden simular sean aceptables.
BIOENSAYOS CON CERDOS
![]()
Los bioensayos con cerdos se han utilizado en algunos estudios85 para confirmar que los resultados positivos de PCR en muestras de piensos son capaces de causar infección, pero su aplicabilidad está limitada ya que requieren el uso de instalaciones para animales con un alto nivel de bioseguridad, son caros y su realización requiere mucho tiempo, además de que pueden no proporcionar resultados fiables y consistentes25.
¿QUÉ ENTENDEMOS POR INACTIVACIÓN?
Es importante interpretar con precisión los resultados de los estudios de inactivación de virus.

Aunque se han realizado estudios para estimar las dosis infecciosas mínimas de diversos virus porcinos capaces de provocar enfermedad, hay incoherencias debido a la imprecisión de las actuales pruebas diagnósticas, lo que, unido a la necesidad de tener en cuenta el número de animales de una población que pueden estar expuestos, dificultan la labor de determinar la probabilidad de que se produzca un brote de la enfermedad.
Los datos de inactivación en los ingredientes de los piensos se describen a menudo como una reducción del 99,9% de los virus, lo que corresponde a una reducción de 3-log o 103 a partir de la concentración inicial y NO DEBE INTERPRETARSE COMO UN 0,1% DE PARTÍCULAS VIRALES QUE PERMANECEN EN LA MUESTRA.
Dependiendo de la concentración inicial de virus, una reducción del 99,9% a través de tratamientos térmicos o químicos aún podría sobrepasar la dosis infecciosa mínima para un pienso contaminado y potencialmente resultar en una infección.
| Existen limitaciones sustanciales entre los diversos ensayos de detección de virus, lo que dificulta la comparación de resultados y la evaluación precisa de la viabilidad e infectividad de los virus en los ingredientes y piensos. |

SUPERVIVENCIA DE LOS VIRUS EN LOS INGREDIENTES PARA PIENSOS DURANTE EL TRANSPORTE
Varios estudios han evaluado la supervivencia de virus en ingredientes de piensos bajo diversos tipos de condiciones de transporte.
Un estudio inicial realizado por Dee et al.14 evaluó 6 ingredientes inoculados experimentalmente con virus porcinos (incluyendo VPPA, VPPC, PEDV, SVA y VPRRS), y almacenados bajo condiciones de temperatura y humedad relativa que simulaban condiciones de transporte transatlántico de 30 días o transpacífico de 37 días.
Se detectaron partículas virales infecciosas de:
LA HARINA DE SOJA CONVENCIONAL PARECE TENER PROPIEDADES QUÍMICAS Y FÍSICAS QUE FAVORECEN LA SUPERVIVENCIA DE LA MAYORÍA DE LOS VIRUS

Por ejemplo, Dee et al.32 realizaron un estudio para determinar si el VPRRS, el PEDV y el SVA viables e infecciosos sobrevivirían a un transporte comercial en camión de 21 días durante más de 9.000 km tras su inoculación en harina de soja orgánica y convencional, cloruro de L-lisina, cloruro de colina y vitamina A.

| Los resultados de estos y otros estudios14-16,86-88 ponen de manifiesto que el tiempo, la temperatura y la humedad relativa del transporte transoceánico y en camiones no reducen la viabilidad e infectividad de los virus porcinos. |

SUPERVIVENCIA DE LOS VIRUS EN LOS INGREDIENTES PARA PIENSOS DURANTE EL ALMACENAMIENTO
CONDICIONES DEL ALMACENAMIENTO
A pesar de que se ha demostrado que los tiempos de almacenamiento prolongados son una forma sencilla y eficaz de reducir las concentraciones de virus en los ingredientes y piensos cuando están contaminados, existen varios aspectos que deben tenerse en cuenta:

ES NECESARIO ESTABLECER UNA DEFINICIÓN ESTÁNDAR DE INACTIVACIÓN ACEPTABLE DE VIRUS BASADA EN LA CAPACIDAD DEL VIRUS RESIDUAL PARA CAUSAR INFECCIÓN
FRECUENCIA DE CONSUMO DEL PIENSO CONTAMINADO
La probabilidad de que un ingrediente contaminado con virus cause infección no solo depende de la concentración inicial de virus inoculado y del posterior nivel de inactivación y pérdida de infectividad durante el almacenamiento, sino que también depende de la frecuencia de consumo de pienso contaminado (es decir, una vez frente a múltiples eventos de alimentación)35,40 que superen las dosis infectivas mínimas de cada virus.
CARACTERÍSTICAS QUÍMICAS Y ESTRUCTURALES DE LOS INGREDIENTES
La actividad del agua (aw) ha demostrado ser un factor determinante de la resistencia térmica de los patógenos bacterianos en los alimentos41, y los valores inferiores a 0,60 suelen considerarse adecuados para prevenir el crecimiento de bacterias y moho en los alimentos42.
Por su parte, Hemmingsen et al.43 señalaron que la harina de soja molida gruesa tiene mayor actividad de agua que la harina de soja molida fina, al igual que la cebada, torta o maíz molidas gruesa o finamente. Estos resultados sugieren que el tamaño de las partículas afecta a la actividad del agua de los ingredientes.
| En vista de los resultados de estos y otros estudios38,89, es necesario seguir investigando para comprender los efectos relativos de las distintas características físicas y químicas de los ingredientes sobre la supervivencia de los virus porcinos, algo que podría ser útil para desarrollar modelos capaces de predecir las tasas de inactivación en distintas condiciones de tiempo y temperatura de las diferentes matrices de los piensos. |
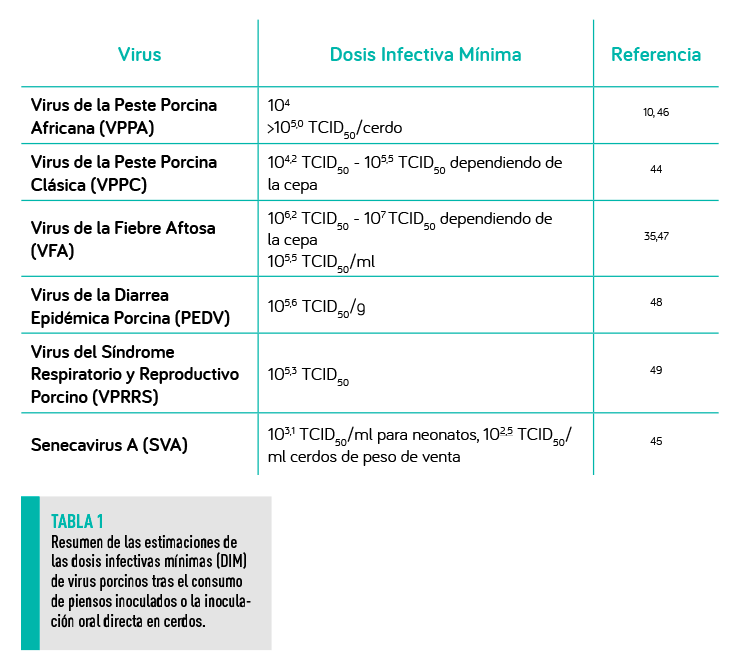
DOSIS INFECTIVA MÍNIMA
Las estimaciones de las dosis infectivas mínimas (DIM) de varios virus porcinos se han determinado mediante el consumo de piensos inoculados o la inoculación oral directa en cerdos (Tabla 1).

Este hecho queda patente en el estudio realizado con pollitos donde se demostró que la alimentación con dietas sin niveles detectables de Salmonella en los piensos puede, aun así, provocar una infección cuando son ingeridos50.

ES IMPORTANTE INTERPRETAR CUIDADOSAMENTE LOS DATOS SOBRE DOSIS INFECCIOSAS Y FRECUENCIA DE CONSUMO DE PIENSOS CONTAMINADOS

INACTIVACIÓN DE VIRUS PORCINOS MEDIANTE PROCESOS TÉRMICOS Y DE IRRADIACIÓN DE INGREDIENTES PARA PIENSOS
TRATAMIENTOS TÉRMICOS
El tratamiento térmico puede ser un método eficaz para inactivar bacterias, virus y parásitos, dependiendo de la temperatura y la duración2, habiéndose demostrado su eficacia para inactivar completamente varios virus, incluyendo el VPPA, el VPPC y el VFA en matrices de productos cárnicos39.
La mayoría de los estudios realizados con ingredientes y piensos completos han evaluado la eficacia del tratamiento térmico para la inactivación del PEDV.
TRATAMIENTOS DE IRRADIACIÓN
Varios estudios han demostrado que la irradiación ultravioleta es un paso adicional de bioseguridad eficaz para inactivar aún más varios virus porcinos con envoltura (VPRRS, PEDV, SVA y VPPC) y sin envoltura durante el proceso de secado por atomización del plasma porcino líquido54.
En general, mostraron que los virus con envoltura son más sensibles a la irradiación ultravioleta C que los virus sin envoltura, pero la infectividad se reduce en al menos 4 logs. Además, aunque el secado por atomización inactiva eficazmente a VPPA y VPPC, la irradiación ultravioleta C durante el proceso de secado por atomización puede proporcionar una inactivación adicional de VPPA con una reducción de más de 4 log DICT50/ml55.
| Los resultados de estos y otros estudios36,38,52,53,54,90,91,92 muestran que diversos tratamientos térmicos de tiempo y temperatura son eficaces para reducir, al menos parcialmente, las concentraciones virales en todas las matrices de piensos, pero la magnitud de la reducción varía considerablemente entre los tipos de ingredientes evaluados, los procesos térmicos utilizados, las concentraciones iniciales de virus, la sensibilidad o resistencia térmica del virus y el método de detección. Como resultado, se necesitan estrategias adicionales de mitigación, como atenuantes químicos, para lograr mayores garantías de inactivación del virus en ingredientes y piensos para cerdos. |

INACTIVACIÓN DE VIRUS PORCINOS MEDIANTE ATENUANTES QUÍMICOS EN INGREDIENTES PARA PIENSOS
Se han realizado pocos estudios sobre la eficacia de distintos aditivos con propiedades atenuantes para inactivar el VPPA56,57, el VFA35, el PDCoV58, el VPRRS y el SVA59. La mayoría de los estudios sobre atenuantes químicos se han centrado en la eficacia de la inactivación del PEDV en ingredientes de piensos y piensos completos51,59-67.
En general, los resultados de estos estudios han demostrado que la mayoría de los aditivos para piensos evaluados aportan algún beneficio en la reducción de las concentraciones de virus porcino, que a menudo se basa en una reducción de las concentraciones de ácido nucleico a partir del análisis PCR.
| En el futuro será necesario realizar estudios para evaluar la eficacia de diversas combinaciones de tiempo y temperatura de almacenamiento prolongados, procesamiento térmico y por irradiación, y atenuantes químicos en la inactivación de diversos virus porcinos en diferentes matrices de ingredientes para piensos. |

EFICACIA DE LAS ESTRATEGIAS DE DESCONTAMINACIÓN VÍRICA EN FÁBRICAS DE PIENSOS
A pesar de usar protocolos de bioseguridad bien diseñados y aplicados en las fábricas de piensos, puede producirse contaminación con patógenos en las superficies de contacto con los piensos y fuera de ellas si se introducen ingredientes de piensos contaminados22,68.
Dada la interconexión entre las fábricas de piensos individuales que sirven a múltiples granjas en grandes áreas geográficas, puede originarse una fuente potencial adicional de transmisión de patógenos a través de fómites asociados con el personal, los vehículos y los equipos de fabricación y entrega de piensos.
Las estrategias de bioseguridad y mitigación para reducir el riesgo de contaminación por patógenos bacterianos y víricos en las fábricas de piensos se han evaluado y resumido basándose en un número limitado de estudios20,69. Las estrategias evaluadas incluyen:
| A este respecto, se han llevado a cabo numerosos estudios53,60,70-83, pero la eficacia limitada de las estrategias de descontaminación en las fábricas de piensos en el escaso número de estudios realizados pone de relieve la necesidad de cumplir protocolos estrictos de bioseguridad de la cadena de suministro de piensos para la prevención, ya que una vez que una fábrica de piensos se contamina con virus, es difícil eliminarlos completamente. |

CONCLUSIONES
Es necesario desarrollar e implementar protocolos de bioseguridad para mejorar nuestra capacidad de prevenir la contaminación y transmisión de virus asociada a la producción, procesamiento, almacenamiento y transporte de alimentos para cerdos.
Los componentes clave de los protocolos de bioseguridad de los piensos deben incluir prácticas de mitigación eficaces, como tiempos de almacenamiento prolongados, procesamiento térmico y por irradiación, y atenuantes químicos para garantizar la inactivación de los virus porcinos viables si están presentes.
| Existen numerosos retos que deben superarse para mejorar nuestra capacidad de predecir con exactitud si los piensos contaminados con virus porcinos son capaces de causar una infección, incluidas las limitaciones de los métodos analíticos actuales para determinar la inactivación, viabilidad e infectividad de los virus en los piensos. |
Artículo traducido y adaptado de: Shurson, G.C.; Urriola, P.E.; Schroeder, D.C. Biosecurity and Mitigation Strategies to Control Swine Viruses in Feed Ingredients and Complete Feeds. Animals 2023, 13, 2375 (CC BY 4.0).
BIBLIOGRAFÍA
1. Beltran-Alcrudo, D.; Falco, J.R.; Raizman, E.; Dietze, K. Transboundary spread of pig disease: The role of international trade and travel. BMC Vet. Res. 2019, 15, 64. https://doi.org/10.1186/s12917-019-1800-5
2. Shurson, G.C.; Urriola, P.E.; van de Ligt, J.L.G. Can we effectively manage parasites, prions, and pathogens in the global feed industry to achieve One Health? Transbound. Emerg. Dis. 2022, 69, 4 30. doi:10.1111/tbed.14205
3. Gebhardt, J.T.; Dritz, S.S.; Elijah, C.G.; Jones, C.K.; Paulk, C.B.; Woodworth, J.C. Sampling and detection of African swine fever virus within a feed manufacturing and swine production system. Transbound. Emerg. Dis. 2022, 69, 103-114. doi:10.1111/tbed.14335
4. Kim, B.; Song, J.-Y.; Tark, D.-S.; Lim, S.-I.; Choi, E.-J.; Kim, J.; Park, C.-K.; Lee, B.-Y.; Wee, S.-H.; Bae, Y.-C.; Lee, O.-S.; Kwon, J.-H.; Kang, W.-C.; Kim, T.-Y.; Kim, J.-H.; Lee, J.-H.; Kang, M.-I. Feed contaminated with classical swine fever vaccine virus (LOM strain) can induce antibodies to the virus in pigs. Vet. Rec. 2008, 162, 12-17. https://doi.org/10.1136/vr.162.1.12
5. Leme, R.A.; Miyabe, F.M.; Agnol, A.M.D.; Alfieri, A.F.; Alfieri, A.A. Seneca Valley virus RNA detection in pig feed and feed ingredients in Brazil. Transbound. Emerg. Dis. 2019, 66, 1449-1453. https://doi:10.1111/tbed.13215
6. Dee, S.; Havas, K.; Spronk, G. Detection of Senecavirus A in pigs from a historically negative national swine herd and associated with feed imports from endemically infected countries. Transbound. Emerg. Dis. 2022, 1-3. doi:10.1111/tbed.14684
7. Bowman, A.S.; Krogwold, R.A.; Price, T.; Davis, M.; Moeller, S.J. Investigating the introduction of porcine epidemic diarrhea virus into an Ohio swine operation. BMC Vet. Res. 2015, 11, 38. https://doi.org/10.1186/s12917-015-0348-2
8. Greiner, L.L. Evaluation of the likelihood of detection of porcine epidemic diarrhea virus or porcine delta coronavirus ribonucleic acid in areas within feed mills. J. Swine Health Prod. 2016, 24, 198-204.
9. Pasma, T.; Furness, M.C.; Alves, D.; Aubry, P. Outbreak investigation of porcine epidemic diarrhea in swine in Ontario. Can. Vet. J. 2016, 57, 84-89.
10. Scott, A.; McClusky, B.; Brown-Reid, M.; Grear, D.; Pitcher, P.; Ramos, G.; Spencer, D.; Singrey, A. Porcine epidemic diarrhea virus introduction into the United States: Root cause investigation. Prev. Vet. Med. 2016, 123, 192-201. doi:10.1016/j.prevetmed.2015.11.013
11. Galvis, J.A.; Corzo, C.A.; Machado, G. Modelling and assessing additional transmission routes for porcine reproductive and respiratory syndrome virus: Vehicle movements and feed ingredients. Transbound. Emerg. Dis. 2022, 69, e1549-e1560. doi:10.1111/tbed.14488
12. Schambow, R.A.; Sampedro, F.; Urriola, P.E.; van de Ligt, J.L.G.; Perez, A.; Shurson, G.C. Rethinking the uncertainty of African swine fever virus contamination in feed ingredients and risk of introduction into the United States. Transbound. Emerg. Dis. 2022, 69, 157-175. doi:10.1111/tbed.14358
13. Dee, S.; Neill, C.; Clement, T.; Singrey, A.; Christopher- Hennings, J.; Nelson, E. An evaluation of porcine epidemic diarrhea virus survival in individual feed ingredients in the presence or absence of a liquid antimicrobial. Porc. Health Manag. 2015, 1, 9. doi:10.1186/s40813-015-0003-0
14. Dee, S.A.; Bauermann, F.V.; Niederwerder, M.C.; Singrey, A.; Clement, T.; de Lima, M.; Long, C.; Patterson, G.; Sheahan, M.A.; Stoian, A.M.M.; Petrovan, V.; Jones, C.K.; De Jong, J.; Ji, J.; Spronk, G.D.; Minion, L. Christopher-Hennings, J.; Zimmerman, J.J.; Rowland, R.R.R.; Nelson, E.; Sundberg, P.; Diel, D.G. Survival of viral pathogens in animal feed ingredients under transboundary shipping models. PLoS ONE 2018, 13, e0194509. https://doi.org/10.1371/journal.pone.0194509
15. Stoian, A.M.M.; Zimmerman, J.; Ji, J.; Hefley, T.J.; Dee, S.; Diel, D.G.; Rowland, R.R.R.; Niederwerder, M.C. Half-life of African swine fever virus in shipped feed. Emerg. Infect. Dis. 2019, 25, 2261-2263. https://doi.org/10.3201/eid2512.191002
16. Dee, S.; Shah, A.; Jones, C.; Singrey, A.; Hanson, D.; Edler, R.; Spronk, G.; Niederwerder, M.; Nelson, E. Evidence of viral survival in representative volumes of feed and feed ingredients during long-distance commercial transport across the continental United States. Transbound. Emerg. Dis. 2022, 69, 149-156. doi:10.1111/tbed.14057
17. Caserta, L.C.; Noll, J.C.G.; Singrey, A.; Niederwerder, M.C.; Dee, S.; Nelson, E.A.; Diel, D.G. Stability of Senecavirus A in animal feed ingredients and infection following consumption of contaminated feed. Transbound. Emerg. Dis. 2022, 69, 88-96. doi:10.1111/tbed.14310
18. Niederwerder, M.C.; Khanal, P.; Foland, T.; Constance, L.A.; Stoian, A.M.M.; Deavours, A.; Haase, K.; Cino-Ozuna, A.G. Stability of African swine fever virus in feed during environmental storage. Transbound. Emerg. Dis. 2022, 1-9. doi:10.1111/tbed.14666
19. FAO. FAO Biosecurity Tool Kit. Food and Agriculture Organization of the United Nations, 2007. http://www.fao.org/docrep/010/a1140e/a1140e00.htm
20. Cochrane, R.A.; Dritz, S.S.; Woodworth, J.C.; Stark, C.R.; Huss, A.R.; Cano, J.P.; Thompson, R.W.; Fahrenholz, A.C.; Jones, C.K. Feed mill biosecurity plans: A systematic approach to prevent biological pathogens in swine feed. J. Swine Health Prod. 2016, 24, 154-164.
21. Van Kessel, J; Strom, S.; Deason, H.; van Moorlehem, E.; Berube, N.; Hauta, S.; Fernando, C.; Hill, J.; Fonstad, T.; Gerdts, V. Time and temperature requirements for heat inactivation of pathogens to be applied to swine transport trailers. J. Swine Health Prod. 2021, 29, 19-28.
22. Munoz, L.R.; Pacheco, W.J.; Hauck, R.; Macklin, K.S. Evaluation of commercially manufactured animal feeds to determine presence of Salmonella, Escherichia coli, and Clostridium perfringens. J. Appl. Poult. Res. 2021, 30, 100142. https://doi.org/10.1016/j.japr.2021.100142
23. Jones, C.K.; Stewart, S.; Woodworth, J.C.; Dritz, S.S.; Paulk, C. Validation of sampling methods in bulk feed ingredients for detection of swine viruses. Transbound. Emerg. Dis. 2020, 67, 1-5. doi:10.1111/tbed.13326
24. Elijah, C.G.; Trujillo, J.D.; Jones, C.K.; Gaudreault, N.N.; Stark, C.R.; Cool, K.R.; Paulk, C.B.; Kwon, T.; Woodworth, J.C.; Morozov, I.; Gallardo, C.; Gebhardt, J.T.; Richt, J.A. Evaluating the distribution of African swine fever virus within a feed mill environment following manufacture of inoculated feed. PLoS ONE 2021, 16, e0256138. https://doi.org/10.1371/journal.pone.0256138
25. Shurson, G.C.; Palowski, A.; van de Ligt, J.L.G.; Schroeder, D.C.; Balestreri, C.; Urriola, P.E.; Samperdo, F. New perspectives for evaluating relative risks of African swine fever virus contamination in global feed ingredient supply chains. Transbound. Emerg. Dis. 2022, 69, 31-56. doi:10.1111/tbed.14174
26. Ward, R.L.; Akin,E.W.; D’Alessio, D.J. Minimum infective dose of animal viruses. Crit. Rev. Environ. Control 1984, 14, 297–310. doi:10.1080/10643388409381721.
27. Puente, H.; Randazzo, W.; Falco, I.; Carvajal, A.; Sánchez, G. Rapid selective detection of potentially infectious porcine epidemic diarrhea coronavirus exposed to heat treatments using viability Rt-qPCR. Front. Microbiol. 2020, 11, 1911. doi:10.3389/fmicb.2020.01911.
28. Balestreri, C.; Schroeder, D.C.; Sampedro, F.; Marqués, G.; Palowski, A.; Urriola, P.E.; van de Ligt, J.L.G.; Yancy, H.F.; Shurson, G.C. Unexpected thermal stability of two enveloped megaviruses, Emiliania huxleyi virus and African swine fever virus particles as measured by viability PCR. Virology 2023
29. Bourry, O.; Hutet, E.; Le Dimna, M.; Lucas, P.; Blanchard, Y.; Chastagner, A.; Paboeuf, F.; Le Potier, M.-F. Oronasal or intramuscular immunization with a thermo-attenuated ASFV strain provides full clinical protection against Georgia 2007/1 challenge. Viruses 2022, 14, 2777. doi:10.3390/v14122777
30. PHE. UK Standards for Microbiology Investigations, Haemadsorption of Viruses. Standards Unit, Microbiology Services, Public Health England, 2013, 45, 1-15. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/344206/V_45i2.2.pdf
31. OIE. African swine fever (infection with African swine fever virus). In: OIE terrestrial manual, 2019, pp. 1-17. OIE. https://www.oie.int/fileadmin/Home/eng/Health_ standards/tahm/3.08.01_ASF.pdf
32. Dee, S.; Shah, A.; Cochrane, R.; Clement, T.; Singrey, A.; Edler, R.; Spronk, G.; Niederwerder, M.; Nelson, E. Use of a demonstration project to evaluate viral survival in feed: Proof of concept. Transbound. Emerg. Dis. 2021, 68, 248-252. doi:10.1111/tbed.13682
33. Dee, N.; Havas, K.; Shah, A.; Singrey, A.; Spronk, G.; Niederwerder, M.; Nelson, E.; Dee, S. Evaluating the effect of temperature on viral survival in plant-based feed during storage. Transbound. Emerg. Dis. 2022, 69, e2105-e2110. doi:10.1111/tbed.14546
34. Fischer, M.; Pikalo, J.; Beer, M.; Blome, S. Stability of African swine fever virus on spiked spray-dried porcine plasma. Transbound. Emerg. Dis. 2021, 68, 2806-2822. doi:10.1111/tbed.14192
35. Stenfeldt, C.; Bertram, M.R.; Meek, H.C.; Hartwig, E.J.; Smoliga, G.R.; Niederwerder, M.C.; Diel, D.G.; Dee, S.A.; Arzt, J. The risk and mitigation of foot-and-mouth disease virus infection of pigs through consumption of contaminated feed. Transbound. Emerg. Dis. 2022, 69, 72-87. doi:10.1111/tbed.14230
36. Pujols, J.; Segalés, J. Survivability of porcine epidemic diarrhea virus (PEDV) in bovine plasma submitted to spray drying processing and held at different time by temperature storage conditions. Vet Microbiol. 2014, 174, 427-432. https://doi.org/10.1016/j.vetmic.2014.10.021
37. Dee, S.; Shah, A.; Cochrane, R.; Wu, F.; Clement, T.; Singrey, A.; Edler, R.; Spronk, G.; Niederwerder, M.; Nelson, E. The effect of extended storage on virus survival in feed. J. Swine Health Prod. 2021, 29, 124-128.
38. Trudeau, M.P.; Verma, H.; Sampedro, F.; Urriola, P.E.; Shurson, G.C.; Goyal, S.M. Environmental persistence of porcine coronaviruses in feed and feed ingredients. PLoS ONE 2017, 12, e0178094. https://doi.org/10.1371/journal.pone.0178094
39. Knight, A.I.; Haines, J.; Zuber, S. Thermal inactivation of animal virus pathogens. Curr. Topics Virol. 2013, 11, 103-119.
40. Niederwerder, M.C.; Stoian, A.M.M.; Rowland, R.R.R.; Dritz, S.S.; Petrovan, V.; Constance, L.A.; Gebhardt, J.T.; Olcha, M.; Jones, C.K.; Woodworth, J.C.; Fang, Y. Liang, J.; Hefley, T.J. Infectious dose of African swine fever virus when consumed naturally in liquid or feed. Emerg. Infect. Dis. 2019, 25, 891 897. https://doi.org/10.3201/eid2505.181495
41. Syamaladevi, R.M.; Tang, J.; Villa-Rojas, R.; Sablani, S.; Carter, B.; Campbell, G. Influence of water activity on thermal resistance of microorganisms in low-moisture foods: A review. Compre. Rev. Food Sci. Food Safety 2016, 15, 353-370. doi:10.1111/1541-4337.12190
42. Beuchat, L.R. Influence of water activity on growth, metabolic activities and survival of yeasts and molds. J. Food Protect. 1983, 46, 135-141. doi:10.4315/0362-028X-46.2.135
43. Hemmingsen, A.K.T.; Stevik, A.M.; Claussen, I.C.; Lundblad, K.K.; Prestløkken, E.; Sørensen, M.; Eikevik, Y.M. Water adsorption in feed ingredients for animal pellets at different temperatures, particle size, and ingredient combinations. Drying Technol. 2008, 26, 738-748. http://dx.doi.org/10.1080/07373930802046393
44. Cowan, L.; Haines, F.J.; Everett, H.E.; Crudgington, B.; Johns, H.L.; Clifford, D.; Drew, T.W.; Crooke, H.R. Factors affecting the infectivity of tissues from pigs with classical swine fever: Thermal inactivation rates and oral infectious dose. Vet. Microbiol. 2015, 176, 1-9. http://dx.doi.org/10.1016/j.vetmic.2014.12.003
45. Buckley, A.; Lager, K. Infectious dose of Senecavirus A in market weight and neonatal pigs. PLoS ONE 2022, 17, e0267145. https://doi.org/10.1371/journal. pone.0267145
46. Blázquez, E.; Pujols, J.; Segalés, J.; Rodríguez, F..; Crenshaw, J.; Rodríguez, C.; Ródenas, J.; Polo, J. Commercial feed containing porcine plasma spiked with African swine fever virus is not infective in pigs when administered for 14 consecutive days. PLoS ONE 2020, 15, e0235895. https://doi.org/10.1371/journal.pone.0235895
47. Nishi, T.; Morioka, K.; Kawaguchi, R.; Yamada, M.; Ikezawa, M.; Fukai, K. Quantitative analysis of infection dynamics of foot-and-mouth disease virus strain O/CATHAY in pigs and cattle. PLoS ONE 2021, 16, e0245781. doi:10.1371/journal.pone.0245781
48. Schumacher, L.L.; Woodworth, J.C.; Jones, C.K.; Chen, Q.; Zhang, J.; Gauger, P.C.; Stark, C.R.; Main, R.G.; Hesse, R.A.; Tokach, M.D.; Dritz, S.S. Evaluation of the minimum infectious dose of porcine epidemic diarrhea virus in virus-inoculated feed. Am. J. Vet. Res. 2016, 77, 1108-1113. https://doi.org/10.2460/ajvr.77.10.1108
49. Hermann, J.R.; Munoz-Zanzi, C.A.; Roof, M.B.; Burkhart, K.; Zimmerman, J.J. Probability of porcine reproductive and respiratory syndrome (PRRS) virus infection as a function of exposure route and dose. Vet. Microbiol. 2005, 110, 7-16.
50. Davies, P.R. The dilemma of rare events: Porcine epidemic diarrhea virus in North America. Prev. Vet. Med. 2015, 122, 235–241. doi:10.1016/j.prevetmed. 2015.08.006.
51. Trudeau, M.P.; Verma, H.; Sampedro, F.; Urriola, P.E.; Shurson, G.C.; McKelvey, J.; Pillai, S.D.; Goyal, S.M. Comparison of thermal and non-thermal processing of swine feed and the use of selected feed additives on inactivation of porcine epidemic diarrhea virus (PEDV). PLoS ONE 2016, 11, e0158128. doi:10.1371/journal.pone.0158128
52. Gerber, P.F.; Xiao, C.-T.; Chen, Q.; Zhang, J.; Halbur, P.; Opriessnig, T. The spray-drying process is sufficient to inactivate infectious porcine epidemic diarrhea virus in plasma. Vet Microbiol. 2014, 174, 86-92. http://dx.doi.org/10.1016/j.vetmic.2014.09.008
53. Cochrane, R.A.; Schumacher, L.L.; Dritz, S.S.; Woodworth, J.C.; Huss, A.R.; Stark, C.R.; DeRouchey, J.M.; Tokach, M.D.; Goodband, R.D.; Bia, J.; Chen, Q.; Zhang, J.; Gauger, P.C.; Derscheid, R.J.; Magstadt, D.R.; Main, R.G.; Jones, C.K. Effect of pelleting on survival of porcine epidemic diarrhea virus contaminated feed. J. Anim. Sci. 2017, 95, 1170-1178. doi:10.2527/jas.2016.0961
54. Blázquez, E.; Rodríguez, C.; Ródenas, J.; Segalés, J.; Pujols, J.; Polo, J. Biosafety steps in the manufacturing process of spray-dried plasma: a review with emphasis on the use of ultraviolet irradiation as a redundant biosafety procedure. Porc. Health Manage. 2020, 6, 16. https://doi.org/10.1186/s40813-020-00155- 1
55. Blázquez, E.; Rodríguez, C.; Ródenas, J.; Rosell, R.; Segalés, J.; Pujols, J.; Polo, J. Effect of spray drying and ultraviolet C radiation as biosafety steps for CSFV and ASFV inactivation in porcine plasma. PLoS ONE 2021, 16, e0249935. https://doi.org/10.1371/journal.pone.0249935
56. Niederwerder, M.C.; Dee, S,; Diel, D.G.; Stoian, A.M.M.; Constance, L.A.; Olcha, M.; Petrovan, V.; Patterson, G.; Cino-Ozuna, A.G.; Rowland, R.R.R. Mitigating the risk of African swine fever virus in feed with anti-viral chemical additives. Transbound. Emerg. Dis. 2020, 68, 477-486. doi:10.1111/tbed.13699
57. Jackman, J.A.; Hakobyan, A.; Zakaryan, H.; Elrod, C.C. Inhibition of African swine fever virus in liquid and feed by medium-chain fatty acids and glycerol monolaurate. J. Anim. Sci. Biotechnol. 2020, 11, 114. https://doi.org/10.1186/s40104-020-00517-3
58. Cottingim, K.M.; Verma, H.; Urriola, P.E.; Sampedro, F.; Shurson, G.C.; Goyal, S.M. Feed additives decrease survival of delta coronavirus in nursery pig diets. Porc. Health Manag. 2017, 3, 5. doi:10.1186/s40813-016-0048-8
59. Dee, S.A.; Niederwerder, M.C.; Edler, R.; Hanson, D.; Singrey, A.; Cochrane, R.; Spronk, G.; Nelson, G. An evaluation of additives for mitigating the risk of virus-contaminated feed using an ice block challenge model. Transbound. Emerg. Dis. 2021, 68, 833-845. doi:10.1111/tbed.13749
59. Dee, S.; Neill, C.; Clement, T.; Singrey, A.; Christopher-Hennings, J.; Nelson, E. An evaluation of porcine epidemic diarrhea virus survival in individual feed ingredients in the presence or absence of a liquid antimicrobial. Porc. Health Manag. 2015, 1, 9. doi:10.1186/s40813-015-0003-0
60. Gebhardt, J.T.; Cochrane, R.A.; Woodworth, J.C.; Jones, C.K.; Niederwerder, M.C.; Muckey, M.B.; Stark, C.R.; Tokach, M.D.; DeRouchey, J.M.; Goodband, R.D.; Bai, J.; Gauger, P.C.; Chen, Q.; Zhang, J.; Main, R.G.; Dritz, S.S. Evaluation of the effects of flushing feed manufacturing equipment with chemically treated rice hulls on porcine epidemic diarrhea virus cross-contamination during feed manufacturing. J. Anim. Sci. 2018, 96, 4149-4158. doi:10.1093/jas/sky295
61. Dee, S.; Neill, C.; Singrey, A.; Clement, T.; Cochrane, R.; Jones, C.; Patterson, G.; Spronk, G.; Christopher-Henning, J.; Nelson, E. Modeling the transboundary risk of feed ingredients contaminated with porcine epidemic diarrhea virus. BMC Vet. Res. 2016, 12, 51. https://doi.org/10.1186/s12917-016 0674-z
62. Dee, S.; Neill, C.; Clement, T.; Christopher-Hennings, J.; Nelson, E. An evaluation of a liquid antimicrobial (Sal CURB®) for reducing the risk of porcine epidemic diarrhea virus infection of naïve pigs during consumption of contaminated feed. BMC Vet. Res. 2014, 10, 220. doi:10.1186/s12917-014-0220-9
63. Lerner, A.B.; Cochrane, R.A.; Gebhardt, J.T.; Dritz, S.S.; Jones, C.K.; DeRouchey, J.M.; Tokach, M.D.; Goodband, R.D.; Bai, J.; Porter, E.; Anderson, J.; Gauger, P.C.; Magstadt, D.R.; Zhang, J.; Bass, B.; Karnezos, T.; de Rodas, B.; Woodworth, J.C. Effects of medium chain fatty acids as a mitigation or prevention strategy against porcine epidemic diarrhea virus in swine feed. J. Anim. Sci. 2020, 98, skaa159. https://doi.org/10.1093/jas/skaa159
64. Gebhardt, J.T.; Thomson, K.A.; Woodworth, J.C.; Dritz, S.S.; Tokach, M.D.; DeRouchey, J.M.; Goodband, R.D.; Jones, C.K.; Cochrane, R.A.; Niederwerder, M.C.; Fernando, S.; Abbas, W.; Burkey, T.E. Effect of dietary medium-chain fatty acids on nursery pig growth performance, fecal microbial composition, and mitigation properties against porcine epidemic diarrhea virus following storage. J. Anim. Sci. 2020, 98, 1-11. doi:10.1093/jas/skz358
65. Phillips, F.C.; Rubach, J.K.; Poss, M.J.; Anam, S.; Goyal, S.M.; Dee, S.A. Monoglyceride reduces viability of porcine epidemic diarrhoea virus in feed and prevents disease transmission to post weaned piglets. Transbound. Emerg. Dis. 2022, 69, 121-127. doi:10.1111/tbed.14353
66. Cochrane, R.A.; Dritz, S.S.; Woodworth, J.C.; Stark, C.R.; Saensukjaroenphon, M.; Gebhardt, J.T.; Bai, J.; Hesse, R.A.; Poulsen, E.G.; Chen, Q.; Gauger, P.C.; Derscheid, R.J.; Zhang, J.Q.; Tokach, M.D.; Main, R.G.; Jones, C.K. Assessing the effect of medium-chain fatty acids and fat sources on PEDV infectivity. Transl. Anim. Sci. 2019, 4, 1051-1059. https://doi.org/10.1093/tas/txz179
66. Dee, S.; DeJong, J.; Neill, C.; Ratliff, B.; Singrey, A.; Hansen, E.; Nelson, E.; Keegan, J.; Gaines, A. Inactivation of porcine epidemic diarrhea virus in contaminated swine feed through inclusion of a dry lactic acid-based product. J. Swine Health Prod. 2020, 28, 213-216.
67. Gebhardt, J.T.; Woodworth, J.C.; Jones, C.K.; Tokach, M.D.; Gauger, P.C.; Main, R.G.; Zhang, J.; Chen, Q.; DeRouchey, J.M.; Goodband, R.D.; Stark, C.R.; Bergstrom, J.R.; Bai, J.; Dritz, S.S. Determining the impact of commercial feed additives as potential porcine epidemic diarrhea vurus mitigation strategies as determined by polymerase chain reaction analysis and bioassay. Transl. Anim. Sci. 2019, 3, 93-102. doi:10.1093/tas/txy100
68. Schumacher, L.L.; Huss, A.R.; Cochrane, R.A.; Stark, C.R.; Woodworth, J.C.; Bai, J.; Poulsen, E.G.; Chen, Q.; Main, R.G.; Zhang, J.; Gauger, P.C.; Ramirez, A.; Derscheid, R.J.; Magstadt, D.M.; Dritz, S.S.; Jones, C.K. Characterizing the rapid spread of porcine epidemic diarrhea virus (PEDV) through an animal food manufacturing facility. PLoS ONE 2017, 12, e0187309. https://doi.org/10.1371/journal.pone.0187309
69. Stewart, S.C.; Dritz, S.S.; Woodworth, J.C.; Paulk, C.; Jones, C.K. A review of strategies to impact swine feed biosecurity. Anim. Health Res. Rev. 2020, 21, 61-68. doi:10.1017/S146625231900015X
70. Wu, F.; Cochrane, R.; Yaros, J.; Zhang, C.; Tsai, S.-Y.; Spronk, G. Interventions to reduce porcine epidemic diarrhea virus prevalence in feed in a Chinese swine production system: A case study. Transbound. Emerg. Dis. 2022, 69, 57-65. doi:10.1111/tbed.13699doi:10.1111/tbed.14209
71. Government of Canada. Notice to industry: Changes to import requirements for unprocessed grains and oilseeds, as well as associated meal destined for use in livestock feed. https://www. inspection.gc.ca/animal-health/terrestrial-animals/diseases/reportable/african-swine-fever/2019-03-29/eng/1553708455772/1553708455993
72. FEFAC. Recommendations for the Development of a Biosecurity Plan in the EU Compound Feed Industry, Version 1.0, June 2019. https://fefac.eu/wp-content/uploads/2020/07/recommendation_biosecurity_v10_final-1-1.pdf
73. Australian Government. Importing plant-based animal feed. Department of Agriculture, Fisheries, and Forestry. April 12, 2022. https://www.agriculture.gov.au/biosecurity-trade/import/goods/plant-products/stockfeed-supplements
74. Patterson, G.; Niederwerder, M.C.; Dee, S.A. Risks to animal health associated with imported feed ingredients. J. Amer. Vet. Med. Assoc. 2019, 254, 790-791. https://doi.org/10.2460/javma.254.7.790
75. Shurson, G.C.; Urriola, P.E. 2019. Understanding the vitamin supply chain and relative risk of transmission of foreign animal diseases. https://hdl.handle.net/11299/220189
76. Almeida, F.N.; Htoo, J.K.; Thomson, J.; Stein, H.H. Amino acid digestibility of heat damaged distillers dried grains with solubles fed to pigs. J. Anim. Sci. Biotechnol. 2013, 4, 44. https://doi.org/10.1186/2049-1891-4-44
77. González-Vega, J.C.; Kim, B.G.; Htoo, J.K.; Lemme, A.; Stein, H.H. Amino acid digestibility in heated soybean meal fed to growing pigs. J. Anim. Sci. 2011, 89, 3617-3625. doi: 10.2527/jas.2010-3465
78. Shurson, G.C.; Kerr, B.J.; Hanson, A.R. (2015). Evaluating the quality of feed fats and oils and their effects on pig growth performance. J. Anim. Sci. Biotechnol., 2015, 6, 10. doi: 10.1186/s40104-015-0005-4
79. Slominski, B.A.; Davie, T.; Nyachoti, M.C.; Jones, O. Heat stability of endogenous and microbial phytase during pelleting. Livest. Sci., 2007, 109, 244-246. doi:10.1016/j.livsci.2007.01.124
80. Markowiak, P.; Śliżewska, K. The role of probiotics, prebiotics and synbiotics in animal nutrition. Gut Pathogen, 2018, 10, 21. https://doi.org/10.1186/s13099-018-0250-0
81. Schumacher, L.L.; Cochrane, R.A.; Huss, A.R.; Gebhardt, J.T.; Woodworth, J.C.; Stark, C.R.; Jones, C.K.; Bai, J.; Main, R.G.; Chen, Q.; Zhang, J.; Gauger, P.C.; DeRouchey, J.M.; Goodband, R.D.; Tokach, M.D.; Dritz, S.S. Feed batch sequencing to decrease the risk of porcine epidemic diarrhea virus (PEDV) cross contamination during feed manufacturing. J. Anim. Sci. 2018, 96, 4562-4570. doi:10.1093/jas/sky320
82. Elijah, C.G.; Trujillo, J.D.; Jones, C.K.; Kwon, T.; Stark, C.R.; Cool, K.R.; Paulk, C.B.; Gaudreault, N.N.; Woodworth, J.C.; Morozov, I.; Gallardo, C.; Gebhardt, J.T.; Richt, J.A. Effect of mixing and feed batch sequencing on the prevalence and distribution of African swine fever virus in swine feed. Transbound. Emerg. Dis. 2022, 69, 115-120. doi:10.1111/tbed.14177
83. Huss, A.R.; Schumacher, L.L.; Cochrane, R.A.; Poulsen, E.; Bai, J.; Woodworth, J.C.; Dritz, S.S.; Stark, C.R.; Jones, C.K. Elimination of porcine epidemic diarrhea virus in an animal feed manufacturing facility. PLoS ONE 2017, 12, e0169612. doi:10.1371/journal.pone.0169612
84. Juszkiewicz, M.; Walczak, M.; Woźniakowski, G. Characteristics of selected active substances used in disinfectants and their virucidal activity against ASFV. J. Vet. Res. 2019, 63, 17-25. doi:10.2478/jvetres-2019-0006
85. Greiner, L.L. Evaluation of the likelihood of detection of porcine epidemic diarrhea virus or porcine delta coronavirus ribonucleic acid in areas within feed mills. J. Swine Health Prod. 2016, 24, 198-204.
86. Stoian, A.M.M.; Petrovan, V.; Constance, L.A.; Olcha, M.; Dee, S.; Diel, D.G.; Sheahan, M.A.; Rowland, R.R.R.; Patterson, G.; Niederwerder, M.C. Stability of classical swine fever virus and pseudorabies virus in animal feed ingredients exposed to transpacific shipping conditions. Transbound. Emerg. Dis. 2020, 67, 1623-1632. doi:10.1111/tbed.13498
87. Dee, S.; Shah, A.; Cochrane, R.; Clement, T.; Singrey, A.; Edler, R.; Spronk, G.; Niederwerder, M.; Nelson, E. Use of a demonstration project to evaluate viral survival in feed: Proof of concept. Transbound. Emerg. Dis. 2021, 68, 248-252. doi:10.1111/tbed.13682
88. Palowski, A.; Balestreri, C.; Urriola, P.E.; van de Ligt, J.L.G.; Sampedro, F.; Dee, S.; Shah, A.; Yancy, H.F.; Shurson, G.C.; Schroeder, D.C. Survival of a surrogate African swine fever virus-like algal virus in feed matrices using a 23-day commercial United States truck transport model. Front. Microbiol. 2022, 13, 1059118. doi:10.3389/fmicb.2022.1059118
89. Shurson, G.C.; Hung, Y.-T.; Jang, J.C.; Urriola, P.E. Measures matter – Determining the true nutriphysiological value of feed ingredients for swine. Animals 2021, 11, 1259. doi.org/10.3390/ani11051259
90. Fischer, M.; Mohnke, M.; Probst, C.; Pikalo, J.; Conraths, F.J.; Beer, M.; Blome, S. Stability of African swine fever virus on heat-treated field crops. Transbound. Emerg. Dis. 2020, 67, 2318-2323. doi:10.1111/tbed.13650
91. Songkasupa, T.; Boonpornprasert, P.; Suwankitwat, N.; Lohlamoh, W.; Nuengjamnong, C.; Nuanualsuwan, S. Thermal inactivation of African swine fever virus in feed ingredients. Sci. Rep. 2022, 12, 15998. https://doi.org/10.1038/s41598-022-20290-9
92. Polo, J.; Quigley, J.D.; Russell, L.E.; Campbell, J.M.; Pujols, J.; Lukert, P.D. Efficacy of spray drying to reduce infectivity of pseudorabies and porcine reproductive and respiratory syndrome (PRRS) viruses and seroconversion in pigs fed diets containing spray-dried animal plasma. J. Anim. Sci. 2005, 83, 1933- 1938. https://doi.org/10.2527/2005.8381933x
[/registrados]
