Nuevas perspectivas sobre el tropismo testicular del virus del PRRS
Para leer más contenidos de Revista porciSapiens Octubre 2025
Para leer más contenidos de Revista porciSapiens Octubre 2025
El Síndrome Reproductivo y Respiratorio Porcino (PRRS) sigue siendo uno de los principales retos sanitarios de la producción porcina, no solo por su capacidad de comprometer al sistema inmunitario, sino también por su impacto en la reproducción. Aunque el virus (PRRSV) presenta un tropismo restringido hacia los macrófagos, estudios recientes han demostrado que en verracos sexualmente activos también puede infectar células del epitelio genital, favoreciendo su diseminación a través del semen. La posibilidad de que este fenómeno ocurra en animales prepúberes y su relación con las células madre espermatogoniales (SSCs) abre nuevas líneas de investigación para comprender mejor la patogénesis del virus y su papel en la propagación de la enfermedad.
PRRSV Y LOS INTERROGANTES SOBRE SU TROPISMO TESTICULAR
El PRRSV es un virus de ARN monocatenario de sentido positivo, clasificado dentro del orden Nidovirales, familia Arteriviridae y género Betaarterivirus.
Reportado por primera vez en Estados Unidos en 1987 y posteriormente en Europa en 19901,2, el virus se ha propagado a nivel mundial, convirtiéndose en una de las enfermedades infecciosas más devastadoras económicamente en la producción porcina.
| En cerdas gestantes suele provocar problemas reproductivos, incluyendo un aumento de abortos y mortinatos3, mientras que en verracos ocasiona una disminución de la fertilidad y de la calidad seminal4. |
El virus se caracteriza por una especificidad de hospedador restringida, infectando principalmente macrófagos porcinos.
Una excepción a este tropismo restringido se ha observado en verracos sexualmente activos, donde el virus infecta e induce apoptosis en el epitelio genital7-10, persistiendo en la fracción celular de los eyaculados de animales infectados durante periodos prolongados5.
EL USO DE SEMEN CONTAMINADO EN LA INSEMINACIÓN ARTIFICIAL CONSTITUYE UN FACTOR CLAVE EN LA PROPAGACIÓN DEL PRRS6
En verracos sexualmente maduros infectados con PRRSV, el virus es transportado a los testículos por macrófagos infectados, lo que conduce a la infección de macrófagos testiculares y células del epitelio germinal.
La infección del tejido testicular por PRRSV provoca6,7:
| En el semen de verracos infectados, el genoma de PRRSV se detecta de manera constante en la fracción celular, más que en el plasma seminal, específicamente en células identificadas como macrófagos y células germinales inmaduras7,10. |
El tropismo testicular del PRRSV se ha observado en múltiples estudios7–9, no obstante, la identificación precisa de las células susceptibles dentro del tejido testicular aún se desconoce. No está claro si el virus utiliza CD163 u otros receptores alternativos para infectar estas células y aún no se ha determinado si puede infectar células testiculares en cerdos jóvenes.
En este estudio, se cultivaron células madre espermatogoniales (SSCs) aisladas de lechones y se demostró su susceptibilidad a la infección por PRRSV. Además, se infectaron machos prepúberes con una cepa virulenta de PRRSV, examinando la distribución de células infectadas en los tejidos testiculares recolectados en varios momentos posteriores a la infección.
En los cerdos prepúberes, las células infectadas por PRRSV se encontraron principalmente en el intersticio y periferia de los túbulos seminíferos, pero no en el centro germinal donde residen las SSCs.
LOS RESULTADOS DE ESTE ESTUDIO APORTAN NUEVOS CONOCIMIENTOS SOBRE EL TROPISMO TESTICULAR DEL PRRSV
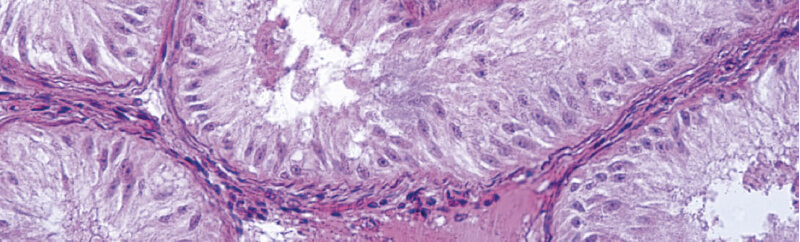
DISEÑO EXPERIMENTAL PARA EXPLORAR LA INFECCIÓN TESTICULAR
Para este estudio se utilizaron células MARC-145, macrófagos alveolares porcinos (PAMs) y células madre espermatogoniales (SSCs) aisladas de lechones recién nacidos.
Las SSCs se obtuvieron a partir de testículos de 1–2 días mediante digestión enzimática y filtración, y posteriormente se enriquecieron en cultivos recubiertos con gelatina y en co-cultivo con células de Sertoli, que actuaron como capa alimentadora.

Las células fueron infectadas con la cepa PRRSV FL1218 a diferentes multiplicidades de infección (MOI 0.1 y 10), evaluándose la replicación viral mediante hibridación in situ (ISH), inmunofluorescencia (IFA) y citometría de flujo, y estableciendo una curva de crecimiento viral de múltiples pasos para comparar la cinética del virus en SSCs, PAMs y MARC-145.
Además, se llevaron a cabo experimentos in vivo en lechones prepúberes de 21 días de edad, libres de PRRSV, que fueron inoculados con la misma cepa viral.

RESULTADOS: DEL LABORATORIO AL MODELO ANIMAL
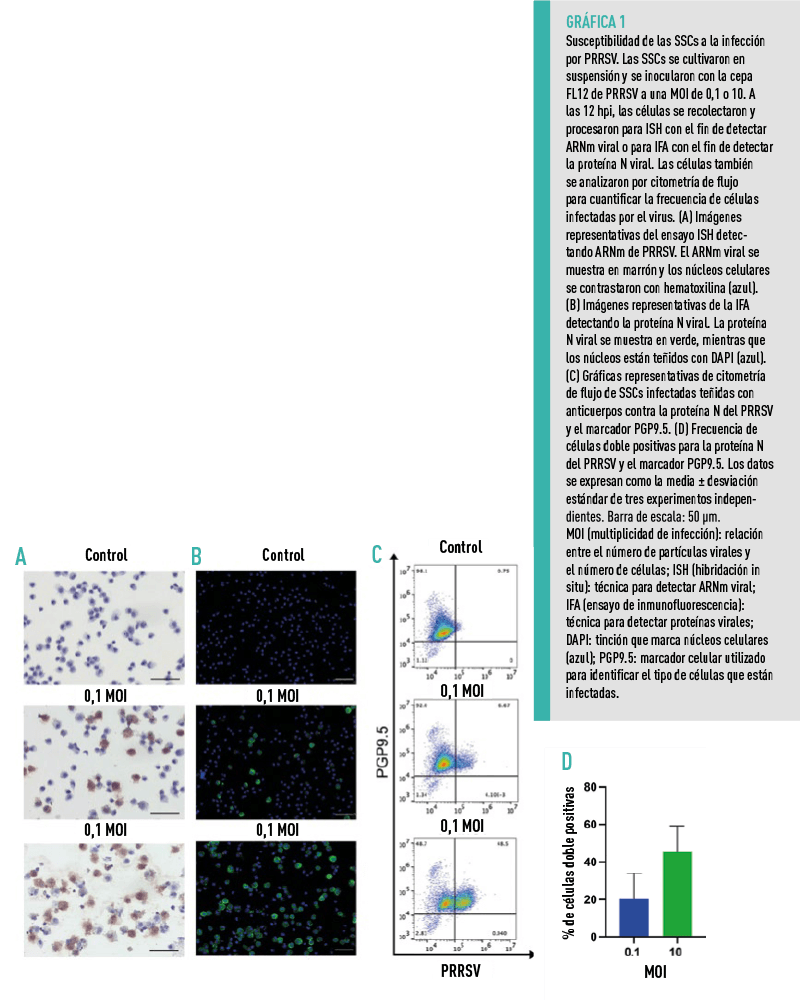
SUSCEPTIBILIDAD DE LAS SSCS A LA INFECCIÓN POR PRRSV
Las SSCs fueron recolectadas aproximadamente 14 días después del co-cultivo con células de Sertoli y posteriormente infectadas con la cepa FL12 de PRRSV a una MOI de 0.1 y 10. A las 12 hpi (12 horas post-infección), se detectaron células infectadas por el virus.

Para cuantificar la frecuencia de células infectadas por el virus, se tiñeron simultáneamente las células con anticuerpos específicos para la proteína viral N y para el marcador PGP9.5.

ESTOS HALLAZGOS DEMUESTRAN QUE LAS SSCS CULTIVADAS EX VIVO SON ALTAMENTE
SUSCEPTIBLES AL PRRSV
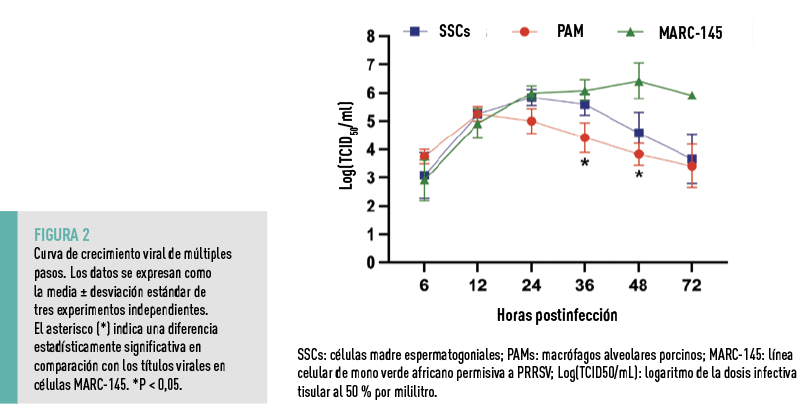
CINÉTICA DE REPLICACIÓN DEL PRRSV EN SSCS
A continuación, se evaluó la cinética de replicación del PRRSV en SSCs y se comparó con la replicación viral en PAMs, la principal célula diana del virus, y en células MARC-145, una línea celular de mono permisiva al virus (Figura 2).
Aunque los títulos virales en SSCs fueron más altos que en PAMs a las 24, 36 y 48 hpi, estas diferencias no fueron estadísticamente significativas.
EN CONJUNTO, SE CONCLUYÓ QUE LAS SSCs SOSTUVIERON LA REPLICACIÓN DEL PRRSV CON UNA CINÉTICA SIMILAR A LA OBSERVADA EN LAS PAMs
TROPISMO TESTICULAR DEL PRRSV EN CERDOS PREPÚBERES
Para investigar el tropismo testicular del PRRSV en animales sexualmente inmaduros, se inocularon 12 lechones no castrados de 28 días de edad con la cepa FL12 del PRRSV.

En diferentes puntos temporales, grupos de tres lechones infectados seleccionados al azar fueron sacrificados, y se recolectaron sus tejidos pulmonares y testiculares para detectar células infectadas mediante ISH.

En los testículos, las células infectadas se encontraron de manera constante en el intersticio desde el día 1 hasta el día 15, aunque la señal disminuyó hacia el final del experimento, en correspondencia con la reducción de la viremia (Figura 3).

NO SE DETECTARON CÉLULAS INFECTADAS DENTRO DEL EPITELIO GERMINAL EN NINGÚN MOMENTO, LO QUE INDICA QUE EL VIRUS NO INFECTA AL EPITELIO GERMINAL DE LOS CERDOS PREPÚBERES
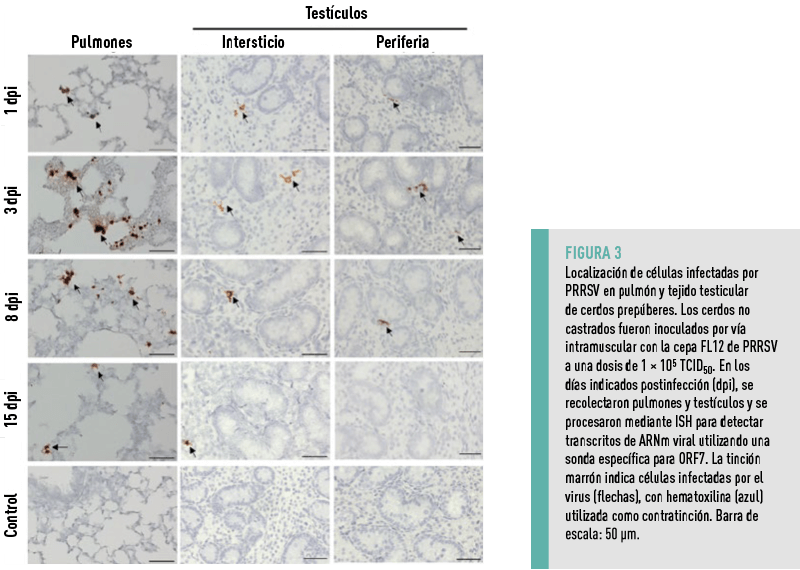
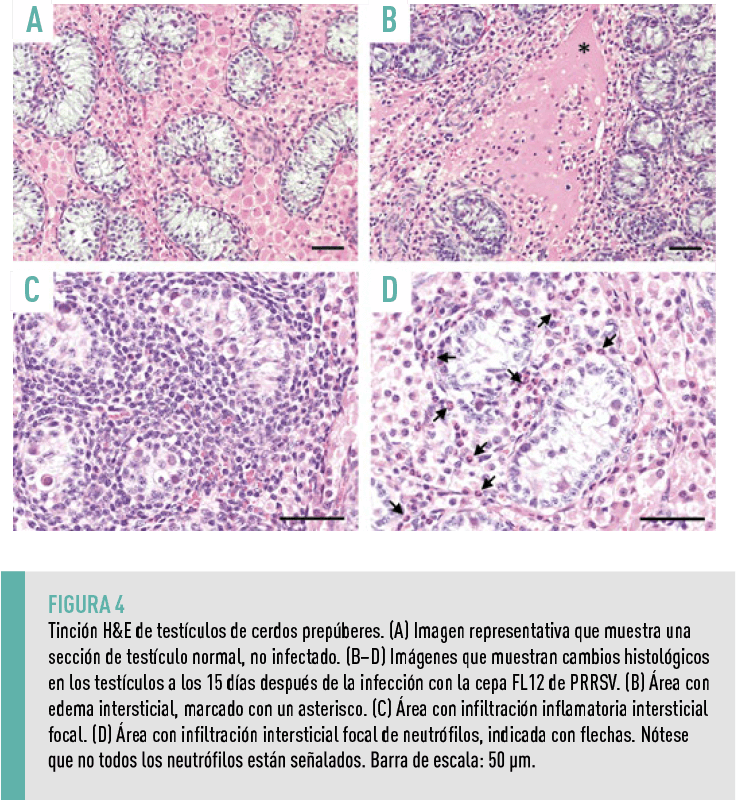
CAMBIOS HISTOLÓGICOS EN LOS TESTÍCULOS
Dada la detección de células infectadas por el virus en los testículos, se examinaron los cambios histológicos en el tejido, observándose cambios histológicos leves en los testículos recolectados a los 15 dpi.
TIPOS CELULARES INFECTADOS POR PRRSV EN TESTÍCULOS DE CERDOS PREPÚBERES
Para identificar los posibles tipos celulares infectados por PRRSV en los testículos de cerdos prepúberes, se realizó ISH para detectar ARN viral junto con IHC para detectar marcadores celulares específicos.
Se utilizaron los siguientes marcadores para identificar diferentes tipos celulares (Figura 5A):
| MIS para células de Sertoli. |  |
Las células positivas para MIS se localizaron dentro de los túbulos seminíferos (Figura 5C), sin co-localizarse con las señales de ARN viral. |
| ASMA para células mioides. |  |
Las señales de ASMA co-localizaron con las señales de ARN viral, lo que indica que las células mioides que rodean los túbulos seminíferos estaban infectadas con PRRSV. Las células positivas para ASMA se detectaron rodeando la membrana basal de los túbulos seminíferos (Figura 5D). |
| PGP9.5 para SSCs. |  |
Las células positivas para PGP9.5 se observaron principalmente en el centro de los túbulos seminíferos, separadas de las células infectadas por el virus (Figura 5B). |
| CD172a y CD163 para macrófagos. |  |
Las células teñidas positivamente para CD172a y CD163 se encontraron principalmente en el intersticio, algunas de las cuales co-localizaron con las señales de ARN viral (Figuras 5E y 5F). |
DISCUSIÓN: PRRSV Y SU HUELLA EN EL TESTÍCULO PORCINO
Se ha señalado previamente que el PRRSV se replica en el tejido reproductivo de verracos sexualmente activos7-9, lo que conduce a la disrupción de la espermatogénesis, la depleción de células germinales, la hipospermatogénesis y la formación de células gigantes multinucleadas6,7.

| En este estudio, se aislaron y cultivaron SSCs de lechones recién nacidos y se demostró que estas células son susceptibles a la infección por PRRSV. Estos resultados, junto con estudios previos7–9, demuestran claramente la capacidad del PRRSV de infectar células distintas de los macrófagos. |
SUSCEPTIBILIDAD DE SSCS Y COMPARACIÓN CON OTROS TIPOS CELULARES
Las SSCs aisladas de lechones recién nacidos y cultivadas ex vivo mostraron una alta susceptibilidad a la infección por PRRSV.
La cinética de replicación viral en SSCs fue similar a la observada en PAMs, su célula diana. Sin embargo, se detectó una diferencia notable en la replicación viral entre SSCs y células MARC-145. Mientras que la replicación del PRRSV en SSCs disminuyó después de las 48 hpi, en las células MARC-145 se mantuvo robusta durante las 72 hpi analizadas. Esta diferencia podría atribuirse a la naturaleza de los tipos celulares:
Como resultado, el virus dispone de un mayor número de células susceptibles en las células MARC-145 que en SSCs y PAMs.
POSIBLES RECEPTORES IMPLICADOS EN LA INFECCIÓN
CD163, el principal receptor celular de PRRSV12, se expresa exclusivamente en monocitos/macrófagos14,15.
En el análisis mediante IHC, no se detectaron señales de CD163 en SSCs dentro de los túbulos seminíferos de cerdos prepúberes.
ES POCO PROBABLE QUE CD163 ESTÉ IMPLICADO EN LA SUSCEPTIBILIDAD DE LAS SSCs A LA INFECCIÓN POR PRRSV
| Se ha reportado que otras moléculas, como vimentina, CD151, sulfato de heparán, sialoadhesina y DC-SIGN, pueden facilitar la infección por PRRSV11. Sin embargo, si estas moléculas se expresan en SSCs y contribuyen a su susceptibilidad al PRRSV sigue siendo desconocido y representa un área lógica para estudios futuros. |
PREPÚBERES VS. ADULTOS: UN CONTRASTE CLAVE
En estudios previos, se ha señalado que la infección de SSCs por PRRSV puede detectarse tan pronto como a los 7 dpi en verracos sexualmente maduros7.
En este estudio, no se detectaron células germinales infectadas por PRRSV en los túbulos seminíferos de cerdos prepúberes durante los 15 días de observación.
En su lugar, las células infectadas por el virus se localizaron en el tejido intersticial, probablemente correspondiendo principalmente a macrófagos que transportan PRRSV hacia esta región. Además, se detectaron células mioides infectadas por PRRSV en la periferia de los túbulos seminíferos.

En lechones jóvenes, las SSCs se localizan en el centro de los túbulos seminíferos y están rodeadas por células de Sertoli16 y, a medida que los cerdos alcanzan la madurez sexual, estas células migran hacia la base de los túbulos seminíferos, donde interactúan con células mioides16.

Las células de Sertoli cultivadas ex vivo no son susceptibles a la infección por PRRSV, lo que sugiere que podrían actuar como una barrera que previene la exposición de las SSCs al virus:
|
 |
ESTE CAMBIO ANATÓMICO EXPLICA POR QUÉ LAS SSCS EN VERRACOS SEXUALMENTE MADUROS SE INFECTAN CON PRRSV, MIENTRAS QUE EN CERDOS JÓVENES NO OCURRE |
IMPLICACIONES PARA LA REPRODUCCIÓN Y FUTUROS MODELOS
| En resumen, se demostró que las SSCs son altamente susceptibles a la infección por PRRSV y se aportó evidencia directa de que células no macrófagos de los cerdos pueden infectarse con PRRSV. Los cultivos de SSCs pueden servir como modelo para investigar receptores virales alternativos para PRRSV y ofrecer una excelente plataforma para desarrollar un modelo in vitro de alteraciones en la espermatogénesis masculina inducidas por virus.
|
Traducido y adaptado de: Durazo- Martínez K, Osorio FA, Delhon G, Hernández J, Vu HLX. 2025. New insights into the testicular tropism of porcine reproductive and respiratory syndrome virus. Microbiol Spectr 13:e02964-24. https://doi.org/10.1128/ spectrum.02964-24
BIBLIOGRAFÍA
1. Keffaber K. 1989. Reproductive failure of unknown etiology. Am Assoc Swine Pract Newsl 1:1–9.
2.Lindhaus W, Lindhaus B. 1991. Mystery swine disease.
3.Rossow KD. 1998. Porcine reproductive and respiratory syndrome. Vet Pathol 35:1–20. https://doi.org/10.1177/030098589803500101
4.Prieto C, Suárez P, Bautista JM, Sánchez R, Rillo SM, Simarro I, Solana A, Castro JM. 1996. Semen changes in boars after experimental infection with porcine reproductive and respiratory syndrome (PRRS) virus. Theriogenology 45:383–395. https://doi.org/10.1016/0093-691x(95)00375-i
5.Christopher-Hennings J, Nelson EA, Hines RJ, Nelson JK, Swenson SL, Zimmerman JJ, Chase CL, Yaeger MJ, Benfield DA. 1995. Persistence of porcine reproductive and respiratory syndrome virus in serum and semen of adult boars. J Vet Diagn Invest 7:456–464. https://doi.org/10.1177/104063879500700406
6. Prieto C, Castro JM. 2005. Porcine reproductive and respiratory syndrome virus infection in the boar: a review. Theriogenology 63:1–16. https://doi.org/10.1016/j.theriogenology. 2004.03.018
7.Sur JH, Doster AR, Christian JS, Galeota JA, Wills RW, Zimmerman JJ, Osorio FA. 1997. Porcine reproductive and respiratory syndrome virus replicates in testicular germ cells, alters spermatogenesis, and induces germ cell death by apoptosis. J Virol 71:9170–9179. https://doi.org/10.1128/JVI.71.12.9170-9179.1997
8.Han K, Seo HW, Park C, Oh Y, Kang I, Chae C. 2013. Comparative pathogenesis of type 1 (European genotype) and type 2 (North American genotype) porcine reproductive and respiratory syndrome virus in infected boar. Virol J 10:156. https://doi.org/10.1186/1743-422X-10-156
9.Han K, Seo HW, Oh Y, Kang I, Park C, Han JH, Kim SH, Chae C. 2013. Pathogenesis of type 1 (European genotype) porcine reproductive and respiratory syndrome virus in male gonads of infected boar. Vet Res Commun 37:155–162. https://doi.org/10.1007/s11259-013-9558-x
10.Christopher-Hennings J, Nelson EA, Nelson JK, Rossow KD, Shivers JL, Yaeger MJ, Chase CC, Garduno RA, Collins JE, Benfield DA. 1998. Identification of porcine reproductive and respiratory syndrome virus in semen and tissues from vasectomized and nonvasectomized boars. Vet Pathol 35:260–267. https://doi.org/10.1177/030098589803500404
11.Zhang Q, Yoo D. 2015. PRRS virus receptors and their role for pathogenesis. Vet Microbiol 177:229–241. https://doi.org/10.1016/j.vetmic.2015.04.002
12. Calvert JG, Slade DE, Shields SL, Jolie R, Mannan RM, Ankenbauer RG, Welch S-KW. 2007. CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses. J Virol 81:7371 7379. https://doi.org/10.1128/JVI.00513-07
13.Brinster RL, Avarbock MR. 1994. Germline transmission of donor haplotype following spermatogonial transplantation. Proc Natl Acad Sci USA 91:11303–11307. https://doi.org/10.1073/pnas.91.24.11303
14.Pulford K, Micklem K, McCarthy S, Cordell J, Jones M, Mason DY. 1992. A monocyte/macrophage antigen recognized by the four antibodies GHI/61, Ber-MAC3, Ki-M8 and SM4. Immunology 75:588–595.
15.Kristiansen M, Graversen JH, Jacobsen C, Sonne O, Hoffman HJ, Law SK, Moestrup SK. 2001. Identification of the haemoglobin scavenger receptor. Nature 409:198–201. https://doi.org/10.1038/35051594
16. Zheng Y, Gao Q, Li T, Liu R, Cheng Z, Guo M, Xiao J, Wu D, Zeng W. 2022. Sertoli cell and spermatogonial development in pigs. J Anim Sci Biotechnol 13:45. https://doi.org/10.1186/s40104-022-00687-2
17.Sakib S, Uchida A, Valenzuela-Leon P, Yu Y, Valli-Pulaski H, Orwig K, Ungrin M, Dobrinski I. 2019. Formation of organotypic testicular organoids in microwell culture†. Biol Reprod 100:1648–1660. https://doi.org/10.1093/biolre/ioz053
18. Truong HM, Lu Z, Kutish GF, Galeota J, Osorio FA, Pattnaik AK. 2004. A highly pathogenic porcine reproductive and respiratory syndrome virus generated from an infectious cDNA clone retains the in vivo virulence and transmissibility properties of the parental virus. Virology 325:308-319
Te puede interesar: Diagnóstico molecular del PRRS: de la PCR a tiempo real a la secuenciación masiva
