
Para leer más contenidos de Revista porciSapiens Abril 2022
Para leer más contenidos de Revista porciSapiens Abril 2022
| Desde que se publicaran hace casi 14 años los resultados del estudio europeo sobre salmonelosis en el ganado porcino en el que España resultó líder en casi todas las categorías (abuelas, madres y cerdos de cebo) (EFSA 2008, 2009), poco hemos mejorado al respecto en nuestro país.
La carne de cerdo se considera desde entonces una de las principales fuentes de infección por Salmonella para las personas, pero, a pesar de ello, y de nuestro liderazgo en el sector porcino europeo, son pocos los esfuerzos que se han hecho para controlar esta infección en nuestras explotaciones. |
REPASO HISTÓRICO A LOS PROGRAMAS DE CONTROL DE SALMONELLA
En realidad, que los cerdos fueran una fuente significativa de salmonelosis humana se conocía desde mucho antes. Fueron los suecos los que, tras sufrir un importante brote de salmonelosis humana asociado con el consumo de productos animales contaminados a mediados de la década de 1950, iniciaron lo que se conoció como el primer Programa Nacional de Control de Salmonella en Europa (Lundbeck et al, 1955).
 Ese programa planteó, como principal objetivo, suministrar productos animales para consumo humano, incluida la carne de cerdo, libres de Salmonella, y se diseñó para prevenir la contaminación por esta bacteria de toda la cadena de producción cárnica.
Ese programa planteó, como principal objetivo, suministrar productos animales para consumo humano, incluida la carne de cerdo, libres de Salmonella, y se diseñó para prevenir la contaminación por esta bacteria de toda la cadena de producción cárnica.
Tras el programa de control sueco, otros países escandinavos siguieron su ejemplo, con Dinamarca, uno de los principales países europeos exportadores de cerdo, iniciando su propio programa en 1995 (Mousing et al., 1997).
El éxito de los programas escandinavos, aunque a un alto coste económico, junto con el desarrollo de una nueva normativa europea (Reglamento -CE- n º 2160/2003 sobre el control de la Salmonella y otros agentes zoonóticos específicos transmitidos por los alimentos), impulsó el inicio de nuevos programas nacionales de control en otros países (Alemania y Reino Unido en 2002, Irlanda en 2003, Países Bajos
EL RETO DEL CONTROL DE LA SALMONELOSIS EN EL PORCINO
El problema de controlar una infección como la salmonelosis en un entorno productivo como el del porcino es evidente. La cadena de producción de carne de cerdo es un proceso complejo que, de forma resumida, podría dividirse en cuatro fases claramente diferenciadas:
Hoy en día, se sabe que son numerosos los factores que favorecen la presencia y mantenimiento de Salmonella en las explotaciones, y la gran mayoría de ellos pueden presentarse en cualquiera de las fases anteriores, dificultando enormemente el control de esta infección. Estos factores podrían agruparse en cuatro categorías principales: bioseguridad, higiene, estrés y alimentación (Figura 1).
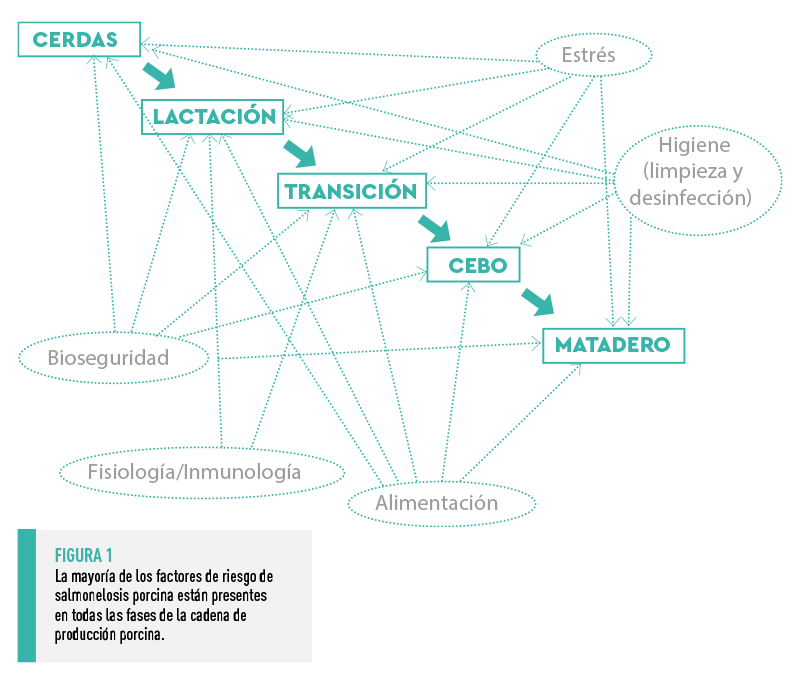
Los cerdos de engorde se consideran la principal fuente de contaminación de las canales en el matadero (Argüello et al., 2013), por ello, la salmonelosis se ha estudiado especialmente durante la fase de cebo.
![]() En este periodo es fácil recoger muestras, ya sea en la granja (sangre y heces), o en el momento del sacrificio (sangre, jugo de carne, contenido gastrointestinal, nódulos linfáticos mesentéricos, amígdalas o las propias canales) y monitorizar la infección.
En este periodo es fácil recoger muestras, ya sea en la granja (sangre y heces), o en el momento del sacrificio (sangre, jugo de carne, contenido gastrointestinal, nódulos linfáticos mesentéricos, amígdalas o las propias canales) y monitorizar la infección.
| La mayoría de los programas de control se han centrado en esta fase al final de la cadena productiva, implementándose en ese momento diferentes acciones para intentar reducir la infección en la explotación.
|
¿QUÉ SABEMOS DE LA SALMONELOSIS EN LACTACIÓN Y TRANSICIÓN?
Existe una escasa información sobre la epidemiología de la salmonelosis porcina durante la lactación y transición, a pesar de que son dos épocas de gran riesgo para los animales.
Los lechones nacen prácticamente desprotegidos, en un ambiente posiblemente contaminado por Salmonella (un 30% de las explotaciones de madres son positivas a Salmonella en la UE según el estudio de la EFSA, y más del 60% en España), y necesitan urgentemente de la inmunidad maternal obtenida a través del calostro.
![]() Así, ingestión de calostro y de Salmonella pueden ocurrir casi simultáneamente en el caso de que la cerda esté infectada y haya excretado la bacteria por las heces en ese periodo de estrés asociado con el parto.
Así, ingestión de calostro y de Salmonella pueden ocurrir casi simultáneamente en el caso de que la cerda esté infectada y haya excretado la bacteria por las heces en ese periodo de estrés asociado con el parto.
Tras el destete, los lechones vuelven a ser muy vulnerables a patógenos entéricos, pues la colonización intestinal por estas bacterias se ve favorecida por dos factores principales:
![]() La disbiosis intestinal generada por el cambio de dieta.
La disbiosis intestinal generada por el cambio de dieta.
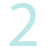 El estrés asociado a un nuevo entorno, al ser separados de la madre y mezclados con otros lechones (Campbell et al., 2013).
El estrés asociado a un nuevo entorno, al ser separados de la madre y mezclados con otros lechones (Campbell et al., 2013).

A pesar de todo, son escasos los trabajos que han estudiado la prevalencia de esta infección en estas fases tempranas. Y es que, si se quisiera determinar con cierta precisión la prevalencia de infección por Salmonella en lechones de explotaciones comerciales, se requeriría del sacrificio (posiblemente poco ético) de un gran número de animales jóvenes.
![]() Solo hay algún estudio que estima la proporción de lechones que eliminan Salmonella en grupos de animales muy concretos y, generalmente, los resultados publicados suelen indicar una baja proporción de animales excretores (Funk et al, 2001; Baber et al., 2002).
Solo hay algún estudio que estima la proporción de lechones que eliminan Salmonella en grupos de animales muy concretos y, generalmente, los resultados publicados suelen indicar una baja proporción de animales excretores (Funk et al, 2001; Baber et al., 2002).
| La cuestión entonces es saber si estos resultados reflejan una realidad o podrían estar sesgados por el tipo de muestra analizada y/o las circunstancias que rodean esos periodos. |

En el inicio de la transición, sin embargo, aunque la cantidad de materia fecal a analizar podría haber sido mayor, es habitual el uso de antimicrobianos en el pienso/agua (colistina –hasta hace poco-, y óxido de zinc) que estarían dificultando la detección de la bacteria. Así, es muy escasa y, seguramente, sesgada la información que tenemos sobre esta infección en estos dos periodos.
PREVALENCIA DE SALMONELLA EN LECHONES DESTETADOS
En este artículo se presentan los resultados de un estudio que tuvo como principal objetivo estimar la prevalencia de infección por Salmonella en lechones al destete en granjas comerciales.
![]() Para ello, se aprovechó de la existencia en España de mataderos especializados en el sacrificio de lechones para consumo.
Para ello, se aprovechó de la existencia en España de mataderos especializados en el sacrificio de lechones para consumo.
| Los resultados obtenidos deberían ayudarnos a entender lo que puede estar ocurriendo con la salmonelosis porcina en esas fases iniciales de la cadena de producción, cuando además intervienen algunos factores inmunológicos y fisiológicos exclusivos de los animales en este periodo (Figura 1). |
MATERIAL Y MÉTODOS
![]()
Para estimar la prevalencia de infección por Salmonella en este tipo de animales se analizaron lechones sacrificados para consumo humano en mataderos comerciales. En España se sacrificaron casi dos millones de lechones para consumo en 2018 (MAPAMA, 2020).
![]() Se trata generalmente de lechones entre 4 y 6 semanas de vida con un peso medio de 7,5 kg. Estos animales están libres de antibióticos, pues no pueden tratarse antes de su sacrificio.
Se trata generalmente de lechones entre 4 y 6 semanas de vida con un peso medio de 7,5 kg. Estos animales están libres de antibióticos, pues no pueden tratarse antes de su sacrificio.
Los lechones procedían de 5 explotaciones que presentaban valores medios de seroprevalencia a Salmonella >50%.
MUESTREO ANÁLISIS
| En el matadero, los lechones se seleccionaban aleatoriamente del lote que se sacrificaba el día del muestreo y de cada lechón seleccionado se recogía el paquete gastrointestinal completo. De ahí se obtenían nódulos linfáticos mesentéricos (NLM) y contenido intestinal (CI) para la detección de Salmonella. Se recogía un pedazo de músculo diafragmático para la obtención de jugo muscular (JM) para la detección de anticuerpos frente a Salmonella (Figura 2). |

|
| A lo largo de los dos años del estudio, se fueron recogiendo cada 3-4 meses muestras fecales individuales de cerdas de la explotación y muestras de heces (pools) de las naves de cebo para la detección e identificación de los serotipos de Salmonella circulantes. Se recogieron muestras de suero para monitorizar la seroprevalencia frente a Salmonella en cerdas y cebo. |
 |
Las salmonelas aisladas, tanto de lechones como de cerdas y animales de cebo, se enviaron a serotipar al Laboratorio de Referencia para Salmonelosis Animales en Algete, Madrid.
![]() Posteriormente, se realizó el tipado molecular de algunos de los serotipos coincidentes encontrados, tanto en lechones (NLM y CI) como en cerdas y naves de cebo (heces), mediante la técnica de electroforesis por campos pulsados (PFGE) en la Facultad de Veterinaria de Zaragoza.
Posteriormente, se realizó el tipado molecular de algunos de los serotipos coincidentes encontrados, tanto en lechones (NLM y CI) como en cerdas y naves de cebo (heces), mediante la técnica de electroforesis por campos pulsados (PFGE) en la Facultad de Veterinaria de Zaragoza.
RESULTADOS Y DISCUSIÓN
![]()
MADRES Y CEBO
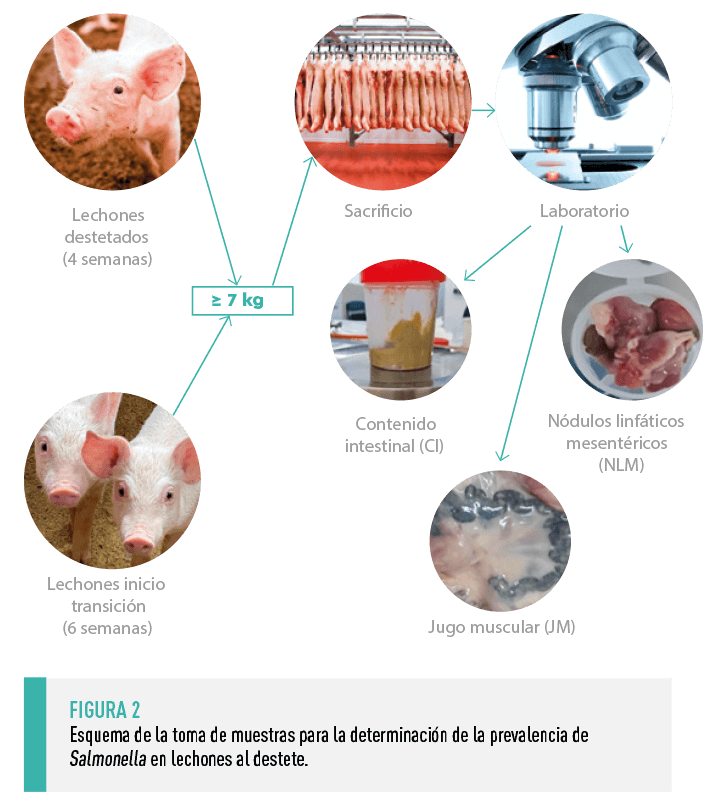
En las 5 explotaciones se aisló con regularidad Salmonella en las heces de las cerdas, así como en las muestras de heces de las naves de cebo (Tablas 1 y 2). Igualmente, la seroprevalencia se mantuvo muy alta en las cerdas (72% de media), aunque algo más baja en los animales de cebo (24,2%).
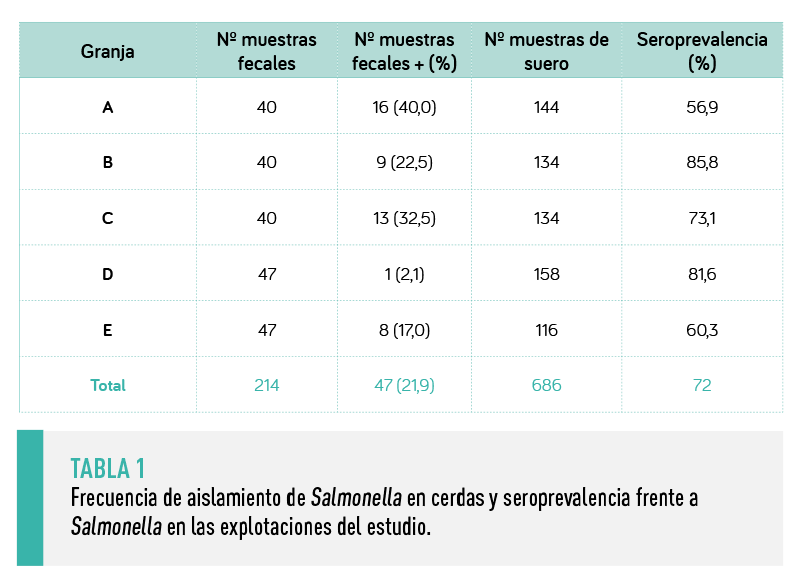
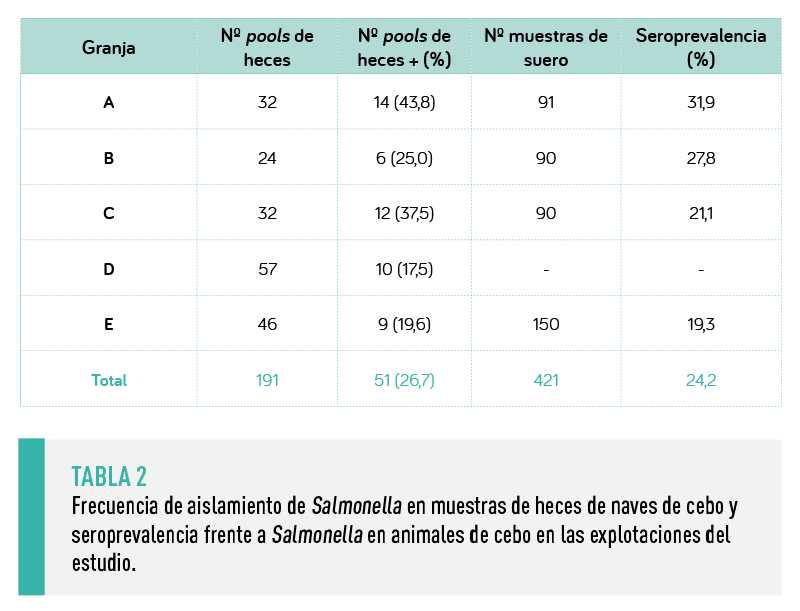
ESTOS RESULTADOS INDICABAN QUE SALMONELLA CIRCULABA CONSISTENTEMENTE TANTO EN LAS EXPLOTACIONES DE MADRES COMO EN LAS NAVES DE CEBO DURANTE LA DURACIÓN DEL ESTUDIO
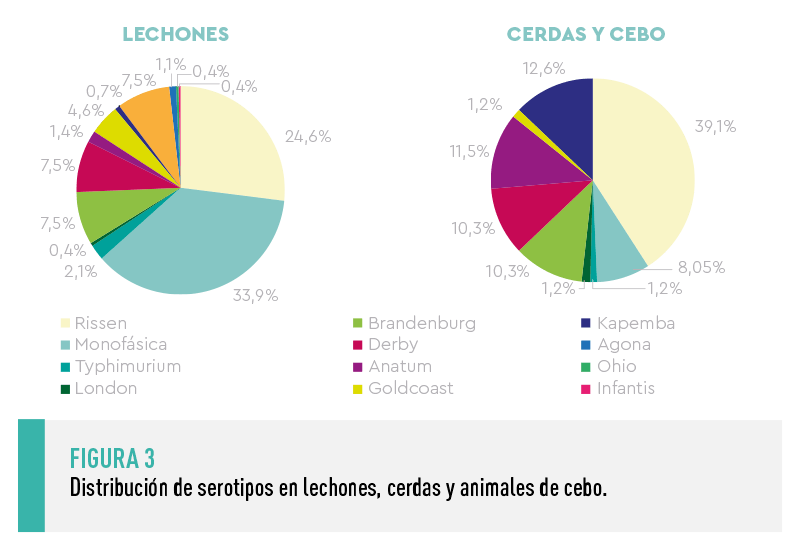
Los principales serotipos identificados en las muestras de madres y animales de cebo se presentan en la Figura 3.
![]() El serotipo predominante fue Rissen, seguido de Kapemba, Anatum, Derby, Brandenburgo y la variante monofásica de Typhimurium. Entre estos serotipos, los de mayor interés por su impacto en Salud Pública serían la variante monofásica de Typhimurium, Derby y, en menor medida, Rissen.
El serotipo predominante fue Rissen, seguido de Kapemba, Anatum, Derby, Brandenburgo y la variante monofásica de Typhimurium. Entre estos serotipos, los de mayor interés por su impacto en Salud Pública serían la variante monofásica de Typhimurium, Derby y, en menor medida, Rissen.
LECHONES
Se analizaron un total de 884 lechones:
En la Tabla 3 se pueden observar los resultados de infección (Salmonella en NLM) y excreción (Salmonella en CI) para ambos tipos de lechones.
![]() Se observaron prevalencias de infección y excreción muy altas (≈36%) y similares en ambos grupos, indicando que los lechones a estas edades se infectan con Salmonella sin necesidad de presentar signos clínicos y, por tanto, actúan como portadores activos (diseminadores) de la bacteria.
Se observaron prevalencias de infección y excreción muy altas (≈36%) y similares en ambos grupos, indicando que los lechones a estas edades se infectan con Salmonella sin necesidad de presentar signos clínicos y, por tanto, actúan como portadores activos (diseminadores) de la bacteria.

La proporción de lechones excretando Salmonella fue muy superior a lo observado en otros estudios, pero en este caso la cantidad de heces que se pudieron analizar fue muy superior a la que se hubiera obtenido con un hisopo.
Esto justificaría la mayor sensibilidad del cultivo bacteriológico en este estudio y, por lo tanto, la mayor prevalencia de excreción.
![]() Además, el hecho de que se tratara de animales destinados a matadero pudo influir en una mayor eliminación de Salmonella debido al estrés generado durante el transporte y la espera previa al sacrificio (Scherer et al., 2008).
Además, el hecho de que se tratara de animales destinados a matadero pudo influir en una mayor eliminación de Salmonella debido al estrés generado durante el transporte y la espera previa al sacrificio (Scherer et al., 2008).
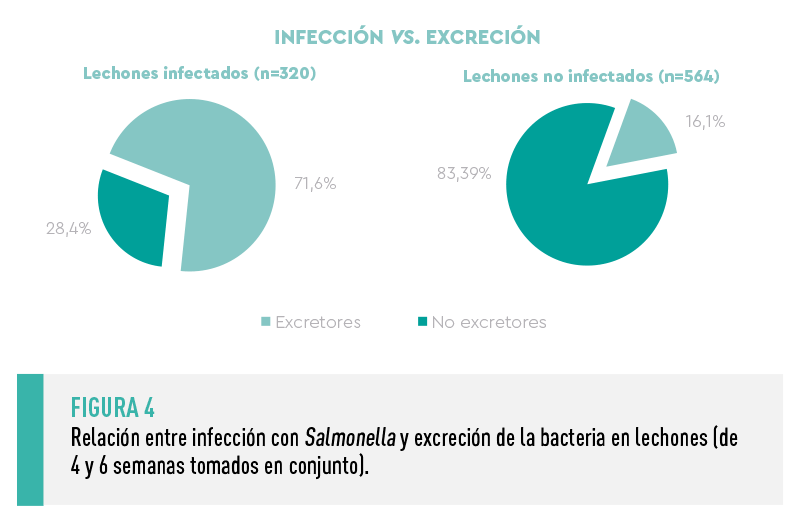
Como era de esperar, se observó una relación significativa entre la presencia de Salmonella en NLM y la probabilidad de excretar la bacteria en heces (CI).
![]() Un lechón infectado (NLM positivo) presentó una probabilidad 10 veces superior de excretar Salmonella (CI positivo) que un lechón NLM negativo (Figura 4).
Un lechón infectado (NLM positivo) presentó una probabilidad 10 veces superior de excretar Salmonella (CI positivo) que un lechón NLM negativo (Figura 4).
| Mediante la técnica de PFGE pudimos confirmar que, en el 97,5% (39) de los 40 lechones infectados que se analizaron, se encontró una alta homología genética (≥ 90%) entre los aislados de Salmonella obtenidos de NLM y aquellos obtenidos de CI.
|
En estudios experimentales se ha demostrado que la excreción es particularmente importante durante las dos primeras semanas tras la primo infección (Scherer et al., 2008; Pires et al., 2013) por lo que, en este caso, es muy probable que los lechones se hubieran infectado en algún momento en las primeras semanas de lactación.
Respecto a los serotipos observados, se detectó una mayor variedad de serotipos en los lechones que en los animales adultos o de cebo (Figura 3), aunque en esta diferencia pudo influir el menor número de muestras positivas analizadas en este segundo grupo.
![]() En cualquier caso, cabe destacar que la mayoría (82%) de los serotipos detectados en cerdas y cebos se detectaron también en los lechones, aunque con una frecuencia de presentación diferente.
En cualquier caso, cabe destacar que la mayoría (82%) de los serotipos detectados en cerdas y cebos se detectaron también en los lechones, aunque con una frecuencia de presentación diferente.
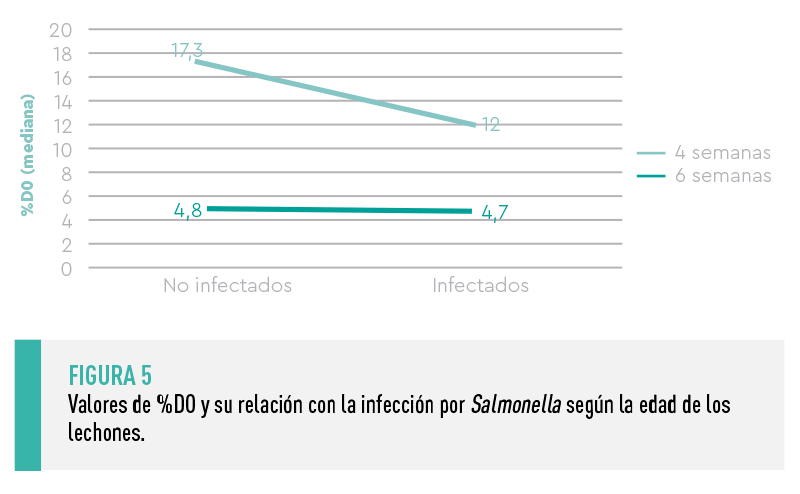
Los valores de %DO fueron significativamente superiores en los lechones de 4 semanas de vida (mediana %DO= 15,5) con respecto a los de 6 semanas de vida (mediana %DO=4,7; P<0,001), indicando una importante reducción de los anticuerpos maternales frente a Salmonella entre las 4 y 6 semanas de vida.
En el caso particular de los lechones de 4 semanas, el valor de %DO fue significativamente superior en los lechones no infectados por Salmonella comparado con los infectados (17,3 vs. 12, respectivamente; P=0,002), lo que sugería el posible efecto protector de la inmunidad maternal.
![]() Este efecto no se observó a las 6 semanas de vida, probablemente debido a que los niveles de anticuerpos eran ya muy bajos (Figura 5).
Este efecto no se observó a las 6 semanas de vida, probablemente debido a que los niveles de anticuerpos eran ya muy bajos (Figura 5).
RELACIÓN ENTRE AISLADOS DE SALMONELLA DETECTADOS EN LECHONES Y EN MADRES O ANIMALES DE CEBO
Como análisis final, se compararon genéticamente aislados del mismo serotipo obtenidos de lechones, cerdas y naves de cebo. La técnica de PFGE permitió identificar cepas genéticamente similares (>90% homología) entre lechones de 4 semanas y cerdas adultas en 4 de las explotaciones estudiadas.
![]() Estos aislados perduraban en la explotación largos periodos de tiempo, encontrando la misma cepa en muestreos realizados con una diferencia de 200 días o más, lo que reforzaría la importancia de la transmisión madre-lechón y el papel de estos en el mantenimiento de la contaminación en la explotación.
Estos aislados perduraban en la explotación largos periodos de tiempo, encontrando la misma cepa en muestreos realizados con una diferencia de 200 días o más, lo que reforzaría la importancia de la transmisión madre-lechón y el papel de estos en el mantenimiento de la contaminación en la explotación.
También se detectaron aislados genéticamente similares entre lechones de 6 semanas de vida (principio de transición) y muestras obtenidas de las naves de cebo de las 4 explotaciones donde se pudieron comparar este tipo de aislados.
![]() Esta relación se detectó para los tres serotipos más predominantes en las naves de cebo (Rissen, Derby y la variante monofásica de Typhimurium), lo que sugería el mantenimiento de la infección entre la fase de transición y la de cebo.
Esta relación se detectó para los tres serotipos más predominantes en las naves de cebo (Rissen, Derby y la variante monofásica de Typhimurium), lo que sugería el mantenimiento de la infección entre la fase de transición y la de cebo.

CONCLUSIONES
En explotaciones comerciales con alta seroprevalencia, la prevalencia de salmonelosis en lechones en el periodo alrededor del destete puede ser muy alta. Los lechones pueden infectarse de forma subclínica y actuar como portadores activos de Salmonella, estando el origen de la infección muy probablemente en las madres.
Los resultados del estudio también apuntan a la importancia del calostro en la protección de los lechones frente a esta infección.
| Las relaciones genéticas entre aislados sugieren la existencia de una transmisión de Salmonella de madres a lechones que alcanza a su vez a los animales en el cebo.
|
BIBLIOGRAFÍA
Argüello H, Álvarez-Ordoñez A, Carvajal A, Rubio P, Prieto M. 2013. Role of slaughtering in Salmonella spreading and control in pork production. J Food Prot 76:899–911.
Barber DA, Bahnson PB, Isaacson R, Jones CJ, Weigel RM. 2002. Distribution of Salmonella in swine production ecosystems. J Food Prot 65:1861–1868.
Bianchi AT, Moonen-Leusen HW, van der Heijden PJ, Bokhout BA. 1995. The use of a double antibody sandwich ELISA and monoclonal antibodies for the assessment of porcine IgM, IgG and IgA concentrations. Vet Immunol Immunopathol 44:309–317
Campbell JM, Crenshaw JD, Polo J. 2013. The biological stress of early weaned piglets. J Anim Sci Biotechnol 4:19.
EFSA. 2008. Report of the Task Force on Zoonoses Data Collection on the analysis of the baseline survey on the prevalence of Salmonella in slaughter pigs. Part A. EFSA J 135: 1-111.
EFSA. 2009. Analysis of the baseline survey on the prevalence of Salmonella in holdings with breeding pigs, in the EU. Part A. EFSA J 7 (12): 93 pp.
Funk JA, Davies PR, Nichols MA. 2000. The effect of fecal sample weight on detection of Salmonella enterica in swine feces. J Vet Diagn Invest 12:412–418.
Funk JA, Davies PR, Nichols MA. 2001. Longitudinal study of Salmonella enterica in growing pigs reared in multiple-site swine production system. Vet Microbiol 83:45–60.
Lundbeck H, Plazikowski U, Silverstolpe L. 1955. The Swedish Salmonella outbreak of 1953. J App Microbiol 18: 535–548.
MAPAMA. 2020. El sector de la carne de cerdo en cifras: principales indicadores económicos 2019. Ministerio de Agricultura y Pesca, Alimentación y Medio Ambiente, España. https://www.mapa.gob.es/es/ganaderia/estadisticas/indicadoreseconomicoscarnedecerdo2019_tcm30379728.pdf. Consultado el 22 de junio de 2021.
Mousing J, Jensen PT, Halgaard C, Bager F, Feld N, Nielsen B, Bech-Nielsen, S. 1997. Nation-wide Salmonella enterica surveillance and control in Danish slaughter swine herds. Prev Vet Med 29: 247–261.
Pires AF, Funk JA, Bolin CA. 2013. Longitudinal study of Salmonella shedding in naturally infected finishing pigs. Epidemiol Infect 141: 1928–1936.
Scherer K, Szabó I, Rösler U, Appel B, Hensel A, Nöckler K. 2008. Time course of infection with Salmonella typhimurium and its influence on fecal shedding, distribution in inner organs, and antibody response in fattening pigs. J Food Prot 71:699–705.
