Para leer más contenidos de Revista porciSapiens Abril 2025
Para leer más contenidos de Revista porciSapiens Abril 2025
La implementación de limitaciones en el uso de antibióticos, junto con la retirada del óxido de zinc y el incremento de la circulación de virus PRRS, han dado lugar a un escenario sanitario distinto al que conocíamos anteriormente. Este cambio ha estado marcado en gran medida por empeoramiento de los datos productivos.
Esta situación requiere un cambio en la forma de abordar la producción porcina. Para ello, hoy en día disponemos de herramientas nuevas que permiten la monitorización de las granjas, facilitando la adopción de medidas para limitar el impacto de las enfermedades.
BIOMARCADORES SALIVALES
La saliva es un fluido biológico que adquiere cada vez más importancia en las pruebas diagnósticas veterinarias.

En la actualidad, existen numerosos analitos medibles que pueden aportar información sobre el estatus sanitario y el bienestar de nuestra población porcina.
Existe una serie de biomarcadores entre los que destacan los siguientes:

No está influenciada por los efectos del estrés térmico, por lo que es una buena herramienta para la determinación de la intensidad de un proceso infeccioso.


EJE INTESTINO-PULMÓN
La mucosa intestinal está altamente correlacionada con otros órganos, como la glándula mamaria y el pulmón, de modo que los cambios que se puedan producir a nivel local tienen repercusiones a nivel general.
Estas alteraciones surgen de varias maneras:


ES FUNDAMENTAL ADOPTAR UNA NUEVA PERSPECTIVA SOBRE EL IMPACTO DE LOS PROCESOS RESPIRATORIOS SOBRE LA MICROBIOTA Y SANIDAD INTESTINAL DE LOS ANIMALES
Este nuevo escenario, con una notable reducción de antibióticos en producción, conlleva un cambio importante en la microbiota intestinal.
Esto se debe a que muchas patologías digestivas, anteriormente enmascaradas por el uso generalizado de antibióticos para el control de enfermedades, ahora se manifiestan con mayor claridad.

| El estado de disbiosis inducido por un proceso respiratorio incrementa la inflamación y compromete la integridad de la barrera intestinal, lo que conlleva un aumento de su permeabilidad. A su vez, la alteración de la mucosa intestinal puede amplificar la inflamación pulmonar y reducir la eficacia de la respuesta inmunitaria del animal. |

|
FIGURA 1. Interacciones en el eje intestino-pulmón: comunicación bidireccional entre las mucosas respiratoria y digestiva. Las infecciones a nivel respiratorio desencadenan una cascada de eventos que afectan al sistema digestivo, entre ellos, un aumento de citoquinas inflamatorias y una disminución del consumo de alimento, lo que repercute en la producción de ácidos grasos de cadena corta (SCFA) y en la estimulación de los receptores tipo Toll (TLR). Estos cambios favorecen la aparición de disbiosis intestinal, caracterizada por un aumento de la inflamación, una menor integridad de la barrera intestinal y una reducción en la producción de péptidos antimicrobianos (AMPs). Todo ello compromete la inmunidad innata y predispone a superinfecciones bacterianas, tanto respiratorias como digestivas. |
BIOMARCADORES SALIVALES COMO HERRAMIENTA PARA EVALUAR LA RESPUESTA VACUNAL FRENTE A LAWSONIA INTRACELLULARIS
Con el fin de determinar si una vacuna inactivada frente a Lawsonia intracellularis puede ejercer una influencia positiva más allá de los parámetros productivos —cuyo beneficio ya está ampliamente demostrado—, este estudio analizó su posible efecto sobre la evolución de las enfermedades respiratorias en cerdos de cebo. Para ello, se estudiaron los cambios tras la vacunación en los niveles salivales de:



MATERIAL Y MÉTODOS
Se trabajó con dos grupos de 630 animales cada uno —vacunados y control— en los que se evaluaron los parámetros productivos.
Dentro de cada grupo, se seleccionaron al azar 15 lechones de 10 semanas de edad al inicio del cebo, que fueron identificados con un crotal de la explotación y otro individual.
Todos los animales del grupo vacunado habían recibido la vacuna inactivada Porcilis® Lawsonia (MSD Animal Health) frente a L. intracellularis al destete.
Durante el estudio, se obtuvieron muestras de los 15 lechones de cada grupo en cuatro momentos diferentes del engorde:




RESULTADOS
DINÁMICA DE SEROCONVERSIÓN
![]()
Primer muestreo a las 10 semanas de vida (entrada al cebo, T1)
Se detectó una diferencia altamente significativa en cuanto al porcentaje de positivos entre ambos grupos (chi cuadrado de Pearson =9,130; p=0,003), siendo la proporción de positivos mayor en el grupo vacunado.
La dinámica de seroconversión frente L. intracellularis siguió un patrón que permite afirmar que no había recirculación hasta las 10 semanas de vida, solamente apareciendo el grupo vacunado, como es lógico, debido a la vacuna (Gráfica 1).
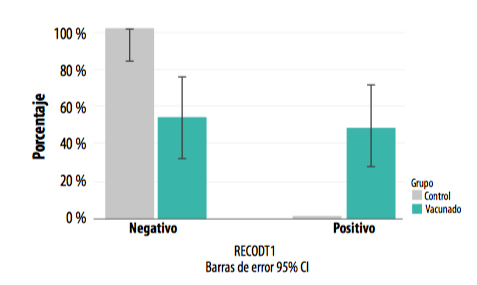
GRÁFICA 1: Presencia de positivos y negativos a L. intracellularis en ambos grupos a la entrada en cebo (T1).
Segundo muestreo (al mes de entrar, T2)
En la segunda toma de muestras se detectó una diferencia significativa en cuanto al porcentaje de positivos entre ambos grupos (chi cuadrado de Pearson =3,968; p=0,046), siendo la proporción de positivos mayor en el grupo vacunado.

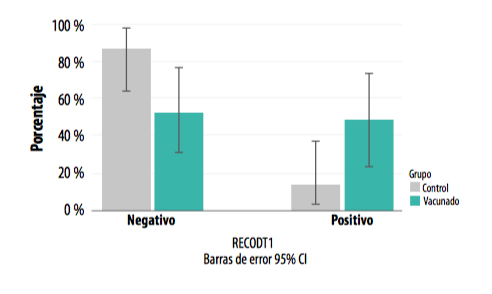
GRÁFICA 2. Presencia de positivos y negativos a L. intracellularis en ambos grupos al mes desde la entrada en cebo (T2).
Tercer muestreo (a los dos meses de entrar, T3)
En esta toma de muestras no se encontraron diferencias significativas en cuanto a la seroconversión entre el grupo vacunado y el grupo control (Gráfica 3).
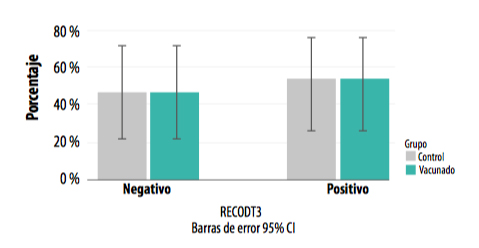
GRÁFICA 3. Presencia de positivos y negativos a L. intracellularis en ambos grupos a los dos meses desde la entrada en cebo (T3).
Cuarto muestreo (a los tres meses de entrar, T4)
Se detectó una diferencia altamente significativa en cuanto al porcentaje de positivos entre ambos grupos (chi cuadrado de Pearson =12,128; p<0,001), siendo la proporción de positivos es mayor en el grupo vacunado.

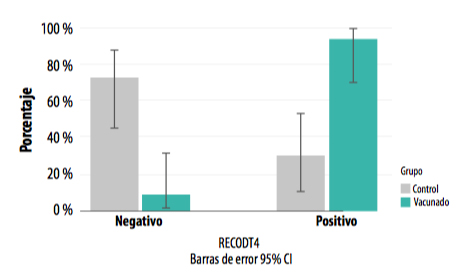
GRÁFICA 4. Presencia de positivos y negativos a L. intracellularis en ambos grupos a los tres meses desde la entrada en cebo (T3).
La dinámica de recirculación de L. intracellularis fue totalmente diferente en el grupo vacunado y en el grupo control (Gráficas 5 y 6), condicionando el estatus sanitario de la población y poniendo de manifiesto una correlación entre la recirculación del patógeno y la reacción inmunitaria e inflamatoria en los animales.
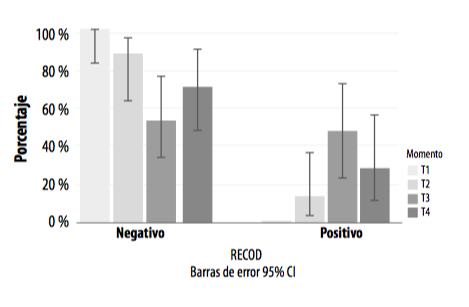
GRÁFICA 5. Presencia de positivos y negativos a L. intracellularis a lo largo de todo el periodo de estudio en el grupo control.
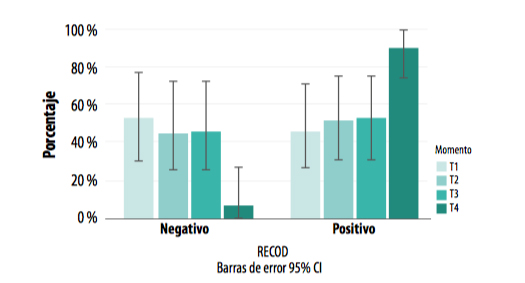
GRÁFICA 6. Presencia de positivos y negativos a L. intracellularis a lo largo de todo el periodo de estudio en el grupo vacunado.
Esta dinámica de seroconversión tuvo una consecuencia reseñable: la transmisión de la enfermedad en el efectivo ocurrió de forma muy lenta, lo que conllevó la coexistencia de animales infectados y animales susceptibles en la misma población.
Desde el punto de vista clínico, no hubo un único momento de infección con L. intracellularis, sino que ocurrió durante un largo periodo de tiempo.

DINÁMICA DE LOS BIOMARCADORES SALIVALES
![]()
Niveles de haptoglobina (HP: ng/mL)
Dado que esta variable no presenta una distribución normal, se aplicó una transformación logarítmica (log10), detectándose una interacción tiempo – grupo altamente significativa (F=18,805; p<0,001) (Gráfica 7).
En el T1 (entrada al cebo) no se encontraron diferencias significativas entre los dos grupos. En cambio, al mes (T2) y dos meses (T3) desde la entrada al cebo se produjo un incremento de la reacción inflamatoria en el grupo control.

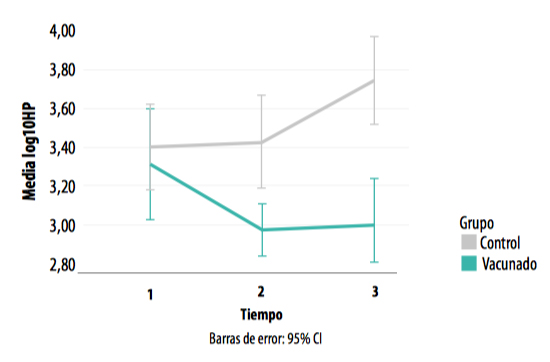
GRÁFICA 7. Concentración de haptoglobina en los muestreos realizados en los grupos control y vacunado.
Niveles de inmunoglobulina G inespecífica (IgG)
El incremento de la IgG estuvo altamente correlacionado con la recirculación de L. intracellularis en la población (Gráfica 8).
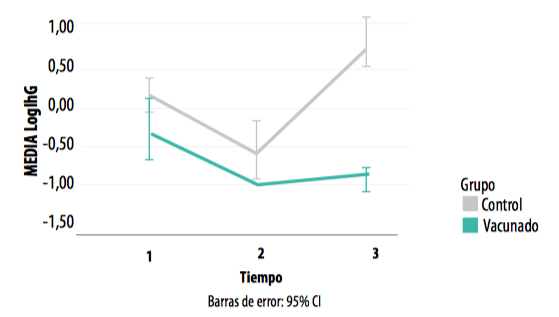
GRÁFICA 8. Concentración de IgG en los muestreos realizados en los grupos control y vacunado.
Niveles de adenosín desaminase (ADA)
Se encontraron diferencias altamente significativas entre los dos grupos, independientemente del momento considerado (F=10,298; p=0,003), siendo las medias del grupo control significativamente superiores, lo que implica que la respuesta inmunitaria celular fue también más alta en el grupo control.
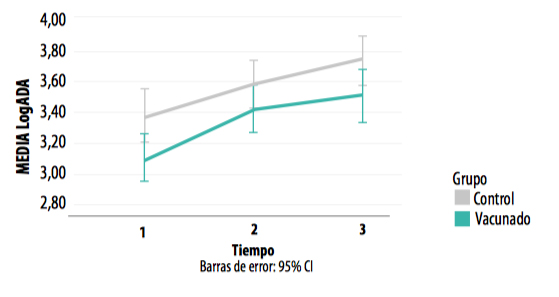
GRÁFICA 9. Concentración de ADA en los muestreos realizados en los grupos control y vacunado.
DINÁMICA DE LA VIREMIA DE PRRS
![]()
Paralelamente a la determinación de la seroconversión frente a L. intracellularis y la medición de los biomarcadores salivales, se realizó un estudio de la dinámica de la viremia de los lechones en el cebo a PRRS mediante PCR cuantitativa para ver su posible influencia en los resultados obtenidos.
La viremia, ya existente a finales de transición, persistió en las dos tomas de muestras iniciales en el grupo control (Gráfica 10). No se observaron diferencias en cuanto a la dinámica de la viremia entre ambos grupos, ya que el grupo vacunado mostró el mismo patrón, siendo los animales virémicos en la segunda toma de muestras, mientras que en los momentos T3 y T4 fueron negativos (Gráfica 11).
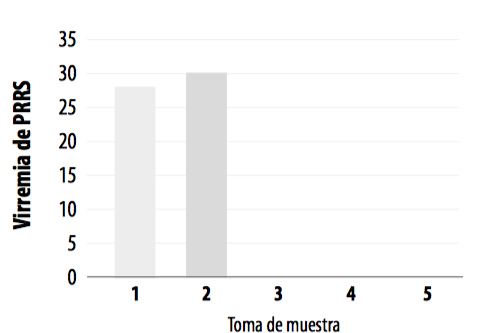
GRÁFICA 10: Viremia de PRRS en el grupo control a lo largo del periodo estudio.
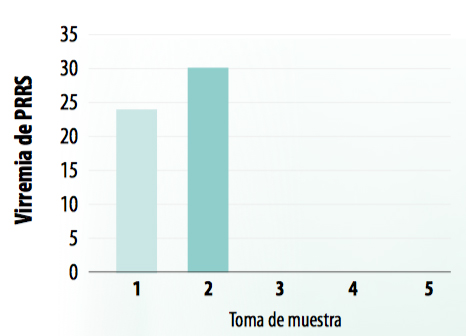
GRÁFICA 11: Viremia de PRRS en el grupo vacunado a lo largo del periodo de estudio.
La ausencia de respuesta en los biomarcadores de inflamación e inmunidad se podría explicar porque los lechones ya eran positivos antes de su entrada en el cebo, lo que impediría una activación detectable en la fase final de la viremia.
DINÁMICA DE SEROCONVERSIÓN
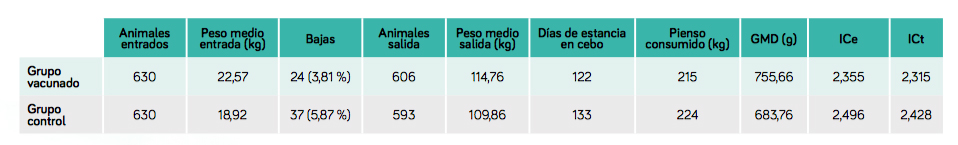
Se consideró la mortalidad como un indicador de las diferentes patologías que habían tenido las poblaciones estudiadas, encontrándose un mayor número de bajas en el grupo control (Tabla 1).
DATOS ZOOTÉCNICOS
![]()
En relación a los datos zootécnicos (Tabla 1), se evaluó la ganancia media diaria (GMD), un parámetro estrechamente vinculado al estado sanitario de los animales, ya que, cuanto mayor sea el crecimiento, mejor será salud.
Asimismo, se valoró el índice de conversión (IC), uno de los indicadores más relevantes en cuanto al coste de producción durante la fase de cebo.
GMD = (Peso final de cebo – Peso inicial de entrada)/días de estancia en cebo
IC económico (ICe) = kg totales de pienso consumido/(kg vendidos – kg entrados)
IC técnico (ICt) = kg totales de pienso consumido/[(kg vendidos + (bajas x 40) – kg entrados
TABLA 1. Datos zootécnicos durante la fase de cebo.
CONCLUSIONES
Se encontraron diferencias importantes en cuanto a las bajas, siendo aproximadamente un 2 % inferiores en el grupo vacunado respecto al grupo control.
El dato más destacado fue el índice de conversión (IC), con una mejora de 141 gramos en el grupo vacunado. Si se considera el IC técnico, la diferencia fue de 113 gramos a favor del mismo grupo.
En términos de eficiencia alimentaria, un cerdo no vacunado necesitó 12,9 kg más de pienso para alcanzar el mismo peso que un cerdo vacunado. Además, la ganancia media diaria (GMD) fue 72 gramos superior en los animales vacunados.
Estos resultados se enmarcan en un contexto en el que la recirculación de L. intracellularis generaba un estado de disbiosis intestinal, acompañado de signos clínicos respiratorios como tos y disnea en un porcentaje elevado de animales.

| El control de la salud digestiva ayuda de una manera significativa a incrementar la salud respiratoria y a la reducción del uso de antibióticos para el control de las recidivas respiratorias que se producen. |
BIBLIOGRAFÍA
1. Enaud R, Prevel R, Ciarlo E, Beaufils F, Wieërs G, Guery B, Delhaes L. The Gut-Lung Axis in Health and Respiratory Diseases: A Place for Inter-Organ and Inter-Kingdom Crosstalks. Front Cell Infect Microbiol. 2020 Feb 19;10:9
2. Dickson RP, Erb-Downward JR, Falkowski NR, Hunter EM, Ashley SL, Huffnagle GB. The Lung Microbiota of Healthy Mice Are Highly Variable, Cluster by Environment, and Reflect Variation in Baseline Lung Innate Immunity. Am J Respir Crit Care Med. 2018 Aug 15;198(4):497-508.
3. Leite FLL, Singer RS, Ward T, Gebhart CJ, Isaacson RE. Vaccination Against Lawsonia intracellularis Decreases Shedding of Salmonella enterica serovar Typhimurium in Co-Infected Pigs and Alters the Gut Microbiome. Sci Rep. 2018 Feb 12;8(1):2857.
4. Borewicz KA, Kim HB, Singer RS, Gebhart CJ, Sreevatsan S, Johnson T, Isaacson RE. Changes in the Porcine Intestinal Microbiome in Response to Infection with Salmonella enterica and Lawsonia intracellularis. PLoS One. 2015 Oct 13;10(10)
5. Savage DC. Microbial ecology of the gastrointestinal tract. Annu Rev Microbiol. 1977;31:107-33.
6. Zheng, L.; Shi, L.; Wu, X.; Hu, P.; Zhang, B.; Han, X.; Wang, K.; Li, X.; Yang, F.; Wang, Y.; et al. Advances in Research on Pig Salivary Analytes: A Window to Reveal Pig Health and Physiological Status. Animals2024, 14, 374.
7. Tecles F, Rubio CP, Contreras-Aguilar MD, et al. Adenosine deaminase activity in pig saliva: analytical validation of two spectrophotometric assays. Journal of Veterinary Diagnostic Investigation. 2018;30(1):175-179.
8. Piirainen V, Gutiérrez AM, Heinonen M, König E, Valros A, Junnikkala S. Salivary and serum haptoglobin, adenosine deaminase, and immunoglobulin G in growing pigs. Porcine Health Manag. 2024 May 21;10(1):21.
9. WenJie Yang a, Abdur Rahman Ansari b, XiaoYu Niu a, WeiHua Zou c, MengQi Lu a, Ling Dong a, Fan Li a, YanHong Chen a, KeLi Yang d, Interaction between gut microbiota dysbiosis and lung infection as gut-lung axis caused by Streptococcus suis in mouse model
10. Intestinal Regeneration: Regulation by the Microenvironment. Author links open overlay panelJoris H. Hageman 1 2, Maria C. Heinz 1 2, Kai Kretzschmar 2 3 4, Jelte van der Vaart 2 3, Hans Clevers 2 3 5, Hugo J.G. Snippert 1 2
11. Lung immune tone via gut-lung axis: gut-derived LPS and short-chain fatty acids’ immunometabolic regulation of lung IL-1, FFAR2, and FFAR3 expressionnd
12. Valentin Sencio, Marina Gomes Machado, François Trottein; The lung–gut axis during viral respiratory infections: the impact of gut dysbiosis on secondary disease outcomes
13. Ma Y, Yang X, Chatterjee V, Wu MH, Yuan SY. The Gut-Lung Axis in Systemic Inflammation. Role of Mesenteric Lymph as a Conduit
14. Changes in saliva biomarkers of stress and immunity in domestic pigs exposed to a psychosocial stressor.
15. Escribano D, Gutiérrez AM, Tecles F, Cerón JJ; Changes in saliva biomarkers of stress and immunity in domestic pigs exposed to a psychosocial stressor.
16. Martinez. A, Toledo. M, Ruiz. E, Garcia. S, Fernández. A, Cerón. JJ, Menjon. R, Tejedor. M, Goyena. E, Muñoz-Prieto. (2 January 2025) A. Changes un analytes related to immunity in the saliva of pigs after vaccination against Lawsonia intracellularis.
