LA NATURALEZA CLARAMENTE MULTIFACTORIAL DE LA CAUDOFAGIA NO PUEDE ABORDARSE CENTRÁNDOSE EN COMPONENTES INDIVIDIALES⁶
Síndrome de Inflamación y Necrosis Porcina
Para leer más contenidos de Revista porciSapiens Abril 2022
Para leer más contenidos de Revista porciSapiens Abril 2022
| El Síndrome de Inflamación y Necrosis Porcina (SINS, del inglés Swine Inflammation and Necrosis Syndrome) se caracteriza por la presencia de signos clínicos de inflamación y necrosis en varios tejidos acrales (partes distales de las extremidades o salientes del cuerpo). Se ha descrito en lechones neonatos y destetados, así como en cerdos en fase de engorde.
Revisamos el estado actual de los conocimientos sobre el SINS, estableciendo una hipótesis sobre los mecanismos de desarrollo del síndrome y los posibles puntos de partida para afrontar esta patología. |
EL PROBLEMA BÁSICO
La inflamación y la pérdida de la integridad de la cola pueden afectar gravemente al bienestar de los cerdos1,2, siendo una causa común de este fenómeno la caudofagia3,4. Existen numerosos factores que pueden actuar como desencadenantes de este comportamiento, entre ellos5:
Los factores genéticos relativos a la agresividad y el umbral de tolerancia a la frustración de los animales también desempeñan un papel.
LA NATURALEZA CLARAMENTE MULTIFACTORIAL DE LA CAUDOFAGIA NO PUEDE ABORDARSE CENTRÁNDOSE EN COMPONENTES INDIVIDIALES⁶
Incluso con la mejora continua y costosa de los factores relacionados con el alojamiento y manejo mencionados, se producen daños en la cola en el 25-70% de los animales, con variaciones a nivel regional. Incluso en las condiciones extensivas al aire libre en Suiza, se han observado prevalencias del 14-20%7.
Sin embargo, el corte de la cola provoca dolor, sufrimiento y daños sin resolver las causas subyacentes8.
A pesar de la creciente demanda de prohibición del corte de colas en la UE (Directiva 2008/120/ CE de la UE), las observaciones de campo y los estudios científicos han demostrado que, en la práctica, la abolición del raboteo en las condiciones actuales puede aumentar seriamente la prevalencia de las lesiones en la cola9.
El principal aspecto a considerar con respecto al origen de las lesiones de la cola sigue siendo la caudofagia, pero cada vez más estudios y la experiencia práctica muestran claramente que la inflamación y la necrosis también pueden ocurrir sin la participación de otros cerdos10-18, pudiendo afectar al 50% de las camadas y hasta el 75% de los lechones11.
Por otro lado, no sólo se ve afectada la cola, sino que también pueden verse afectadas otras partes del cuerpo, especialmente las orejas, los pezones, las pezuñas (rodetes coronarios, superficies plantares y talones), el ombligo, la vulva y la cara (Figura 1)13-18. En la mayoría de los lechones, los síntomas aparecen en varias partes del cuerpo al mismo tiempo.
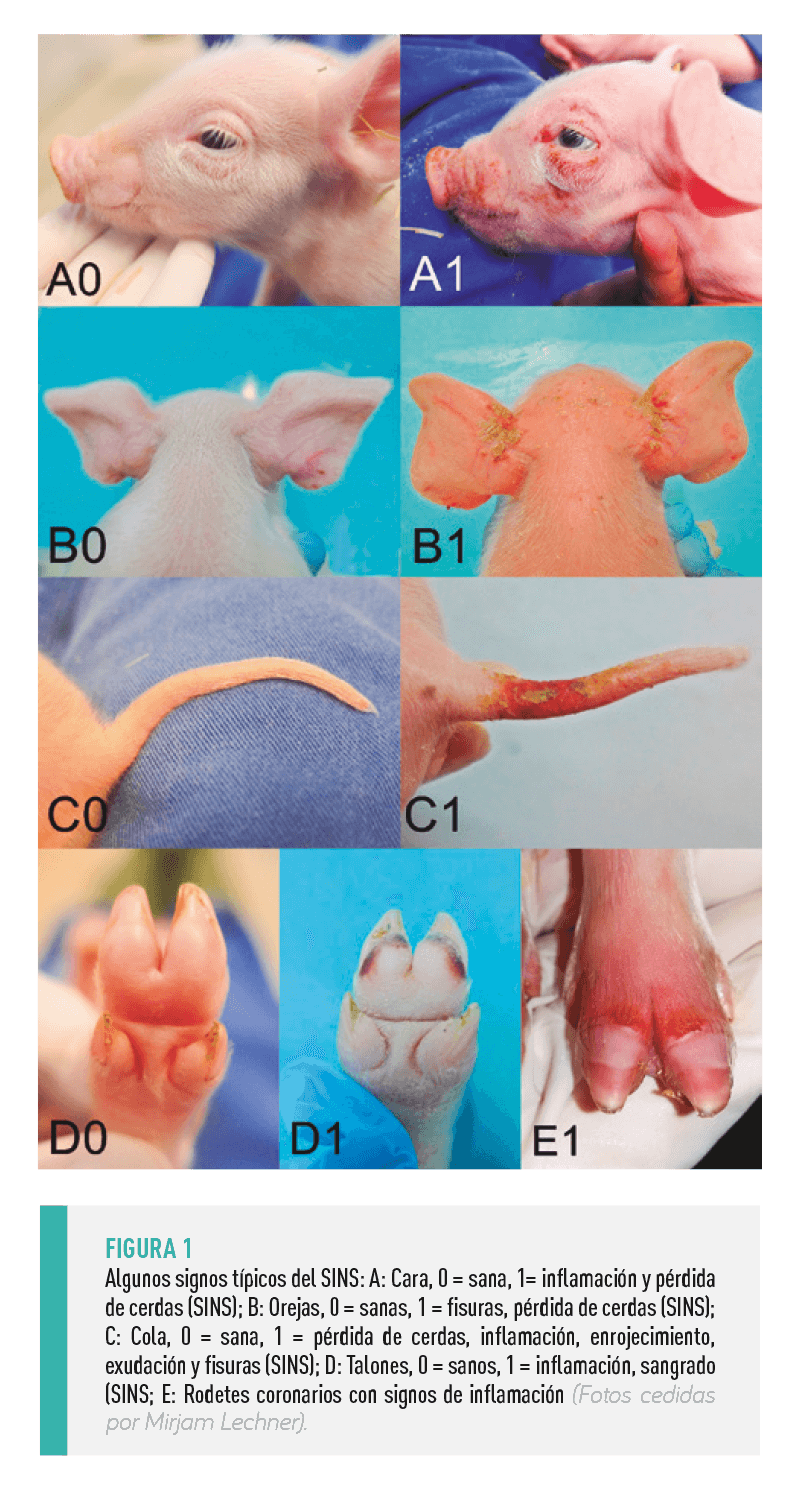
| La aparición simultánea en regiones corporales tan diferentes14,16, la evidencia de que estas lesiones pueden iniciarse antes del nacimiento cuando las mordeduras y los estímulos mecánicos (por ejemplo, desde el suelo) pueden excluirse definitivamente17 y la evidencia histopatológica de una reacción inflamatoria asociada a los vasos en las partes del cuerpo afectadas motivaron la adopción del término “Síndrome de Inflamación y Necrosis Porcina” (SINS)14. |
La importancia de considerar este nuevo síndrome radica en la constatación de que [registrados]las lesiones de la cola no son únicamente consecuencia de la agresividad y el aburrimiento y, por tanto, no pueden controlarse únicamente a través del enriquecimiento ambiental.
Más bien, se observa una asociación compleja de una amplia gama de síntomas inflamatorios y de necrosis acompañado de un metabolismo comprometido de los animales. Se pueden detectar influencias genéticas significativas del verraco y de la cerda en la susceptibilidad de la descendencia en todo el genoma del cerdo que podrían ayudar en la selección en contra del síndrome.
 Esto lleva a sospechar que el SINS es un efecto secundario de décadas de selección genética intensiva y extremadamente exitosa a favor de la carnosidad, el crecimiento y la fertilidad sobre la base de rasgos externos (relación carne:grasa, ganancia diaria y número de lechones), sin tener en cuenta el cambio en la regulación genética que esto inevitablemente conlleva.
Esto lleva a sospechar que el SINS es un efecto secundario de décadas de selección genética intensiva y extremadamente exitosa a favor de la carnosidad, el crecimiento y la fertilidad sobre la base de rasgos externos (relación carne:grasa, ganancia diaria y número de lechones), sin tener en cuenta el cambio en la regulación genética que esto inevitablemente conlleva.
| El objetivo de esta revisión es resumir los conocimientos actuales sobre el SINS, establecer una hipótesis sobre los mecanismos de desarrollo del síndrome y, a partir de ahí, presentar los puntos de partida para abordar la enfermedad. Se puede encontrar una visión detallada en (Reiner, Kuehling, Loewenstein, Lechner & Becker, 2021) 19. |
DEFINIENDO EL SÍNDROME DE INFLAMACIÓN Y NECROSIS PORCINA
El SINS se caracteriza por la presencia de signos clínicos de inflamación y necrosis en varios tejidos acrales. Se ha descrito en lechones neonatos y destetados, así como en cerdos en fase de engorde13-17. Los primeros signos son:
![]() La pérdida de cerdas en la base de la cola y en las orejas.
La pérdida de cerdas en la base de la cola y en las orejas.
![]() El enrojecimiento de los talones.
El enrojecimiento de los talones.
![]() La inflamación de la base de la cola, la cola y los pezones.
La inflamación de la base de la cola, la cola y los pezones.
![]() La inflamación de los rodetes coronarios.
La inflamación de los rodetes coronarios.

Estos signos más leves del SINS pueden pasar desapercibidos, pero tienen un gran potencial de diagnóstico porque se pueden adoptar medidas correctivas antes de que se produzcan daños más graves como la hemorragia, la exudación y la necrosis.
LOS SIGNOS DEL SINS PUEDEN DETECTARSE AL NACIMIENTO16
![]()
En los lechones recién nacidos se han encontrado evidencias histopatológicas de inflamación endógena que tardan, al menos, 4-7 días en desarrollarse. Además, entre el 30% y el 80% de los recién nacidos presentan pérdida de cerdas, así como enrojecimiento e hinchazón en la base de la cola, los pezones, la pared de las pezuñas, los rodetes coronarios y los talones.
![]() Los síntomas aumentan en cuanto a prevalencia y gravedad desde la lactación hasta el destete, momento en el que muchos animales se ven afectados por fenómenos de exudación y necrosis. En la fase de engorde, los síntomas vuelven a disminuir o se ven acentuados por las condiciones ambientales.
Los síntomas aumentan en cuanto a prevalencia y gravedad desde la lactación hasta el destete, momento en el que muchos animales se ven afectados por fenómenos de exudación y necrosis. En la fase de engorde, los síntomas vuelven a disminuir o se ven acentuados por las condiciones ambientales.
Existe una clara conexión con los problemas de producción, por ejemplo, las condiciones desfavorables del suelo, que se vuelven más importantes con la edad de los animales.
Tomando como ejemplo los talones y las pezuñas, cuanto más gravemente afectados estén los tejidos por el SINS, más sensiblemente reaccionarán a las condiciones desfavorables del suelo, y viceversa.
Las orejas se ven especialmente afectadas cuando la termorregulación de los animales no funciona correctamente debido a una falta de capacidad de refrigeración.

En una cohorte de 646 lechones, el 40% estaba afectado en al menos 5 de las 7 partes del cuerpo estudiadas:
Los signos del SINS son relativamente fáciles de diagnosticar clínicamente si se limpian previamente las zonas afectadas de los animales, aunque se necesita algo de experiencia a la hora de puntuar las lesiones.
Las partes del cuerpo se fotografían para permitir la evaluación con una alta repetibilidad de los resultados y un bajo estrés en los lechones16,17. En la Figura 1 se muestran algunos ejemplos de signos de SINS.
EL SINS ES UNA ENFERMEDAD ENDÓGENA
Tres observaciones clave apoyan la hipótesis de que el SINS es principalmente un trastorno endógeno, aunque puede ser modificado por tecnopatías y otros factores de estrés mecánico. Estas observaciones son:
![]() La aparición simultánea en partes del cuerpo tan diversas como la cola, los pezones y las pezuñas14,16,17.
La aparición simultánea en partes del cuerpo tan diversas como la cola, los pezones y las pezuñas14,16,17.
![]() La evidencia de que el SINS puede aparecer antes del nacimiento16.
La evidencia de que el SINS puede aparecer antes del nacimiento16.
![]() La evidencia de que la inflamación originada en los vasos sanguíneos puede estar presente antes del nacimiento en lechones con la epidermis aún intacta, cuando se excluyen los mordiscos y la irritación mecánica (por ejemplo, asociado a un suelo inadecuado)15,16.
La evidencia de que la inflamación originada en los vasos sanguíneos puede estar presente antes del nacimiento en lechones con la epidermis aún intacta, cuando se excluyen los mordiscos y la irritación mecánica (por ejemplo, asociado a un suelo inadecuado)15,16.
| Los signos clínicos de inflamación en la cola, las pezuñas y las orejas se han confirmado histopatológicamente, documentándose fenómenos de vasculitis, trombosis, proliferación de la íntima, edema e hiperemia con la epidermis intacta15. |

![]()
En una granja convencional, entre el 40% y el 80% de los lechones recién nacidos presentaban hemorragias en la pared de las pezuñas, inflamación del rodete coronario, enrojecimiento de los talones, pérdida de cerdas y enrojecimiento de la cola y las orejas16.
![]() La inflamación se caracterizó por la presencia de granulocitos, macrófagos y linfocitos, lo que indica un inicio de la inflamación al menos 4 días antes del nacimiento.
La inflamación se caracterizó por la presencia de granulocitos, macrófagos y linfocitos, lo que indica un inicio de la inflamación al menos 4 días antes del nacimiento.
Penny et al.10 ya sospechaban que la inflamación y la necrosis son el resultado de alteraciones circulatorias desencadenadas por la vasoconstricción y agravadas por otras circunstancias. Esta hipótesis fue confirmada por los hallazgos mencionados de vasculitis, proliferación de la íntima y formación de trombos en la zona de la base de la cola inflamada, signos directamente relacionados con las lesiones clínicas16.
LA ALTERACIÓN CIRCULATORIA RESULTANTE PUEDE CONFIRMARSE CLÍNICAMENTE MEDIANTE TERMOGRAFÍA INFRARROJA13
La inflamación de la punta de la cola (al margen de los eventos de caudofagia) siempre se ve acompañada de cambios en la base de la cola, mientras que los lechones con la base de la cola intacta nunca muestran signos en la punta de la cola15,16.
HIPÓTESIS Y FUNDAMENTOS DE LA PATOGÉNESIS DEL SINS

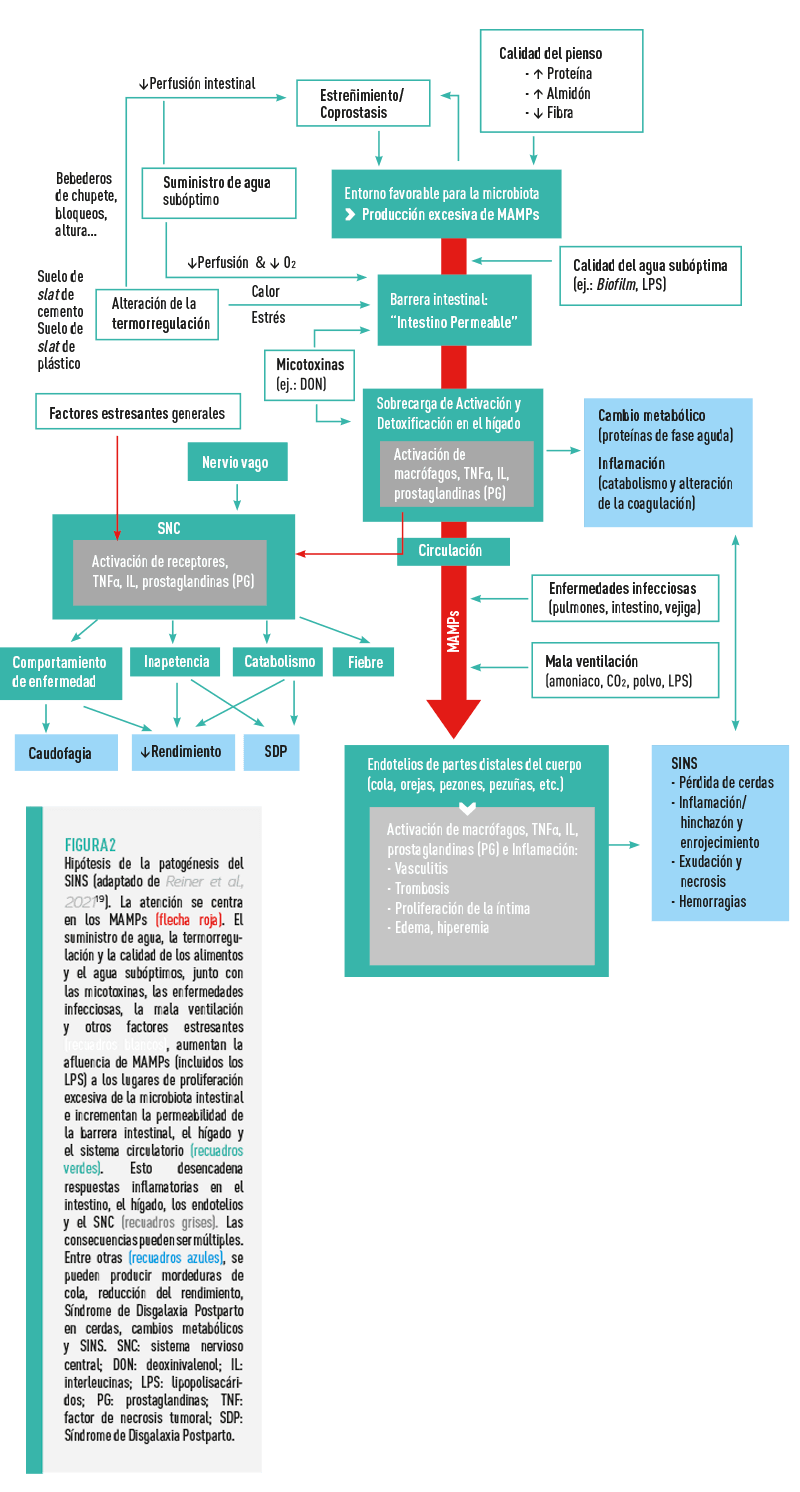
Las endotoxinas (LPS) y otros productos de degradación bacteriana (MAMPs, del inglés Microbiome Associated Molecular Patterns) podrían desempeñar un papel decisivo20-23. Si estos componentes microbianos pasan a la circulación sanguínea, son reconocidos por las propias defensas del organismo y combatidos a través de las vías inflamatorias (resumen en la Figura 219).
![]() Con el fin de atraer gran cantidad de factores defensivos y células inflamatorias hacia el tejido supuestamente infectado por bacterias, los capilares sanguíneos se dilatan y se vuelven permeables. Esto hace que la presión sanguínea descienda, la sangre se detenga y se active la coagulación. De este modo, se reduce o incluso se interrumpe el suministro de sangre a los tejidos irrigados. El resultado final es la destrucción de estos tejidos por necrosis.
Con el fin de atraer gran cantidad de factores defensivos y células inflamatorias hacia el tejido supuestamente infectado por bacterias, los capilares sanguíneos se dilatan y se vuelven permeables. Esto hace que la presión sanguínea descienda, la sangre se detenga y se active la coagulación. De este modo, se reduce o incluso se interrumpe el suministro de sangre a los tejidos irrigados. El resultado final es la destrucción de estos tejidos por necrosis.
![]() Todos estos cambios inflamatorios en los vasos sanguíneos, incluida su obstrucción con trombos, se han demostrado histopatológicamente en los cerdos afectados por el SINS16.
Todos estos cambios inflamatorios en los vasos sanguíneos, incluida su obstrucción con trombos, se han demostrado histopatológicamente en los cerdos afectados por el SINS16.
¿DE DÓNDE PROCEDEN LOS PRODUCTOS DE DEGRADACIÓN BACTERIANA?

La disbiosis de la microbiota y el deterioro de la barrera intestinal también se asocian a una serie de inflamaciones crónicas y enfermedades sistémicas en humanos, y la implicación patogénica de las endotoxinas está bien descrita31,32.
AGUA, ALIMENTO & TERMORREGULACIÓN
![]()
La producción excesiva de MAMPs se puede ver exacerbada por un suministro de agua subóptimo o por la incapacidad para la termorregulación.
![]() Ambos procesos conducen a una relativa falta de agua, lo que se intenta compensar con una reducción del flujo sanguíneo intestinal, conduciendo a un espesamiento del quimo (coprostasis) y una multiplicación descontrolada de las bacterias.
Ambos procesos conducen a una relativa falta de agua, lo que se intenta compensar con una reducción del flujo sanguíneo intestinal, conduciendo a un espesamiento del quimo (coprostasis) y una multiplicación descontrolada de las bacterias.
![]() La alimentación con demasiada proteína y almidón, y con muy poca fibra bruta, también favorece la proliferación bacteriana excesiva y la producción de MAMPs, ya que el entorno intestinal y la microbiota cambian.
La alimentación con demasiada proteína y almidón, y con muy poca fibra bruta, también favorece la proliferación bacteriana excesiva y la producción de MAMPs, ya que el entorno intestinal y la microbiota cambian.
La acumulación de calor en condiciones de una termorregulación alterada y la reducción del flujo sanguíneo intestinal conducen simultáneamente a una sobrecarga de la barrera hematointestinal dando lugar a lo que se conoce como “intestino permeable”, permitiendo el paso de demasiados MAMPs.
EN LOS CERDOS, LOS DAÑOS EN LA BARRERA INTESTINAL CONDUCEN DIRECTAMENTE A UNA MAYOR TRANSLOCACIÓN DE LPS25
ESTRÉS POR CALOR
![]()
La barrera hematointestinal de los cerdos es especialmente susceptible al estrés por calor26-28, observándose una reducción de la perfusión intestinal con una relativa deficiencia de agua y un aumento de las necesidades de agua para la termorregulación27,28, especialmente en condiciones en las que falla la refrigeración en naves con suelos secos de hormigón o plástico.
MICOTOXINAS
![]()
Las micotoxinas (DON y sustancias similares) alteran la barrera intestinal de los cerdos, aumentan la absorción de LPS y provocan inflamación intestinal y hepática29-30.
En este sentido, las micotoxinas y los LPS pueden actuar sinérgicamente, favoreciendo su absorción mutua.
INFLAMACIÓN HEPÁTICA
![]()
El hígado actúa como barrera fundamental para el organismo, degradando los MAMPs (LPS y otros) y evitando que entren en la circulación sistémica donde en cantidades elevadas provocarían la muerte por shock.
![]() Sin embargo, cuando se produce una proliferación microbiana excesiva en el intestino o cuando hay una alteración de la barrera intestinal (“leaky gut”), el hígado tiene que procesar altas concentraciones de MAMPs que no puede eliminar por completo, lo que provoca inflamación hepática y deterioro de su función orgánica33.
Sin embargo, cuando se produce una proliferación microbiana excesiva en el intestino o cuando hay una alteración de la barrera intestinal (“leaky gut”), el hígado tiene que procesar altas concentraciones de MAMPs que no puede eliminar por completo, lo que provoca inflamación hepática y deterioro de su función orgánica33.
EN CONSECUENCIA, EL HÍGADO PASA DE UN METABOLISMO ANABÓLICO A UN METABOLISMO INFLAMATORIO Y DE FASE AGUDA
| Las primeras evidencias que apuntaban a la inducción de procesos inflamatorios en el hígado de lechones con SINS y a los cambios en el metabolismo fueron aportadas por Ringseis et al.18 y Löwenstein et al.34.
Un resumen detallado de cómo la inflamación ocurre como consecuencia de problemas asociados a las bacterias intestinales, a la barrera intestinal, al entorno de alojamiento y a la higiene, a la activación inmunitaria, a las micotoxinas, al estrés psicológico, al estado nutricional y a la composición de los piensos puede encontrarse en Nordgreen et al.35. |
ALTERACIÓN DEL COMPORTAMIENTO
![]()
Los procesos inflamatorios locales no permanecen ocultos al sistema nervioso central. Éste reacciona cambiando a un metabolismo catabólico, observándose una falta de apetito y un comportamiento de enfermedad con el objetivo de ahorrar energía para la defensa del organismo y privar de nutrientes a las bacterias intestinales.
SE HA DEMOSTRADO QUE EL COMPORTAMIENTO DE ENFERMEDAD, DESENCADENADO POR MAMPs COMO EL LPS, LLEVA A LA CAUDOFAGIA35
INFLUENCIA DE LA GENÉTICA
IMPACTO DEL VERRACO
![]()
Durante años, los ganaderos han observado una asociación entre la presencia de SINS en sus lechones y determinados verracos.
Para esclarecer científicamente las posibles correlaciones, se han estudiado verracos cuya descendencia resultaba ser más susceptible al SINS y verracos cuya descendencia resultaba ser especialmente resistente, inseminando a cerdas individuales con semen mixto de ambos perfiles de verracos. De este modo, los lechones nacían en la misma camada, eliminándose en gran medida los efectos ambientales no sistemáticos.
Hasta ahora se han examinado un total de 4 verracos Duroc y 15 verracos Pietrain de 8 empresas de genética17 y obteniéndose aproximadamente 650 lechones a partir de 39 cerdas de genética homogénea. Los resultados fueron sorprendentes:
![]() La descendencia de los verracos Duroc apenas mostraba síntomas de SINS (proporciones acumuladas de inflamación y necrosis: 43%) y estaba significativamente menos afectada que la descendencia de los verracos Pietrain (proporciones acumuladas de inflamación y necrosis: 165%).
La descendencia de los verracos Duroc apenas mostraba síntomas de SINS (proporciones acumuladas de inflamación y necrosis: 43%) y estaba significativamente menos afectada que la descendencia de los verracos Pietrain (proporciones acumuladas de inflamación y necrosis: 165%).
![]() Dentro de la raza Pietrain, pudieron identificarse verracos con una progenie especialmente susceptible (proporciones acumuladas de inflamación y necrosis: 200%) y verracos cuya progenie presentaba grados de SINS similares (proporciones acumuladas de inflamación y necrosis: 62%) a los de la progenie Duroc.
Dentro de la raza Pietrain, pudieron identificarse verracos con una progenie especialmente susceptible (proporciones acumuladas de inflamación y necrosis: 200%) y verracos cuya progenie presentaba grados de SINS similares (proporciones acumuladas de inflamación y necrosis: 62%) a los de la progenie Duroc.
| La asignación de los verracos no fue aleatoria sino altamente repetible. Los grados más altos de SINS con exudación y necrosis sólo se observaron en la descendencia de los verracos Pietrain de calidad media (4,4%) y baja (20,1%), pero no en la descendencia de los verracos Duroc ni en los descendientes de los mejores verracos Pietrain. |
ESTOS RESULTADOS CONFIRMAN LA EXISTENCIA DE EFECTOS GENÉTICOS SIGNIFICATIVOS SOBRE LA PROBABILIDAD DE APARICIÓN DE SINS EN UNA GANADERÍA DETERMINADA
Los resultados muestran claramente que había verracos con una distribución favorable y desfavorable para el desarrollo del SINS en la descendencia en las distintas explotaciones analizadas. Se puede suponer que la expresión del SINS está significativamente influenciada por el manejo y la alimentación y que las diferencias absolutas entre los verracos son más débiles o más fuertes en condiciones más o menos favorables.
Por supuesto, no se pueden esperar diferencias genéticas entre todos los verracos, cerdas o líneas genéticas. Sin embargo, los resultados concluyentes del estudio fueron la clara diferenciación entre los verracos Duroc y Pietrain y la pronunciada variación dentro de los verracos Pietrain incluidos en el estudio. Estos resultados están siendo tomados en serio por numerosas empresas de genética en varios países.
| La conclusión de estos estudios es que los verracos pueden seleccionarse de forma fiable basándose en los resultados de desarrollo del SINS en su progenie. |
IMPACTO DE LA CERDA
![]()
La genética de la cerda también puede desempeñar un papel importante en el desarrollo del SINS de su progenie.
En un ensayo con más de 20.000 cerdos de diferentes edades, se demostró que una de las cuatro líneas de cerdas utilizadas estaba dos veces más predispuesta a desarrollar SINS que las otras tres14.
![]() Esto era cierto, tanto para las alteraciones en la cola como en las orejas (las demás partes del cuerpo no se puntuaron debido al elevado número de animales).
Esto era cierto, tanto para las alteraciones en la cola como en las orejas (las demás partes del cuerpo no se puntuaron debido al elevado número de animales).
![]() Al mismo tiempo, en la descendencia de esta línea de cerdas se observó una incidencia significativamente más baja de caudofagia que en las otras tres líneas.
Al mismo tiempo, en la descendencia de esta línea de cerdas se observó una incidencia significativamente más baja de caudofagia que en las otras tres líneas.
| Estas evidencias son un claro indicio de la naturaleza sindrómica del SINS y de que la caudofagia y el SINS son fundamentalmente dos problemas diferentes, aunque puedan aparecer simultáneamente. |
OPORTUNIDADES PARA MEJORAR EL SINS A TRAVÉS DE LAS CONDICIONES AMBIENTALES
En general, se considera que mejorar el suministro de agua y fibra bruta tiene un impacto positivo en la salud intestinal y en la mejora del bienestar de los cerdos3. Por ello, en un estudio a gran escala15, se evaluó:
 Si el SINS puede mejorarse dando un buen aporte de fibra bruta y ofreciendo agua higienizada (=mejoras zootécnicas). Si el SINS puede mejorarse dando un buen aporte de fibra bruta y ofreciendo agua higienizada (=mejoras zootécnicas). |
Las mejoras zootécnicas se llevaron a cabo en todas las etapas, desde las cerdas reproductoras hasta los cerdos de engorde. La prevalencia del SINS mejoró significativamente en todas las edades. En los lechones lactantes, lechones destetados y cerdos de engorde, la mejora de las condiciones de manejo se tradujo en una reducción del SINS en un 40%, 60% y 80%, respectivamente. |
  Si la proporción de lechones con SINS puede reducirse en cerdas sin lesiones en la piel, pezones y pezuñas en comparación con otras cerdas (=calidad de la cerda). Si la proporción de lechones con SINS puede reducirse en cerdas sin lesiones en la piel, pezones y pezuñas en comparación con otras cerdas (=calidad de la cerda). |
La calidad de la cerda también resultó tener un efecto significativo en la incidencia del SINS desde los lechones hasta el engorde. El efecto más llamativo estuvo relacionado con la coprostasis de la cerda que se produjo exclusivamente en condiciones de alojamiento estándar, sin mejorar el suministro de agua y fibra, y con mayor frecuencia en cerdas con peor calidad de piel, pezuñas y pezones. |
ES EVIDENTE QUE EL SUMINISTRO DE FIBRA, AGUA HIGIENIZADA PROCEDENTE DE BEBEDEROS ADECUADOS Y CERDAS CON PEZUÑAS Y PEZONES SANOS, Y PIEL INTACTA ES FUNDAMENTAL PARA COMBATIR EL SINS15
CONCLUSIONES
Para controlar las lesiones de la cola y mejorar el bienestar de los animales, fijarse sólo en el comportamiento de caudofagia es insuficiente. Ahora sabemos que las lesiones de la cola ocurren en un grado considerable, incluso sin la intervención de otros cerdos.
![]() Además, la inflamación y la necrosis observadas afectan hasta el 75% de los lechones, encontrándose en numerosas partes del cuerpo y pudiendo estar ya presentes antes del nacimiento cuando aún no es posible la lesión mecánica, por lo que se atribuyen a causas endógenas asociadas a los vasos sanguíneos.
Además, la inflamación y la necrosis observadas afectan hasta el 75% de los lechones, encontrándose en numerosas partes del cuerpo y pudiendo estar ya presentes antes del nacimiento cuando aún no es posible la lesión mecánica, por lo que se atribuyen a causas endógenas asociadas a los vasos sanguíneos.
La inflamación y la necrosis están documentadas histopatológicamente, denominándose con el término “Síndrome de Inflamación y Necrosis Porcina” (SINS).
EL SINS ES UNA PATOLOGÍA MULTIFACTORIAL QUE AFECTA A LOS CERDOS
Numerosos factores están relacionados con el desarrollo del SINS, como las instalaciones, la alimentación y el manejo, una termorregulación y un suministro de agua inadecuados, una alimentación con exceso de proteína y almidón y escaso aporte de fibra bruta y la contaminación por micotoxinas, entre otros. Son como 40 cajas apiladas unas encima de otras. ¡Retirar una sola es inútil, la pila seguirá cayendo!
| El control del SINS, al igual que ocurre con la caudofagia, debe tener en cuenta muchos factores al mismo tiempo.
|
BIBLIOGRAFÍA
1. EFSA Panel on Animal Health and Welfare (AHAW). Statement on the use of animal‐based measures to assess the welfare of animals. EFSA J. 2012, 10, 2767.
2. EFSA Panel on Animal Health and Welfare (AHAW). Scientific Opinion concerning a multifactorial approach on the use of animal and non‐animal‐based measures to assess the welfare of pigs. EFSA J. 2014, 12, 3702.
3.Nannoni, E.; Sardi, L.; Vitali, M.; Trevisi, E.; Ferrari, A.; Barone, F.; Bacci, M.L.; Barbieri, S.; Martelli, G. Effects of different enrichment devices on some welfare indicators of post‐weaned undocked piglets. Appl. Anim. Behav. Sci. 2016, 184, 25–34.
4. Thodberg, K.; Herskin, M.S.; Jensen, T.; Jensen, K.H. The effect of docking length on the risk of tail biting, tail directed behaviour, aggression and activity level of growing pigs kept under commercial conditions. Animal 2018, 12, 2609–2618.
5. Kallio, P.A.; Janczak, A.M.; Valros, A.E.; Edwards, S.A.; Heinonen, M. Case control study on environmental, nutritional and management‐based risk factors for tailbiting in long‐tailed pigs. Anim. Welf. 2018, 27, 21–34, doi:10.7120/09627286.27.1.021.
6. Breuer, K.; Sutcliffe, M.E.M.; Mercer, J.T.; Rance, K.A.; Beattie, V.E.; Sneddon, I.A.; Edwards, S.A. The effect of breed on the development of adverse social behaviours in pigs. Appl. Anim. Behav. Sci. 2003, 84, 59–74, doi:10.1016/S0168‐1591(03)00147‐3.
7. Walker, P.; Bilkei, G. Tail‐biting in outdoor pig production. Vet. J. 2006, 171, 367–369.
8. EFSA. Scientific opinion of the Panel on Animal Health and Welfare on a request from Commission on the risks associated with tail biting in pigs and possible means to reduce the need for tail docking considering the different housing and husbandry systems. EFSA J. 2007, 161, 1–13.
9. Valros, A.; Ahlstrom, S.; Rintala, H.; Hakkinen, T.; Saloniemi, H. The prevalence of tail damage in slaughter pigs in Finland and associations to carcass condemnations. Acta Agric. Scand. Sect. A Anim. Sci. 2004, 54, 213–219, doi:10.1080/09064700510009234.
10. Penny, R.H.C.; Edwards, M.J.; Mulley, R. Clinical observations of necrosis of skin of suckling piglets. Aust. Vet. J. 1971, 47, 529–537.
11. Blowey, R.; Done, S.H. Tail necrosis in pigs. Pig, J. 2003, 51, 155–163.
12. Santi, M.; Gheller, N.B.; Mores, T.J.; Marques, B.M.; Gonçalves, M.A.; Gava, D.; Zlotowski, P.; Driemeier, D.; Barcellos, D.E. Tail Necrosis in Piglets—Case Report. Available online: http://hdl.handle.net/11299/155093 (accessed on 15 November 2018).
13. Reiner, G.; Lechner, M. Inflammation and necrosis syndrome (SINS) in swine. CAB Rev. 2019, 14, 1 8.
14. Reiner, G.; Lechner, M.; Eisenack, A.; Kallenbach, K.; Rau, K.; Müller, S.; Fink‐Gremmels, J. Prevalence of an inflammation and necrosis syndrome in suckling piglets. Animal 2019, 13, 2007–2017.
15. Reiner, G.; Kuehling, J.; Lechner, M.; Schrade, H.J.; Saltzmann, J.; Muelling, C.; Daenicke, S.; Loewenstein, F. Inflammation and Necrosis Syndrome is influenced by husbandry and quality of sow in suckling piglets, weaners and fattening pigs. Porc. Health Manag. 2020, 6, 32.
16. Kuehling, J.; Loewenstein, F.; Wenisch, S.; Kressin, M.; Herden, C.; Lechner, M.; Reiner, G. An in depth diagnostic exploration of an inflammation and necrosis syndrome in a population of newborn piglets. Animal 2021, 15, 100078.
17. Kuehling, J.; Eisenhofer, K.; Lechner, M.; Becker, S.; Willems, H.; Reiner, G. The effects of boar on susceptibility to swine inflammation and necrosis syndrome in piglets. Porc. Health Manag. 2021, 7, 15.
18. Ringseis, R.; Gessner, D.; Löwenstein, F.; Kuehling, J.; Becker, S.; Willems, H.; Lechner, M.; Eder, K.; Reiner, G. Swine inflammation and necrosis syndrome is associated with plasma metabolites and liver transcriptome in affected piglets. Animals 2021, 11, 772, doi:10.3390/ani11030772.
19. Reiner, G.; Kuehling, J.; Loewenstein, F.; Lechner, M.; Becker, S. Swine Inflammation and Necrosis Syndrome (SINS). Animals 2021, 11, 1670.
20. Schrauwen, E.; Thoonen, H.; Hoorens, J.; Houvenaghel, A. Pathophysiological effects of endotoxin infusion in young piglets. Br. Vet. J. 1986, 142, 364–370.
21. Jadamus, A.; Schneider, D. Long‐term effect of fusariotoxins on the reproduction performance of sows testing the effectiveness of detoxifying feed additives 700. Feed Mag. 2002, 10, 396–405.
22. Busch, M.E.; Jensen, I.M.; Korsgaard, J. Development and consequences of ear necrosis in a weaner herd and two growingfinishing herds. I Proceedings of the 21st International Pig Veterinary Society Congress, Vancouver, BC, Canada, 18–21 July 2010; p. 45.
23. Guillou, D.; Demey, V.; Chacheyras‐Durand, F.; Le Treut, Y. Mise en evidence du transfer des endotoxines de la truie vers sa portée dans le context du syndrome de dysgalactie post‐partum. J. Rech. Porc. 2013, 45, 269–270.
24. Van Limbergen, T.; Devreese, M.; Croubels, S.; Broekaert, N.; Michiels, A.; DeSaeger, S.; Maes, D. Role of mycotoxins in herds with and without problems with tail necrosis in neonatal pigs. Vet. Rec. 2017, 181, 539.
25. Sanz Fernandez, M.V.; Stoakes, S.K.; Abuajamieh, M.; Seibert, J.T.; Johnson, J.S.; Horst, E.A.; Rhoads, R.P.; Baumgard, L.H. Heat stress increases insulin sensitivity in pigs. Physiol. Reprod. 2015, 3, e1247.
26. Pearce, S.C.; Mani, V.; Boddicker, R.L.; Johnson, J.S.; Weber, T.E.; Ross, J.W.; Baumgard, L.H.; Gabler, N.K. Heat stress reduces barrier function and alters intestinal metabolism in growing pigs. J. Anim. Sci. 2012, 90, 257–259.
27. Pearce, C.S.; Mani, V.; Boddicker, R.L.; Johnson, J.S.; Weber, T.E.; Ross, J.W.; Rhoads, R.P.; Baumgard, L.H.; Gabler, N.K. Heat stress reduces intestinal barrier integrity and favors intestinal glucose transport in growing pigs. PLoS ONE 2013, 8, e70215.
28. Pearce, S.C.; Sanz‐Fernandez, M.V.; Hollis, J.H.; Baumgard, L.H.; Gabler, N.K. Short‐term exposure to heat stress attenuates appetite and intestinal integrity in growing pigs. J. Anim. Sci. 2014, 92, 5444–5454.
29. Alizadeh, A.; Braber, S.; Akbari, P.; Kraneveld, A.; Garssen, J.; Fink‐Gremmels, J. Deoxynivalenol and its modified forms: Are there major differences? Toxins 2016, 8, 334.
30. 54. Pierron, A.; Alassane‐Kpembi, I.; Oswald, I.P. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health. Porc. Health Manag. 2016, 2, 21.
31. Brandl, K.; Schnabl, B. Is intestinal inflammation linking dysbiosis to gut barrier dysfunction during liver disease? Expert Rev. Gastroenterol. Hepatol. 2015, 9, 1069–1076.
32. Carotti, S.; Guarino, M.P.L.; Vespasiani‐ Gentilucci, U.; Morini, S. Starring role of toll‐like receptor‐4 activation in the gut‐liver axis. World, J. Gastrointest. Pathophysiol. 2015, 6, 99–109.
33. Medzhitov, R. Toll‐like receptors and innate immunity. Nat. Rev. Immunol. 2001, 1, 135–145.
34. Loewenstein, F.; Becker, S.; Kuehling, J.; Schrade, H.; Lechner, M.; Ringseis, R.; Eder, K.; Moritz, A.; Reiner, G. Inflammation and necrosis syndrome is associated with alterations in blood and metabolism in pigs. BMC Vet Res 18, 50 (2022). https://doi.org/10.1186/s12917-021-03107-1
35. Nordgreen, J.; Edwards, S.A.; Boyle, L.A.; Bolhuis, J.E.; Veit, C.; Sayyari, A.; Marin, D.E.; Dimitrov, I.; Janczak, A.M.; Valros, A. A proposed role for proinflammatory cytokines in damaging behavior in pigs. Front. Vet. Sci. 2020, 7, 646.
[/registrados]
