Transferencia de micotoxinas desde el pienso de lactación al calostro de las cerdas
Para leer más contenidos de porciSapiens Octubre 2022
Para leer más contenidos de porciSapiens Octubre 2022
| Los niveles de riesgo de las micotoxinas varían según el tipo de micotoxina, la especie animal, la edad y el tipo de producción. En los animales lactantes, las micotoxinas pueden transferirse desde el alimento consumido al calostro y a la leche. Esto está bien documentado en el caso de la aflatoxicosis en el ganado vacuno, pero no en las cerdas ni en las micotoxinas más frecuentes.
Los estudios relativos a la transferencia de micotoxinas de la alimentación de las cerdas al calostro son escasos. Por ello, en este estudio se recogieron muestras de pienso de lactación y calostro de cerdas de 19 granjas para analizar los niveles de aflatoxinas, fumonisinas, deoxinivalenol y zearalenona. |
EL PROBLEMA DE LAS MICOTOXINAS

El problema de las micotoxinas en la ganadería es actualmente muy relevante, ya que ocasiona importantes pérdidas económicas relacionadas con el empeoramiento de los resultados productivos de los animales como consecuencia de una situación de enfermedad aguda, subaguda o crónica2.
Numerosos estudios han caracterizado las principales micotoxinas y sus metabolitos, demostrando sus efectos negativos sobre la salud animal y humana3. Los grupos más relevantes de micotoxinas que se encuentran en la alimentación animal son producidos por tres géneros de hongos3:
| En los cerdos, la micotoxicosis asociada a la ingestión de AFs, tricotecenos, FUMs y ZEN es difusa, pudiendo afectar negativamente a varios órganos, incluyendo el tracto digestivo4, los sistemas inmunitario5, reproductor6 y respiratorio7, los riñones8 y el hígado9. |
La absorción de las micotoxinas presentes en la dieta es, por lo general, un proceso rápido12,13 que da lugar a una presencia difusa en la circulación sanguínea.
EN EL CASO DEL PORCINO, LAS PRUEBAS SON ESCASAS EN CUANTO AL RIESGO QUE SUPONEN LAS SECRECIONES DE LAS GLÁNDULAS MAMARIAS RESPECTO A LA TRANSFERENCIA DE MICOTOXINAS A LOS LECHONES
En el caso de los rumiantes, numerosos estudios han demostrado claramente la transferencia de micotoxinas desde los piensos a la leche de vaca, especialmente en el caso de las aflatoxinas y sus metabolitos14,15, ya que esta leche se destina al consumo humano. Por ello, La Comisión Europea estableció un límite de 0,050 g de metabolito de AFM1/kg de leche para regular el consumo humano o la fabricación de productos lácteos16.
Se ha comprobado que se produce una transferencia de aflatoxinas a la leche de cerda, tal y como indica la recuperación de AFB1 o sus metabolitos AFM1 y AFM217,18. Sin embargo, es mucho menor que la detectada en las vacas.
 No obstante, en un estudio realizado en Serbia19 se encontraron varias muestras de leche de cerda con valores dos o tres veces superiores al límite fijado por la Unión Europea (UE) para la leche de vaca destinada al consumo humano16.
No obstante, en un estudio realizado en Serbia19 se encontraron varias muestras de leche de cerda con valores dos o tres veces superiores al límite fijado por la Unión Europea (UE) para la leche de vaca destinada al consumo humano16.
TRANSFERENCIA DE MICOTOXINAS AL CALOSTRO
| Dada la escasez de datos sobre la asociación entre el pienso de las cerdas y la leche, el objetivo de este estudio fue determinar si la ingesta de micotoxinas antes del parto conlleva su transferencia al calostro como fuente potencial de riesgo para los recién nacidos. [registrados] |
MATERIALES Y MÉTODOS
MUESTRAS DE PIENSO Y CALOSTRO
![]()
| PIENSO Se obtuvieron muestras de la mezcla de piensos para cerdas lactantes de 19 explotaciones situadas en las regiones de Emilia-Romaña, Lombardía y Véneto. Las explotaciones seleccionadas cumplían las siguientes características: |
| CALOSTRO Un día después del parto, se obtuvo el calostro de 2 o 3 cerdas multíparas de cada granja (un total de 49 muestras individuales de calostro), tomando al menos 10 ml de cada cerda en tubos de ensayo que se congelaron inmediatamente y se conservaron a 20˚C.  Las cerdas no fueron tratadas con oxitocina antes de la toma de muestras y no fue necesario separar a los lechones recién nacidos de las cerdas ya que, dentro del primer día postparto, el calostro también se obtiene fácilmente en presencia de crías. Las cerdas no fueron tratadas con oxitocina antes de la toma de muestras y no fue necesario separar a los lechones recién nacidos de las cerdas ya que, dentro del primer día postparto, el calostro también se obtiene fácilmente en presencia de crías. |
Una vez obtenidas las muestras, se evaluó el contenido de micotoxinas (AFB1, AFB2, AFG1, AFG2, FUMs, DON y ZEN) en las 19 muestras de pienso recogidas. En función de los niveles de cada micotoxina encontrados en los piensos de cada explotación, se seleccionaron para los análisis los calostros recogidos en 13 de las 19 explotaciones, con un total de 35 muestras.
 En concreto, 13, 12 y 14 de estas muestras se analizaron para AFs, FUMs y DON, respectivamente. No se analizó ninguna muestra de calostro para ZEN debido a la ausencia de piensos positivos para esta micotoxina.
En concreto, 13, 12 y 14 de estas muestras se analizaron para AFs, FUMs y DON, respectivamente. No se analizó ninguna muestra de calostro para ZEN debido a la ausencia de piensos positivos para esta micotoxina.
DETECCIÓN DE MICOTOXINAS
![]()
El contenido de AFB1, AFB2, AFG1, AFG2, FUMs, DON y ZEN en los piensos se evaluó mediante kit comercial ELISA, validándose los valores más altos y algunos valores bajos de un total de 11 resultados mediante cromatografía líquida-espectrometría de masas (LC-MS), mientras que los valores de las muestras de calostro se obtuvieron mediante LC-MS.
Para las muestras de piensos se calcularon las frecuencias de valores de micotoxinas por encima del umbral de cuantificación (LOQ: 0,0010 mg/kg; 0,125 mg/kg; 0,15 mg/kg; 0,025 mg/kg para AF, DON, FUMs y ZEN, respectivamente) y por encima del nivel máximo permitido en la UE para AF10 o los valores máximos orientativos recomendados por la UE para las otras tres micotoxinas11.
RESULTADOS
MICOTOXINAS DETECTADAS EN PIENSO
![]()
La Tabla 1 muestra el contenido de micotoxinas en las muestras de piensos para las cerdas lactantes.
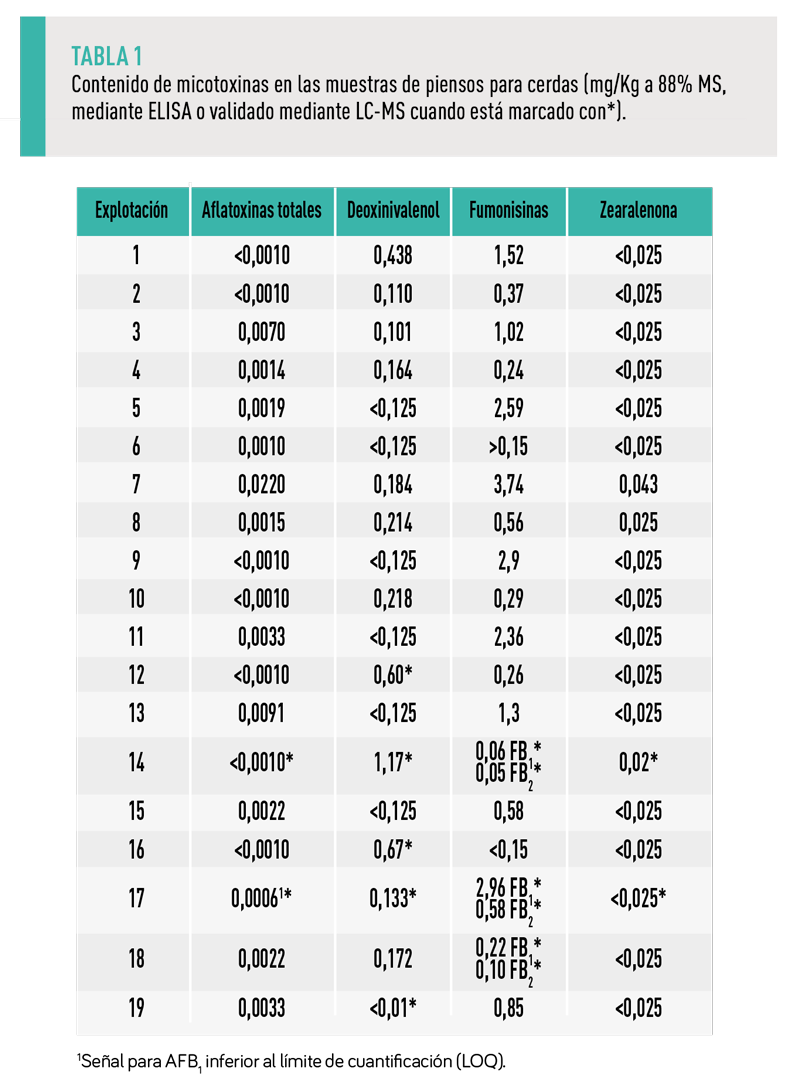
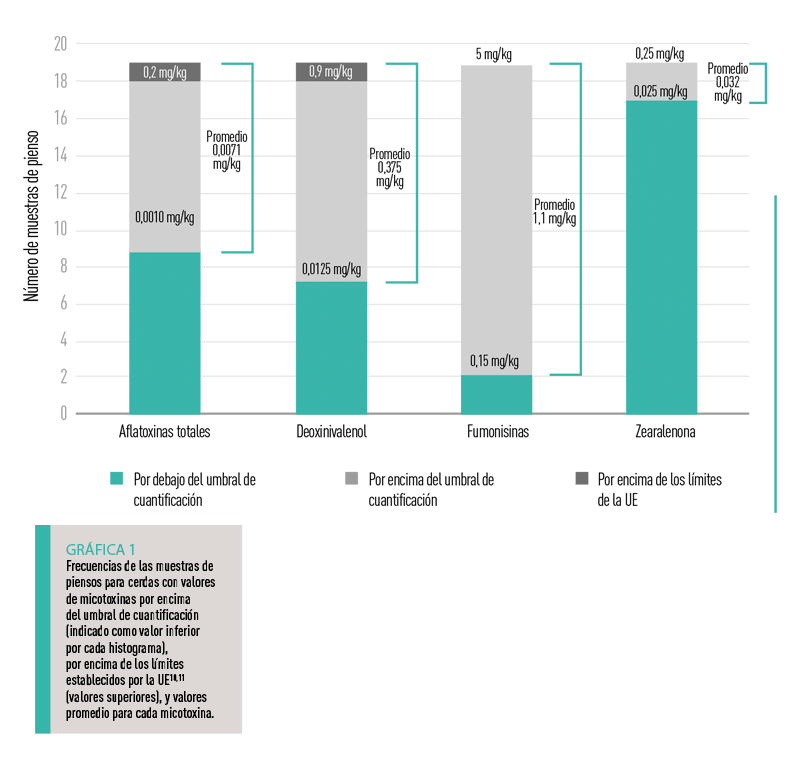
De las 19 muestras analizadas, los niveles de las micotoxinas detectadas fueron en general bajos (número de muestras positivas 10, 12, 17 y 2 para AFs, FUMs, DON y ZEN, respectivamente), y estaban siempre dentro de los límites de las directivas de la UE o de las recomendaciones de la UE, excepto en dos muestras (una para AFs y otra para DON) (Gráfica 1).
 No obstante, la presencia de dos explotaciones, cada una de ellas con un valor de micotoxinas superior al límite, puso de manifiesto la necesidad de realizar controles en los piensos para cerdas producidos en la explotación.
No obstante, la presencia de dos explotaciones, cada una de ellas con un valor de micotoxinas superior al límite, puso de manifiesto la necesidad de realizar controles en los piensos para cerdas producidos en la explotación.
MICOTOXINAS DETECTADAS EN CALOSTRO
![]()
Todas las muestras de calostro recogidas en las 13 granjas seleccionadas fueron analizadas para detectar al menos una categoría de micotoxinas (AFs, FUMs y DON) y los resultados se presentan en la Tabla 2.

| AFLATOXINAS Todas las muestras de calostro resultaron negativas para las AFs. La concentración de AFs encontrada en las muestras de pienso era aparentemente demasiado baja para detectar su presencia en el calostro, teniendo en cuenta que, en otros estudios realizados en cerdas, se ha puesto de manifiesto su transferencia a la leche con dosis más altas en el pienso.El nivel de las aflatoxinas AFB1 y AFB2 fue de 6,4±0,5 y 0,67±0,05 g/kg de pienso, respectivamente16.  Estos datos mostraron que los niveles de transferencia al calostro (relación entre los valores de AF en el calostro y en el pienso) eran muy bajos, concretamente, para AFB1 y AFM1 eran inferiores al 0,1%, y para la AFB2 era del 0,35%10. Estos datos mostraron que los niveles de transferencia al calostro (relación entre los valores de AF en el calostro y en el pienso) eran muy bajos, concretamente, para AFB1 y AFM1 eran inferiores al 0,1%, y para la AFB2 era del 0,35%10. |
| FUMONISINAS En este estudio, el criterio de selección de las fumonisinas fue el mismo que el adoptado para las aflatoxinas. A pesar de estar presentes en pequeñas cantidades en el pienso, a menudo se detectó una señal en el calostro (5/11 de las muestras de calostro) pero, en general, por debajo del límite de cuantificación estándar (LOQ).Por regla general, el calostro positivo se asocia con el pienso que tiene la mayor concentración de fumonisinas. Esto indica que, para las fumonisinas, debe prestarse atención a los ingredientes de los piensos para cerdas. |
| DEOXINIVALENOL La información obtenida en este estudio demostró la presencia de DON en los piensos utilizados para las cerdas lactantes, con valores cercanos al límite recomendado para los piensos. También se demostró la capacidad del DON de ser transferido del torrente sanguíneo al calostro, observándose en 10 de las 14 muestras de calostro analizadas.El coeficiente de correlación entre los valores del pienso y los del calostro fue de +0,647 (p = 0,012).  Este valor global indica la existencia de una asociación entre la presencia de DON en el pienso suministrado en el periodo inmediatamente anterior al parto y la observada en el calostro de la cerda.En particular, en la granja que presentaba la muestra de pienso contaminada con el valor de DON superior al límite recomendado, también se detectó el nivel más alto de DON en el calostro (10,9 g/kg). Este valor global indica la existencia de una asociación entre la presencia de DON en el pienso suministrado en el periodo inmediatamente anterior al parto y la observada en el calostro de la cerda.En particular, en la granja que presentaba la muestra de pienso contaminada con el valor de DON superior al límite recomendado, también se detectó el nivel más alto de DON en el calostro (10,9 g/kg). A este respecto, no hay indicios sobre la transferencia de DON a la leche de las cerdas y sobre la posibilidad de que se hayan alcanzado los límites tóxicos para los lechones al ingerir calostro o leche contaminados. Sin embargo, se puede realizar una estimación considerando el valor más alto encontrado en el calostro de la cerda en el presente estudio y en los estudios de toxicidad para el DON en lechones destetados de 4 semanas de edad.
|
| Debido a la ausencia de valores de referencia para el nivel de toxicidad en lechones recién nacidos, su reducida inmunocompetencia23, el riesgo de la mayor ingestión de DON debido a la ingesta continua de leche y la potencial ingestión de pienso contaminado durante todo el periodo de lactación por parte de las cerdas, se sugiere controlar la alimentación de las cerdas con frecuencia, siendo necesario realizar más estudios, en particular sobre la transferencia de DON y la toxicidad en el lechón. |

CONCLUSIONES
Los valores encontrados en cuanto a la presencia de aflatoxinas en las muestras de piensos suministradas a las cerdas en los días inmediatamente anteriores al parto no parecieron representar un riesgo de transferencia al calostro, ya que las aflatoxinas no fueron detectables en las muestras de calostro.
Las muestras de piensos que mostraban la presencia de fumonisinas por encima de los valores máximos orientativos eran poco frecuentes. Sin embargo, debería prestarse más atención a los niveles de fumonisinas en relación con la transferencia al calostro como fuente potencial de riesgo para los lechones recién nacidos.
En el caso del deoxinivalenol, la ausencia de valores de referencia para los lechones lactantes pone de manifiesto la necesidad de controlar con frecuencia la alimentación de las cerdas y de llevar a cabo más estudios, sobre todo en lo que respecta a la transferencia de DON desde la madre al calostro o a la leche, así como su toxicidad para el lechón.
BIBLIOGRAFÍA
1. Streit, E.; Naehrer, K.; Rodrigues, I.; Schatzmayr, G. Mycotoxin occurrence in feed and feed raw materials worldwide: Long-term analysis with special focus on Europe and Asia. J. Sci. Food Agric. 2013, 93, 2892–2899 [CrossRef] [PubMed]
2. Magnoli, A.P.; Poloni, V.L.; Cavaglieri, L. Impact of mycotoxin contamination in the animal feed industry. Curr. Opin. Food Sci. 2019, 29, 99–108. [CrossRef]
3. Marin, S.; Ramos, A.; Cano-Sancho, G.; Sanchis, V. Mycotoxins: Occurrence, toxicology, and exposure assessment. Food Chem. Toxicol. 2013, 60, 218–237. [CrossRef] [PubMed]
4. Pinton, P.; Oswald, I.P. Effect of Deoxynivalenol and Other Type B Trichothecenes on the Intestine: A Review. Toxins 2014, 6, 1615–1643. [CrossRef] [PubMed]
5. Pierron, A.; Alassane-Kpembi, I.; Oswald, I.P. Impact of mycotoxin on immune response and consequences for pig health. Anim. Nutr. 2016, 2, 63–68. [CrossRef] [PubMed]
6. Cortinovis, C.; Pizzo, F.; Spicer, L.J.; Caloni, F. Fusarium mycotoxins: Effects on reproductive function in domestic animals—A review. Theriogenology 2013, 80, 557–564. [CrossRef]
7. Haschek, W.M.; Gumprecht, L.A.; Smith, G.; Tumbleson, M.E.; Constable, P.D. Fumonisin toxicosis in swine: An overview of porcine pulmonary edema and current perspectives. Environ. Health Perspect. 2001, 109, 251–257. [CrossRef]
8. Lei, M.; Zhang, N.; Qi, D. In vitro investigation of individual and combined cytotoxic effects of aflatoxin B1 and other selected mycotoxins on the cell line porcine kidney 15. Exp. Toxicol. Pathol. 2013, 65, 1149–1157. [CrossRef]
9. Chaytor, A.C.; See, M.T.; Hansen, J.A.; De Souza, A.L.P.; Middleton, T.F.; Kim, S.W. Effects of chronic exposure of diets with reduced concentrations of aflatoxin and deoxynivalenol on growth and immune status of pigs1. J. Anim. Sci. 2011, 89, 124–135. [CrossRef]
10. Directive 2002/32/EC of the European Parliament and of the Council of 7 May 2002 on Undesirable Substances in Animal Feed—Council Statement. Available online: http://eur-lex. europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG: 2002L0032:20090420:EN:PDF (accessed on 15 November 2020).
11. Commission Recommendation (2006/576/EU) of 17 August 2006 on the Presence of Deoxynivalenol, Zearalenone, ochratoxin A, T-2 and HT-2 and Fumonisins in Products Intended for Animal Feeding. Available online: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2006:229:0007:0009:EN:PDF (accessed on 15 November 2020).
12. Ramos, A.; Hernandez, E. In situ absorption of aflatoxins in rat small intestine. Mycopathology 1996, 134, 27–30. [CrossRef]
13. Gratz, S.W.; Dinesh, R.; Yoshinari, T.; Holtrop, G.; Richardson, A.J.; Duncan, G.;Macdonald, S.; Lloyd, A.; Tarbin, J. Masked trichothecene and zearalenone mycotoxins withstand digestion and absorption in the upper GI tract but are efficiently hydrolyzed by human gut microbiota in vitro. Mol. Nutr. Food Res. 2017, 61, 1600680. [CrossRef] [PubMed]
14. Kutz, R.; Sampson, J.; Pompeu, L.; LeDoux, D.R.; Spain, J.; Vázquez-Añón, M.; Rottinghaus, G. Efficacy of Solis, NovasilPlus, and MTB-100 to reduce aflatoxin M1 levels in milk of early to mid lactation dairy cows fed aflatoxin B1. J. Dairy Sci. 2009, 92, 3959–3963. [CrossRef] [PubMed]
15. Rodríguez-Blanco, M.; Ramos, A.J.; Prim, M.; Sanchis, V.; Marín, S. Usefulness of the analytical control of aflatoxins in feedstuffs for dairy cows for the prevention of aflatoxin M1 in milk. Mycotoxin Res. 2019, 36, 11–22. [CrossRef] [PubMed]
16. European Commission. Commission regulation 2006/1881/EC of 19, 2006 setting maximum levels for certain contaminants in foodstuffs. O. J. Eur. Union 2006, L364, 5–24.
17. Bertuzzi, T.; Pietri, A.; Barbieri, G.; Piva, G. Aflatoxin residues in milk of sows fed a naturally contaminated diet. It. J. Anim. Sci. 2003, 2 (Suppl. 1.), 234–236. [CrossRef]
18. Felloni, E. Immunovaccinazione nei confronti di Aflatossina B1 nel suino: Rilievi anatoistopatologici in scrofa gravide vaccinate e successivamente esposte a mangime contaminato e nella loro prole. Ph.D. Thesis, Università di Parma. Dipartimento di salute animale, Parma, Italy, 2010.
19. Prodanov-Radulovic, J.; Zivkov-Balos, M.; Jakši´c, S.; Grgic, Z.; Stojanov, I.; Bojkovski, J.; Tassis, P.D. Aflatoxin M1 levels in sow milk. J. Hell. Veter.-Med. Soc. 2018, 68, 341–346 [CrossRef]
20. Bracarense, A.-P.F.L.; Lucioli, J.; Grenier, B.; Pacheco, G.D.; Moll,W.-D.; Schatzmayr, G.; Oswald, I. Chronic ingestion of deoxynivalenol and fumonisin, alone or in interaction, induces morphological and immunological changes in the intestine of piglets. Br. J. Nutr. 2011, 107, 1776–1786. [CrossRef] [PubMed]
21. Lessard, M.; Savard, C.; Deschene, K.; Lauzon, K.; Pinilla, V.; Gagnon, C.A.; Lapointe, J.; Guay, F.; Chorfi, Y. Impact of deoxynivalenol (DON) contaminated feed on intestinal integrity and immune response in swine. Food Chem. Toxicol. 2015, 80, 7–16. [CrossRef]
22. Pinton, P.; Accensi, F.; Beauchamp, E.; Cossalter, A.-M.; Callu, P.; Grosjean, F.; Oswald, I. Ingestion of deoxynivalenol (DON) contaminated feed alters the pig vaccinal immune responses. Toxicol. Lett. 2008, 177, 215–222. [CrossRef] [PubMed]
23. Pabst, R.; Rothkötter, H.J. Postnatal development of lymphocyte subsets in different compartments of the small intestine of piglets. Veter. Immunol. Immunopathol. 1999, 72, 167–173. [CrossRef]
24. Hasan, S.; Orro, T.; Valros, A.; Junnikkala, S.; Peltoniemi, O.; Oliviero, C. Factors affecting sow colostrum yield and composition, and their impact on piglet growth and health. Livest. Sci. 2019, 227, 60–67. [CrossRef]
[/registrados]
