Validación de marcadores genéticos y fenotipos de inmunidad para mejorar la robustez y resistencia a enfermedades en cerdos
Para leer más contenidos de Revista porciSapiens Octubre 2024
Para leer más contenidos de Revista porciSapiens Octubre 2024
En el sector porcino, la mejora genética se ha convertido en una herramienta clave para enfrentar patógenos endémicos y emergentes. Este artículo presenta los resultados de la validación de marcadores genéticos asociados con la inmunocompetencia y la supervivencia frente al PRRSV, destacando su potencial para fortalecer la salud de la cabaña porcina y reducir la mortalidad en situaciones de brote.
MEJORA GENÉTICA PARA HACER FRENTE A LAS ENFERMEDADES PORCINAS
En los últimos años, el sector porcino ha realizado un esfuerzo significativo para reducir el uso de antibióticos con el fin de hacer frente al incremento de las resistencias antimicrobianas. No obstante, el control de patógenos endémicos y emergentes sigue siendo uno de los mayores desafíos de la producción porcina, dado el impacto social y económico que generan.
| En este contexto, además de los métodos convencionales de vacunación y el refuerzo de las medidas de bioseguridad, las empresas de selección genética están incorporando en sus programas de mejora marcadores genéticos y caracteres relacionados con la salud animal para producir poblaciones porcinas más robustas y resilientes. |
Existen diversas aproximaciones para identificar marcadores de robustez y resiliencia.
MÉTODOS DIRECTOS
Los métodos directos consisten en estudiar la susceptibilidad/ resistencia genética a enfermedades específicas y, por tanto, requieren la exposición de los animales a los agentes infecciosos.


MÉTODOS INDIRECTOS
Los métodos indirectos centrados en mejorar la inmunocompetencia global de los animales sanos son una buena estrategia para tener una cabaña porcina más robusta y resistente a enfermedades.
| En esta aproximación los caracteres de inmunidad se consideran parámetros biológicamente relevantes para medir la inmunocompetencia. Estos caracteres pueden dividirse en los dos componentes principales del sistema inmunitario:
|

PROYECTOS IMMUPIGEN Y METAPIGEN
En los últimos años y como resultado de los proyectos IMMUPIGEN (AGL2016-75432-R) y METAPIGEN (PID2020-112677RB-C21), hemos analizado un total de 41 caracteres relacionados con la salud animal, que engloban fenotipos de inmunidad, hematológicos y de estrés, en 432 animales sanos de una línea comercial Duroc de la empresa Selección Batallé.
Los principales resultados muestran que muchos de estos caracteres están determinados a nivel genético, mostrando heredabilidades medias-altas y correlaciones genéticas, tanto positivas como negativas, entre estos fenotipos, así como con otros fenotipos relacionados con la producción y la calidad de la carne.
A nivel genómico, se han identificado un total de 58 polimorfismos, ubicados en 11 regiones cromosómicas y asociados a las variaciones en:[registrados]
Además, mediante la utilización de datos de transcriptómica en sangre total, hemos podido analizar los niveles de ARN mensajero en un total de 255 individuos de la población IMMUPIGEN, identificando biomarcadores para algunas de las poblaciones de células T.
No obstante, antes de incorporar estos (bio)marcadores y fenotipos de salud en los esquemas de selección, es fundamental validar su utilidad para mejorar la inmunocompetencia de los animales mediante experimentos in vitro e in vivo frente a diferentes tipos de factores bióticos (patógenos, antígenos vacunales, etc.).
| En este artículo presentamos la validación de varios fenotipos y (bio)marcadores de inmunidad previamente identificados por nuestro grupo, a través de su asociación con la supervivencia de los animales tras una infección natural con el virus del Síndrome Reproductivo y Respiratorio Porcino (PRRSV). |

VALIDACIÓN DE FENOTIPOS Y (BIO)MARCADORES
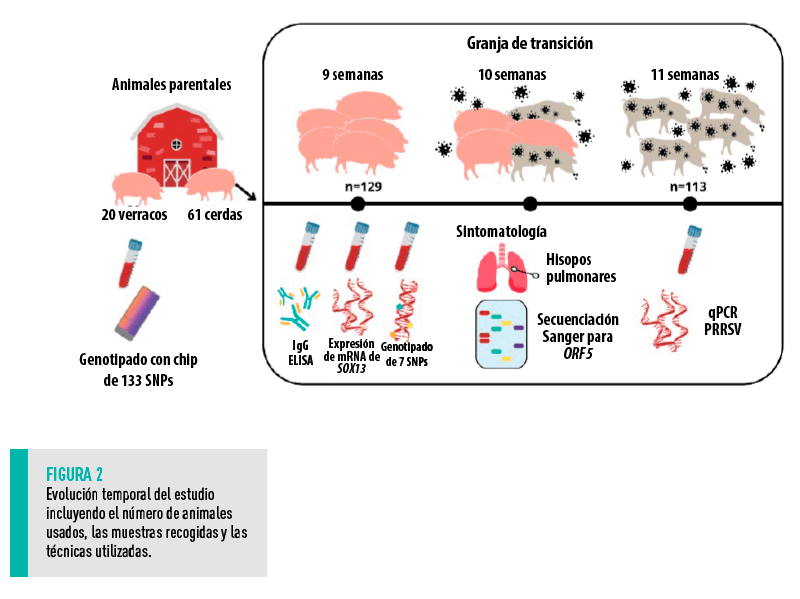
Para la validación de los marcadores, se utilizaron un total de 129 lechones hembras en transición de una línea comercial Duroc.
| Los lechones se engordaron en seis corrales consecutivos y provenían del cruce de 61 hembras con 20 machos activos de la población comercial. Todos los animales provenían de una granja de reproductoras negativas y en el inicio del estudio estaban sanos, sin ningún signo de infección. |
En la Figura 2 se muestra un cronograma del estudio con los animales, muestras y técnicas utilizadas. A los 60 ± 2d de vida se recogieron muestras de sangre para medir los fenotipos de inmunidad:
1. La concentración de inmunoglobulinas IgG en plasma mediante ELISA.
2. La expresión del gen SOX13, un biomarcador de células T γδ, mediante PCR cuantitativa.
Una semana después, los lechones se infectaron naturalmente con una cepa de alta patogenicidad del virus de PRRS (genotipo 1).

Una semana después se tomaron muestras de sangre de 88 animales para aislar el ARN viral, confirmándose que todos los animales contenían elevadas dosis del virus (Ct<25 en el 90% de los animales).
LA INFECCIÓN DURÓ 6 SEMANAS Y RESULTÓ EN UNA TASA DE MORTALIDAD DE 47 LECHONES MUERTOS POR 82 ANIMALES VIVOS
A las 15 semanas de vida, las 82 hembras supervivientes se trasladaron a una nave de engorde. Los animales estaban aparentemente sanos, aunque 4 animales más murieron durante este período. Los 78 animales restantes se sacrificaron a un peso medio de 137 kg, entre 245 y 262 días de edad. Después del sacrificio, se midió:
|
 |
Las medidas de los animales en el matadero se promediaron por camada. |
Un primer análisis descriptivo de los datos mostró un importante efecto genético, ya que se observaron diferencias en la supervivencia de los lechones al brote de PRRS en función del padre.

ESTAS 28 HIJAS TENÍAN NIVELES SIGNIFICATIVAMENTE MENORES DE IgG EN SANGRE Y MAYOR EXPRESIÓN DEL GEN SOX13 EN SANGRE QUE EL RESTO DE LA POBLACIÓN
MARCADORES DE RESISTENCIA AL PRRS
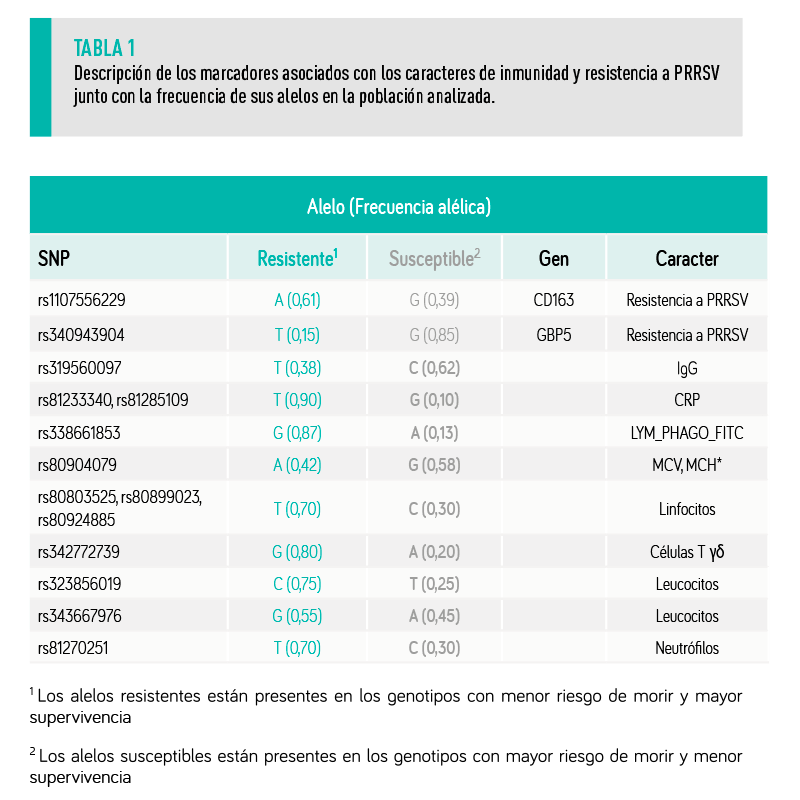
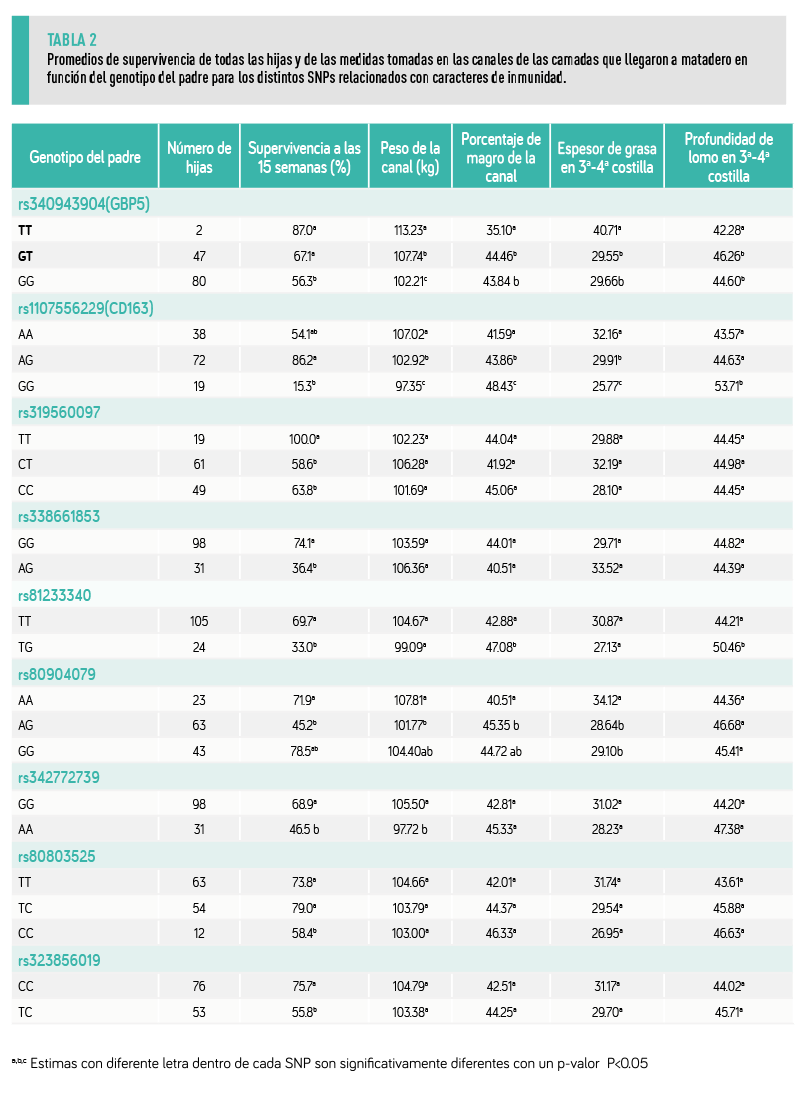
Los 20 padres estaban genotipados con un panel comercial de 128 polimorfismos de un solo nucleótido (SNPs), que se utiliza para controlar las paternidades, y se modificó para incluir también SNPs asociados con caracteres productivos y de salud animal identificados en el proyecto IMMUPIGEN y METAPIGEN (Tabla 1).
Para completar el estudio genético, tanto los 20 padres como sus 129 hijas se genotiparon con SNPs específicos de resistencia a PRRS:
|
 |
Para cada uno de estos SNPs se hizo un test de asociación con el riesgo de morir en el brote de PRRS usando un modelo de riesgos proporcionales que corregía el efecto de la camada y del corral. |
El estudio de asociación para los marcadores específicos de resistencia a PRRS se hizo comparando los genotipos de los animales para cada marcador.
| Los animales con genotipos susceptibles tienen un mayor riesgo de morir y sobreviven menos durante el brote, mientras que los animales con genotipos resistentes tienen un menor riesgo de morir y sobreviven más. |
Este estudio mostró que los marcadores rs1107556229 y rs340943904 estaban asociados con el riesgo de morir en el brote de PRRS.

El resto de los marcadores específicos de resistencia a PRRS no resultaron significativamente asociados al riesgo de morir de los animales en nuestro brote.
MARCADOR rs1107556229
![]()
Los macrófagos alveolares porcinos (MAPs) son una importante línea de defensa contra la infección por PRRSV y son la principal célula diana para la replicación del virus.
EL GEN CD163 CODIFICA UN RECEPTOR CELULAR PARA LA ENTRADA DEL PRRSV EN LOS MACRÓFAGOS
Nuestros resultados muestran que el alelo mayor (A) del marcador rs1107556229 está significativamente asociado con una mayor supervivencia al brote de PRRS y a una mayor ganancia de peso posterior a la infección que el alelo (G) (Tabla 2).
MARCADOR rs340943904
![]()
El otro marcador asociado con la resistencia a las infecciones de PRRSV es el rs340943904 del gen GBP5.
EL GEN GBP5 SE HA DESCRITO COMO MARCADOR DE MACRÓFAGOS CLÁSICAMENTE ACTIVADOS INDUCIDOS POR INTERFERÓN GAMMA (INF-γ)
Nuestros resultados muestran que el alelo menor (T) para este marcador está asociado con mayor supervivencia y crecimiento posterior a la infección con PRRSV (Tabla 2).
Nuestro estudio también mostró una interacción significativa entre ambos marcadores (rs340943904 y rs1107556229) (Figura 3), lo que sugiere una interacción biológica entre ambos genes (CD163 y GBP5).
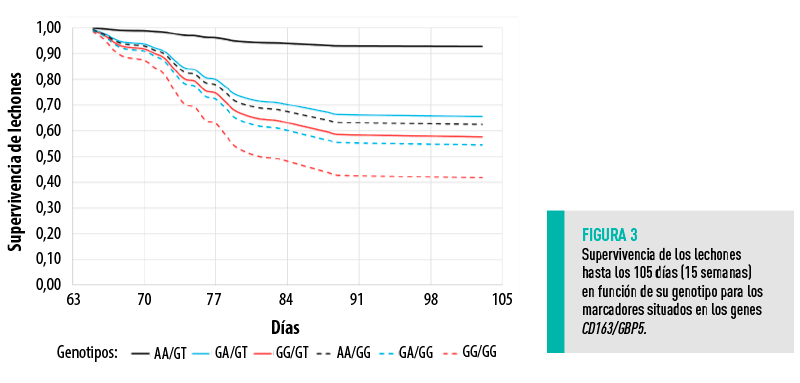

MARCADORES DE INMUNOCOMPETENCIA GLOBAL
En cuanto a los caracteres relacionados con la inmunocompetencia global, al no disponer de los genotipos de los animales, el estudio de asociación se hizo comparando los genotipos de los padres para cada marcador (Tabla 1).

En este estudio resultaron significativamente asociados con la supervivencia al brote de PRRSV los marcadores genéticos asociados a la variación de los:
Estos polimorfismos están relacionados tanto con la inmunidad innata o no específica como con la inmunidad adaptativa o específica. |
CRP
![]()
La proteína C reactiva (CRP), es una proteína de fase aguda que juega un papel importante durante las infecciones.
Dependiendo de su conformación, la CRP puede:
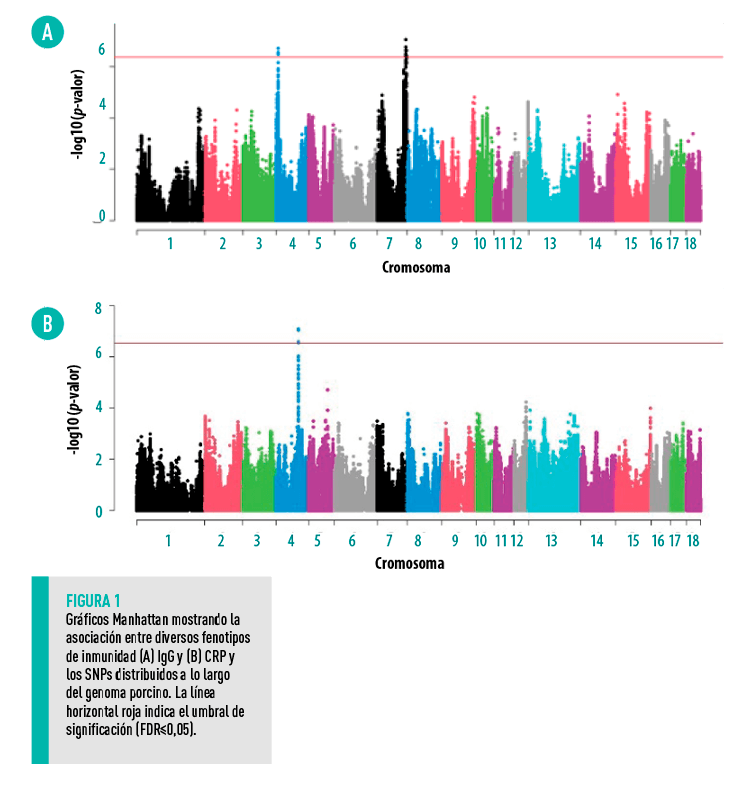
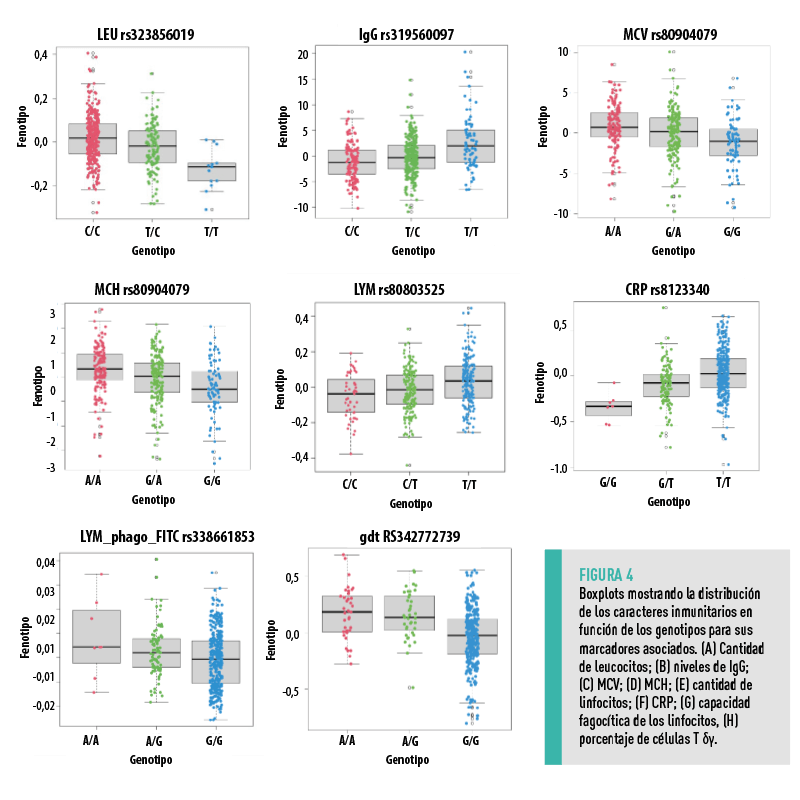
En nuestro estudio, el alelo T del SNP rs81233340, localizado en el gen CRP, se asoció significativamente con una mayor supervivencia de las hijas a PRRSV y un mayor nivel de CRP en sangre (Figura 4). |
CÉLULAS T γ δ
![]()
La producción de INF-γ juega un papel importante en la protección frente a la infección por PRRSV. Además de los macrófagos, se ha descrito que otras células como las células T γδ producen INF-γ durante la infección por PRRSV.
Estas células pueden clasificarse en diferentes poblaciones con diferentes capacidades para responder a patógenos específicos y generar respuestas de citoquinas. Las células WC1.1+ y WC1.2+ difieren en la expresión de citoquinas:
|
SE HA OBSERVADO UNA MAYOR EXPRESIÓN DE SOX13 EN LAS CÉLULAS WC1.2+, LO QUE INFLUYE EN SU DIFERENCIACIÓN HACIA CÉLULAS T γδ PRODUCTORAS DE IL-17
EXPRESIÓN DE SOX13
![]()
Nuestros resultados mostraron que niveles más bajos de expresión de SOX13 se asociaron con una mayor supervivencia durante un brote de PRRS. Además, el marcador genético rs342772739 estuvo relacionado con la expresión del gen SOX13 en nuestro estudio.
Este SNP ha sido previamente asociado con el porcentaje de células T γδ.
|
CANTIDAD DE LEUCOCITOS Y LINFOCITOS
![]()
Otros marcadores asociados con la cantidad de leucocitos (rs323856019) y linfocitos (rs80803525) en sangre también se identificaron como asociados a la supervivencia de las hijas tras el brote de PRRS.

Además de la inducción de respuestas inmunitarias mediadas por células T, después de la infección por PRRSV se observa una respuesta humoral caracterizada por una producción inicial de anticuerpos no neutralizantes, seguida por la inducción tardía de anticuerpos neutralizantes.
EN NUESTRO ESTUDIO, LOS ANIMALES CON MAYORES NIVELES BASALES DE IgG EN PLASMA SE ASOCIARON CON UNA MAYOR SUPERVIVENCIA AL BROTE DE PRRSV
A este respecto, Ballester et al. (2020) describieron un SNP (rs319560097) en la región proximal del cromosoma porcino SSC4 que estaba asociado con mayores niveles de IgG en plasma (Figura 4) y que también está asociado con una mayor supervivencia en nuestro estudio.
CAPACIDAD FAGOCÍTICA DE LOS LINFOCITOS
![]()
Otro marcador interesante asociado con las células B es el rs338661853.
| Muchos estudios en mamíferos han demostrado que las células B tienen capacidad fagocítica, siendo capaces de fagocitar partículas, incluidas bacterias, y presentar de forma más eficiente los antígenos particulados fagocitados a las células T CD4+, optimizando la inducción de la respuesta humoral. |
| En nuestro estudio, el alelo mayor G, previamente asociado con una menor capacidad fagocítica (Figura 4), se asoció con mayor supervivencia al brote de PRRSV. |
PARÁMETROS HEMATOLÓGICOS
![]()
Finalmente, otros marcadores relacionados con los caracteres hematológicos, como el MCV y MCH (rs80904079), también resultaron asociados con la supervivencia al brote de PRRSV.

La selección de animales para producir una buena respuesta inmunitaria frente al PRRSV debe considerar tanto caracteres de inmunidad innata como adaptativa.
Los padres que acumulan más alelos resistentes para ambos tipos de caracteres tienen hijas con mayores niveles de IgG en sangre, menor expresión del gen SOX13, mayor supervivencia ante los brotes de PRRSV y un crecimiento post-infección superior, lo que se traduce en mayores pesos de canal en el matadero, con un mayor espesor de grasa dorsal y un menor porcentaje de magro.
En conclusión, nuestros resultados validan los fenotipos y (bio)marcadores analizados para supervivencia a PRRSV y respaldan la posibilidad de implementar programas de selección incorporando fenotipos y marcadores genéticos de inmunidad para mejorar la inmunocompetencia de los cerdos.
Artículo adaptado de: Tarres, J. et al. Genetic determination of piglet survival upon PRRSV outbreaks. 2024. doi: 10.21203/rs.3.rs-4503083/v1.
BIBLIOGRAFÍA
1. Bai X, Plastow GS (2022) Breeding for disease resilience: opportunities to manage polymicrobial challenge and improve commercial performance in the pig industry. CABI Agric Biosci 3. https://doi. org/10.1186/S43170-022-00073-Y
2. Visscher AH, Janss LL, Niewold TA, de Greef KH (2002) Disease incidence and immunological traits for the selection of healthy pigs. A review. Vet Q 24:29–34. https://doi.org/10.1080/01652176.2002.9695121
3. Ballester M, Ramayo-Caldas Y, González-Rodríguez O, et al (2020) Genetic parameters and associated genomic regions for global immunocompetence and other health-related traits in pigs. Sci Rep 10. https:// doi.org/10.1038/s41598-020-75417-7
4. Ballester M, Jové-Juncà T, Pascual A, et al (2023) Genetic architecture of innate and adaptive immune cells in pigs. Front Immunol 14. https://doi.org/10.3389/ fimmu.2023.1058346
Te puede interesar: Identificación de marcadores genéticos de células linfocitarias para mejorar la robustez y resistencia a enfermedades en cerdos
[/registrados]
