Porcisapiens
Avances en el desarrollo de métodos de detección de residuos antibióticos en animal vivo
Para leer más contenidos de porciSapiens Abril 2021
Porcisapiens
Para leer más contenidos de porciSapiens Abril 2021


En este ámbito, las autoridades sanitarias cuentan con una legislación amplia y protectora que, junto al uso responsable y los programas de control, han logrado reducir la aparición de alimentos contaminados con residuos de antibióticos hasta porcentajes tan bajos como el 0,3% en 2018 (EFSA, 2020).
Precisamente es el Reglamento 2377/90 el que fija los Límites Máximos de Residuos (LMRs) de estos compuestos permitidos en alimentos de origen animal, punto clave en el establecimiento de los periodos de supresión requeridos para todo medicamento veterinario (Directiva 2001/82/CE).
Los LMRs son también punto de referencia para la implementación de los métodos de vigilancia y control (Decisión de la Comisión 2002/657/ CE) y, por ende, en los planes nacionales de vigilancia (Directiva 96/23/CE).
Así, los datos oficiales dan seguridad al consumidor y reflejan, no solo el buen hacer de los productores sino la efectividad de los planes de vigilancia
En un primer momento, se lleva a cabo un método de cribado que permite el análisis rápido de un elevado número de compuestos. Este método es cualitativo y necesita de un segundo paso en el que se lleva a cabo la determinación y cuantificación del compuesto.
MÉTODOS DE CRIBADO
Tradicionalmente, los métodos de cribado han tenido base biológica. De hecho, fueron los primeros métodos en desarrollarse (Mitchell et al., 1998) y se basan en la inhibición del crecimiento de un microorganismo sensible a la presencia de antimicrobianos. En la actualidad siguen siendo ampliamente empleados ya que son baratos y de amplio espectro (Pikkemaat, 2009).
DETERMINACIÓN Y CUANTIFICACIÓN
Cuando el microorganismo muestra cierto nivel de inhibición del crecimiento por exposición a la muestra estudiada, ésta se considera positiva y es necesario llevar a cabo su confirmación mediante un método que permita identificar el compuesto inhibitorio y determinar su concentración.
Normalmente, estos métodos confirmatorios se basan en las propiedades físico-químicas de los antibióticos (HPLC, LC-MS/MS) (Gaudin, 2017).
Aunque los planes de vigilancia cumplen con los requisitos propuestos en la Directiva 96/23/CE y han probado cumplir sus objetivos, presentan un inconveniente derivado de los métodos de control: son baratos y fáciles de manejar, pero todos ellos se llevan a cabo tras el sacrificio del animal.
EL USO DE MÉTODOS DE DETECCIÓN PRECISOS, FIABLES Y SENSIBLES ES ESENCIAL PARA EVITAR LA INCORPORACIÓN DE ANTIBIÓTICOS A LA CADENA ALIMENTARIA
A pesar de preservar la salud del consumidor, los métodos actuales no evitan los problemas ligados a la aparición de una canal positiva que ha de ser decomisada:
![]() La repercusión económica es [registrados]importante para los productores, que se enfrentan a la pérdida del capital invertido en criar el animal, desvanecido por su venta frustrada, sin olvidar las consecuencias legales que podría tener el incumplimiento de la normativa vigente.
La repercusión económica es [registrados]importante para los productores, que se enfrentan a la pérdida del capital invertido en criar el animal, desvanecido por su venta frustrada, sin olvidar las consecuencias legales que podría tener el incumplimiento de la normativa vigente.
![]() El nocivo impacto medioambiental ligado a la cría de animales que terminan como un desecho, no sólo por los recursos consumidos (agua, energía, etc.) sino por las emisiones al medio (aguas residuales, purines, emisiones de gases, etc.) y la complicada gestión de canales contaminadas (Djekic et al., 2015).
El nocivo impacto medioambiental ligado a la cría de animales que terminan como un desecho, no sólo por los recursos consumidos (agua, energía, etc.) sino por las emisiones al medio (aguas residuales, purines, emisiones de gases, etc.) y la complicada gestión de canales contaminadas (Djekic et al., 2015).
| Es importante señalar que estos inconvenientes no son las implicaciones más graves de la existencia de canales contaminadas, ya que un fallo en su detección derivaría en la incorporación de residuos antibióticos en la cadena alimentaria, con el consiguiente impacto directo e indirecto en la salud humana (alergias, antibiorresistencias, etc.). |
EL RETO DE LA DETECCIÓN DE ANTIBIÓTICOS EN ANIMALES VIVOS
OBJETIVO

Este proyecto une el esfuerzo de universidades públicas, centros de investigación y empresas privadas del área transfronteriza España – Francia – Andorra (POCTEFA) en su afán por ofrecer herramientas innovadoras y ponerlas al servicio de todos los agentes de la cadena alimentaria. En concreto, el proyecto está liderado por la Universidad de Zaragoza – Instituto Agroalimentario de Aragón (IA2) y cuenta con la colaboración de la Universidad de La Rioja, el Laboratorio de Salud Pública del Gobierno Vasco, la Fundación Vasca de Innovación e Investigación Sanitaria y Zeulab S.L. como socios españoles, y la Universidad de Perpignan Vía Domitia y el INRA (Institut National de la Recherche Agronomique) como socios franceses.
Estas entidades, de acreditada experiencia en diversos aspectos relacionados con esta problemática, propusieron una solución innovadora: la adaptación de los métodos de cribado actuales para la detección de antibióticos en animales vivos.
Este nuevo enfoque requiere de una matriz adecuada para llevar a cabo los análisis, de fácil obtención a nivel de producción y que presente una buena correlación con la concentración presente en músculo.
Son muchas las matrices que pueden obtenerse de un animal vivo mediante un método mínimamente invasivo, pero al igual que en muchas otras pruebas, de resultar adecuado, la sangre sería el fluido idóneo.
Sin embargo, a pesar de que existen estudios sobre la concentración de antibióticos en músculo (Reyes-Herrera et al., 2005) y plasma sanguíneo (Hernández et al., 2005; Ziółkowski et al., 2016), sorprendentemente, existe poca información sobre la relación entre los niveles de antibióticos de estas dos matrices. Además, no se puede obviar la dependencia de esta relación y la farmacocinética característica de cada familia de antibióticos.
Así pues, el presente estudio se planteó para explorar esta correspondencia a través de la creación de un banco de muestras naturalmente contaminadas por antimicrobianos de distintas familias (quinolonas, sulfonamidas, β-lactámicos y tetraciclinas) con objeto de obtener muestras pareadas de sangre y músculo con distintas concentraciones de antimicrobianos (correspondientes a diferentes días del periodo de supresión) y averiguar si la sangre es un buen indicador de la presencia de residuos antibióticos en músculo y, por ende, una matriz adecuada para el desarrollo de métodos de detección aptos para análisis ante mortem.
MATERIALES Y MÉTODOS
ANTIMICROBIANOS
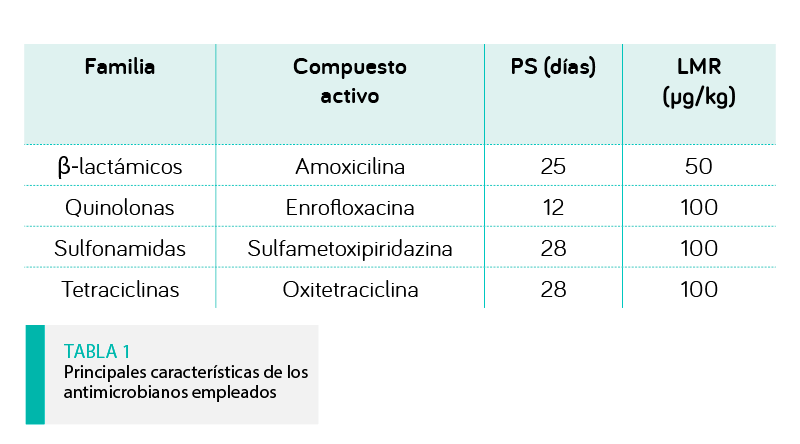
Los antimicrobianos seleccionados para cada tratamiento fueron oxitetraciclina (una tetraciclina), sulfametoxipiridazina (una sulfonamida), enrofloxacina (una quinolona) y amoxicilina (una penicilina), ya que están entre los antimicrobianos de mayor importancia en medicina humana y se metabolizan siguiendo rutas diferentes (Riviere, 2009). La Tabla 1 recoge la información principal de cada antimicrobiano.
CUANTIFICACIÓN DE LAS MUESTRAS POR HPLC
La caracterización de las muestras de músculo y sangre se llevó a cabo en el Laboratorio de Salud Pública del Gobierno Vasco por HPLC-FLD y LC-MS/MS.
BANCO DE MUESTR AS NATUR ALMENT E CONTAMINADAS
Para obtener muestras biológicas contaminadas de forma natural por los antibióticos de elección, se adquirieron 120 cerdos. La Tabla 1 resume las principales características de los tratamientos antimicrobianos. Tras la administración intramuscular de los antibióticos, los animales fueron sacrificados a intervalos de tiempo preseleccionados durante el periodo de supresión (PS) y se conservaron músculo (lomos, cuartos delanteros y traseros) y suero sanguíneo en congelación (-20°C).
AUTORIZACIÓN DEL COMITÉ ÉTICO
Los animales fueron sacrificados de acuerdo al Reglamento (CE) Nº. 1099/2009 relativo a la protección de los animales en el momento de la matanza. La Comisión Ética Asesora para la Experimentación Animal de la Universidad de Zaragoza aprobó el protocolo experimental (PI58/17).
RESULTADOS Y DISCUSIÓN
En primer lugar, tras la obtención de las muestras, se comprobó que la distribución del antibiótico fuese homogénea entre los distintos grupos musculares (lomos, cuartos delanteros y traseros).
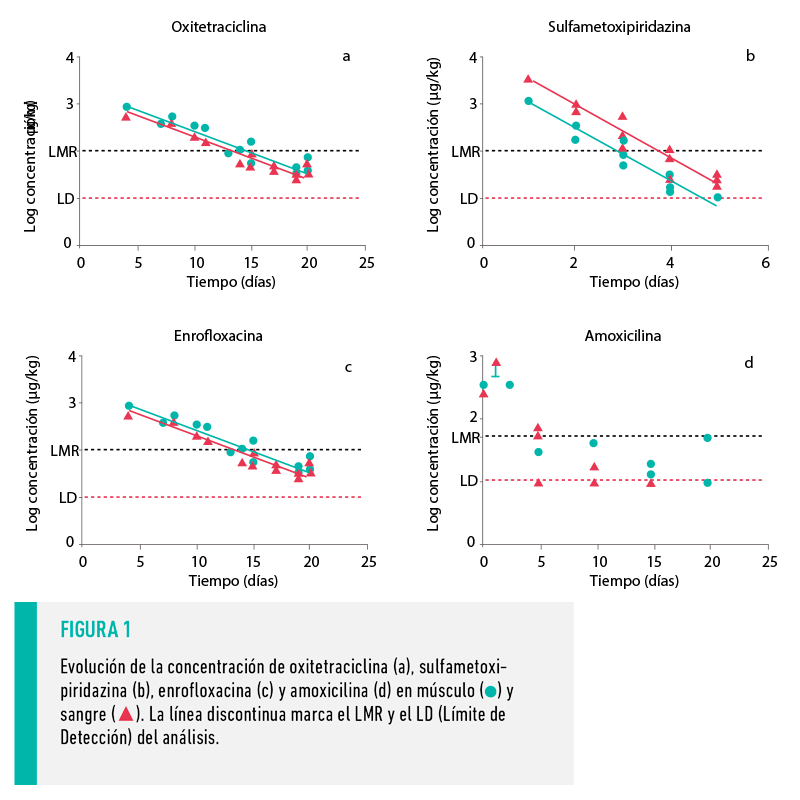
Las diferencias fueron pequeñas y las mayores concentraciones se describieron en los lomos, por lo que se decidió analizar por HPLC o LC-MS/MS únicamente el lomo y el suero sanguíneo, obteniendo la evolución de su concentración a lo largo del periodo de supresión (Figura 1).
SE COMPARÓ LA CONCENTRACIÓN DE LOS ANTIBIÓTICOS EN EL LOMO Y EL SUERO SANGUÍNEO A LO LARGO DEL PERIODO DE SUPRESIÓN
Para todos los compuestos, las muestras correspondientes a los primeros días del periodo de supresión contenían concentraciones elevadas de antimicrobiano que disminuían por debajo del LMR antes de su finalización.
La Tabla 2 muestra la diversidad de las muestras que componen el banco de muestras, formado por más de 11.000 (1.500 de ellas de animales no tratados), de las cuales más del 50% están contaminadas por encima del LMR.
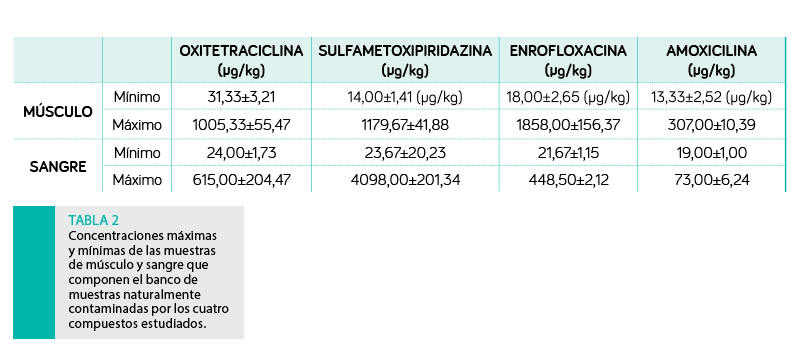
A partir de las concentraciones descritas en músculo a lo largo del periodo de supresión, se calcularon los tiempos de vida media para cada antibiótico y matriz, que se recogen en la Tabla 3.

EVOLUCIÓN DE LA CONCENTRACIÓN DE LOS ANTIMICROBIANOS
OXITETRACICLINA
La oxitetraciclina muestra un prolongado tiempo medio de residencia (Ziółkowski et al., 2016), que se refleja en un largo periodo de supresión (Tabla 1). La Figura 1a muestra la evolución de la concentración de oxitetraciclina en muestras de músculo y sangre de animales tratados con este antibiótico.
En ambas matrices la concentración de antimicrobiano descendió a lo largo del periodo de supresión siguiendo un ritmo de eliminación exponencial, situación descrita para xenobióticos en animales (Berninger y Brooks, 2010). No se observaron diferencias (P˃0,05) en los tiempos de vida media de ambas matrices (Tabla 3): 3,43 días para músculo y 3,59 días para suero.
Este hecho, junto con una concentración igual de este compuesto en sangre y músculo, hace de la sangre una matriz adecuada para el desarrollo de nuevos métodos de detección de residuos antibióticos in vivo.
LA SANGRE PUEDE SER UNA MATRIZ ADECUADA PARA LA DETECCIÓN DE RESIDUOS DE OXITETRACICLINA IN VIVO
SULFAMETOXIPIRIDAZINA
La sulfametoxipiridazina está catalogada como una sulfonamida de larga acción y tiene largos periodos de supresión en animales de ganadería (Tabla 1). La Figura 1b muestra un ritmo de eliminación similar en músculo y sangre, de 0,55 días (Tabla 3), aunque se describieron diferencias significativas entre las concentraciones descritas en ambas matrices (P<0,05).
En concreto, la concentración descrita en sangre fue 3 veces superior a la descrita en músculo, de forma que, aunque esta matriz sea un buen indicador de lo que está sucediendo en músculo, la adaptación de un test comercial actual requeriría la disminución de su sensibilidad a este compuesto. No obstante, dado que los métodos de cribado pretenden evitar la entrada de residuos antibióticos a la cadena alimentaria, la aparición de falsos positivos no supondría un riesgo sanitario y el análisis confirmatorio ofrecería el resultado real.
LA SANGRE PUEDE SER UNA MATRIZ ADECUADA PARA LA DETECCIÓN DE RESIDUOS DE SULFAMETOXIPIRIDAZINA IN VIVO SI SE DISMINUYE LA SENSIBILIDAD DEL TEST COMERCIAL
ENROFLOXACINA
En este estudio, la enrofloxacina siguió un ritmo de eliminación exponencial (Figura 1c) distinto en músculo y sangre (Tabla 3).
Mientras que en músculo el tiempo de vida media fue de 0,92 días, en sangre fue de 1,90. Además, la concentración durante los primeros días del periodo de supresión fue mayor en músculo que en sangre, hallazgo ya descrito por otros autores en otros modelos animales (Cars, 1997).
Esta situación obligaría a un incremento en la sensibilidad del test a este compuesto a la hora de adaptarlo.
LA SANGRE PUEDE SER UNA MATRIZ ADECUADA PARA LA DETECCIÓN DE ENROFLOXACINA IN VIVO SI SE AUMENTA LA SENSIBILIDAD DEL TEST COMERCIAL
AMOXICILINA
La Figura 1d muestra la rápida eliminación de este compuesto, que baja a concentraciones cercanas al LMR el primer día del periodo de supresión, escenario ya descrito en otras especies (Delis et al., 2010; Hung et al., 2019). Aunque esta eliminación rápida impide la identificación de un ritmo de eliminación exponencial claro, éste ha sido previamente descrito por otros autores (Hernández et al., 2005).
EVIDENCIAS PAR A EL DESARROLLO DE MÉTODOS DE VIGILANCIA ANTE MORTEM
Todas las sustancias estudiadas en este trabajo siguieron un ritmo de eliminación exponencial, a excepción de la amoxicilina que, por su rápida eliminación, no pudo evaluarse adecuadamente.
La Figura 2 muestra el ritmo de eliminación hallado en músculo (Figura 2a) y sangre (Figura 2b).
La oxitetraciclina y la sulfametoxipiridazina siguieron el mismo ritmo de eliminación, mientras que la enrofloxacina mostró un ritmo de eliminación mayor en músculo que en sangre. Entre estos compuestos, el mayor ritmo de eliminación se describió en sulfametoxipiridazina, seguida por enrofloxacina y oxitetraciclina para ambas matrices (Tabla 1).
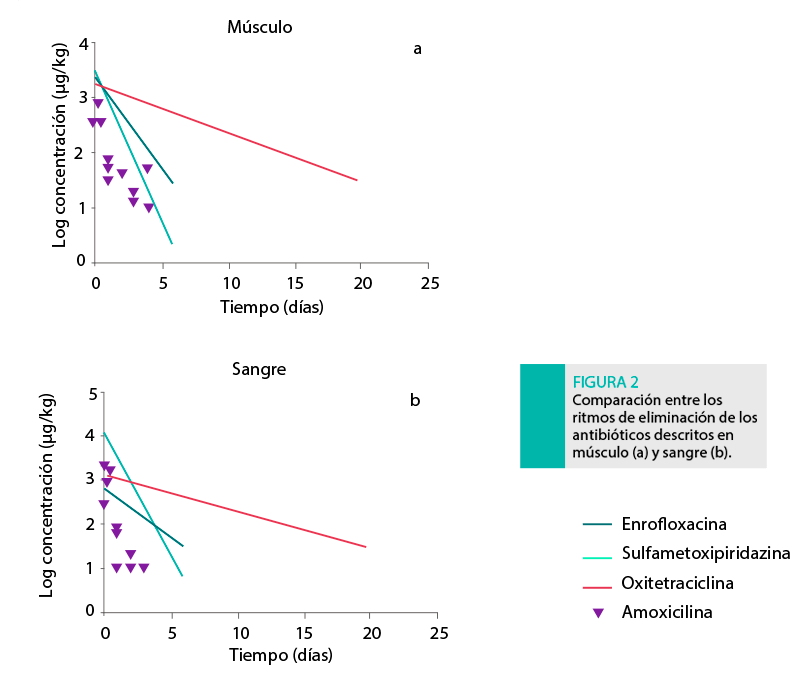
A pesar de que existe un amplio abanico de métodos para la detección de residuos antibióticos en carne, es común que los métodos de cribado estén basados en la inhibición del crecimiento microbiano (Sanz et al., 2011).
En base a los datos expuestos, un nuevo método ante mortem basado en sangre no requeriría ninguna adaptación para la oxitetraciclina, aunque debería estudiarse el efecto que la sangre puede tener sobre el crecimiento en sí mismo. Por su parte, puesto que la concentración de sulfametoxipiridazina en sangre fue 3 veces superior a la detectada en músculo, la sensibilidad del test a la sulfametoxipiridazina debería reducirse, por ejemplo, reduciendo la concentración de trimetropim añadida al medio de crecimiento, puesto que este compuesto se añade de forma común a los tests para incrementar la sensibilidad a sulfonamidas (Suzuki et al, 2012).
El escenario con la enrofloxacina es el contrario: la concentración por encima y próxima al LMR es mayor en músculo que en sangre, de forma que el desarrollo de nuevos test in vivo debería disminuir su límite de detección para incrementar la sensibilidad.
Como la enrofloxacina es un antibiótico que inhibe la replicación del ADN, la sensibilidad se vería incrementada con la reducción de la concentración bacteriana en el test de cribado. A pesar de que los datos extraídos de las muestras pareadas de amoxicilina no permitieron comparar el comportamiento en músculo y sangre, la eliminación de este compuesto es tan rápida que su paso a la cadena alimentaria a través de la carne es improbable y no resultaría un compuesto limitante a la hora de desarrollar nuevos test de cribado de base biológica.
|
CONCLUSIONES Puesto que los test de cribado son una herramienta ampliamente extendida en los planes de vigilancia, su adaptación a animal vivo supondría ventajas, no sólo desde el punto de vista sanitario, sino también económico y medioambiental. Una forma eficiente de encontrar una matriz sustituta de la carne que sea reflejo de su status es a través del estudio de muestras pareadas obtenidas de un mismo animal. Así, tras la creación de un banco de muestras y el estudio del comportamiento de 4 antimicrobianos (oxitetraciclina, sulfametoxipiridazina enrofloxacina y amoxicilina) de distintas familias en músculo y sangre de cerdos tratados, se concluyó que la sangre es una matriz adecuada para el desarrollo de nuevos métodos in vivo para la detección de antibióticos. En este sentido, y en el ámbito del proyecto TESTACOS, actualmente se está procediendo a la validación de dos nuevos test de detección de antibióticos, sulfamidas y quinolonas para animales vivos basados en el uso de la sangre como matriz de diagnóstico. |
El proyecto ha sido cofinanciado al 65% por el Fondo Europeo de Desarrollo Regional (FEDER) a través del Programa Interreg V-A España-Francia-Andorra (POCTEFA 2014-2020).
Más información del proyecto POCTEFA-TESTACOS en www.testacos.com
BIBLIOGRAFÍA
Berninger, J.P.; Brooks, B.W. Leveraging mammalian pharmaceutical toxicology and pharmacology data to predict chronic fish responses to pharmaceuticals. Toxicol.
Lett. 2010, 193, 69–78. Cars, O. Efficacy of beta-lactam antibiotics: Integration of pharmacokinetics and pharmacodynamics. Diagn. Microbiol. Infect. Dis. 1997, 27, 29–33.
Decisión de la Comisión de 12 de agosto de 2002 por la que se aplica la Directiva 96/23/CE del Consejo en cuanto al funcionamiento de los métodos analíticos y la interpretación de los resultados. Diario Oficial de la Unión Europea, L221, 8-36.
Delis, G.A.; Koutsoviti-Papadopoulou, M.; Theodosiadou, E.; Kounenis, G.; Batzias, G.C. Peripheral distribution of amoxicillin in sheep and influence of local inflammation. Vet. J. 2010, 185, 310–316.
Directiva 2001/82/CE del Parlamento Europeo y del Consejo, de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos veterinaries.
Diario Oficial de las Comunidades Europeas, L311, 1-110.
Directiva 96/23/CE del Consejo de 29 de abril de 1996 relativa a las medidas de control aplicables respecto de determinadas sustancias y sus residuos en los animales vivos y sus productos y por la que se derogan las Directivas 85/358/CEE y 86/469/CEE y las Decisiones 89/187/ CEE y 91/664/CEE.
Diario Oficial de las Comunidades Europeas, L125, 10-31. Djekic, I.; Radović, Č.; Lukić, M.; Stanišić, N.; Lilić, S. Environmental life-cycle assessment in production of pork products. Meso 2015, 17. EFSA, European Food Safety Authority (2020).
Report for 2018 on the results from the monitoring of veterinary medicinal product residues and other substances in live animals and animal products. Disponible online: https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/sp.efsa.2020.
EN-1775%20Consultado%20el%2003/02/2020″https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/sp.efsa.2020.
EN-1775 Consultado el 03/02/2020.
EMA, European Medicines Agency (2020). Sales of veterinary antimicrobial agents in 31 European countries in 2018. Trends from 2010 to 2018. Tenth ESVAC report. Disponible online: https://www.ema.europa.eu/en/documents/report/sales-veterinary-antimicrobial-agents-31-european-countries-2018-trends-2010-2018-tenth-esvac-report_en.pdf.%20Consultado%20el%2003/02/2020″ https://www.ema.europa.eu/en/documents/report/sales-veterinary-antimicrobial-agents-31-european-countries-2018-trends-2010-2018-tenth-esvac-report_en.pdf. Consultado el 03/02/2020.
Gaudin, V. Advances in biosensor development for the screening of antibiotic residues in food products of animal origin—A comprehensive review. Biosens. Bioelectron. 2017, 90, 363–377.
Hernández, E.; Rey, R.; Puig, M.; Garcia, M.A.; Solans, C.; Bregante, M.A. Pharmacokinetics and residues of a new oral amoxicillin formulation in piglets: A preliminary study. Vet. J. 2005, 170, 237–242.
Hung, Y.W.; Lin, Y.H.; Chan, C.Y.; Wang, W.S.; Chiu, C.F.; Chiu, C.C.; Chiu, H.W.; Tsai, W.H.; Hung, S.W. Pharmacokinetic study of amoxicillin in Japanese eel Anguilla japonica by high performance liquid chromatography with
fluorescence detection. Aquac. Rep. 2019, 13, 100184.
Mitchell, J.M.; Griffiths, M.W.; McEwen, S.A.; McNab, W.B.; Yee, A.J. Antimicrobial drug residues in milk and
meat: Causes, concerns, prevalence, regulations, tests, and test performance. J. Food Prot. 1998, 61, 742–756.
OMS, Organizción Munsial de la Salud (2017). El enfoque multisectorial de la OMS “Una salud”. Disponible
online: https://www.who.int/features/qa/one-health/es/. Consultado el 04/02/2020 Pikkemaat, M.G. Microbial screening methods for detection of antibiotic residues in slaughter animals. Anal. Bioanal. Chem. 2009, 395, 893–905.
Reglamento (CE) No 1099/2009 del Consejo de 24 de septiembre de 2009 relativo a la protección de los animales en el momento de la matanza.
Diario Oficial de la Unión Europea, 303, 1-30. Reglamento (CEE) No 2377/90 del Consejo de 26 de junio de 1990 por el que se establece un procedimiento comunitario de fijación de los límites máximos de residuos de medicamentos
veterinarios en los alimentos de origen animal.
Diario Oficial de las Comunidades Europeas, L224, 1-8.
Reyes-Herrera, I.; Schneider, M.J.; Cole, K.; Farnell, M.B.; Blore, P.J.; Donoghue, D.J. Concentrations of antibiotic residues vary between different edible muscle tissues in poultry. Research note. J. Food Prot. 2005,
68, 2217–2219.
Riviere, J.E. 2. Absorption, distribution, metabolism, and elimination. In Veterinary Pharmacology and Therapeutics, 9th ed.; Riviere, J.E. & Papich, M.G., Eds.; Willey Blackwell: Ames, IA, USA, 2009; 11-46.
Sanz, D.; Mata, L.; Condón, S.; Sanz, M.Á.; Razquin, P. Performance of a new microbial test for quinolone residues in muscle. Food Anal. Methods 2011, 4, 212–220. Suzuki, S.; Hoa, P.T.P. Distribution of quinolones, sulfonamides, tetracyclines in aquatic environment and antibiotic resistance in Indochina. Front. Microbiol. 2012, 3, 67. Vaden, S.L.; Riviere, J.E. Chapter 4
[/registrados]
