Influencia del peso corporal sobre la expresión génica intestinal de los lechones
Para leer más contenidos de Revista porciSapiens Abril 2023
Para leer más contenidos de Revista porciSapiens Abril 2023
| En las actuales condiciones de producción con cerdas hiperprolíficas, los lechones recién nacidos y lactantes de bajo peso corporal tienen desventajas fisiológicas en comparación con sus compañeros de camada de peso medio. Para comprender mejor el impacto que tiene el peso corporal en los lechones, el presente estudio evaluó el grado de debilidad fisiológica de los lechones más pequeños al nacimiento y durante el periodo de lactación (20 días) en comparación con sus compañeros de camada de peso medio a través de su expresión génica yeyunal.
Los lechones recién nacidos de bajo peso recién presentaron una reducción en la expresión de genes relacionados con la inmunidad, la actividad antioxidante y la actividad digestiva, pero también una tendencia a una mayor expresión de otros genes relacionados con la inflamación y la respuesta al estrés. Al final del periodo de lactación, estas diferencias en la expresión de los genes desaparecieron, apareciendo otras. Los lechones de peso ligero mostraron una menor expresión de genes implicados en la función de barrera y en las respuestas a la inflamación y al estrés, en comparación con sus compañeros de camada de peso medio. |
EL RETO DE LA PRODUCCIÓN PORCINA EN LA ERA DE LA CERDA HIPERPROLÍFICA
La intensa selección genética a favor de la hiperprolificidad basada en el rendimiento reproductivo de la cerda (tamaño de la camada; 16-20 lechones nacidos totales) ha conducido a una reducción del peso medio de los lechones al nacimiento, así como a un aumento de la variabilidad de los pesos al nacimiento dentro de la camada (Peltoniemi et al., 2021).

Las variaciones iniciales de peso al nacimiento dentro de una camada revelan que las cerdas de genéticas hiperprolíficas no son capaces de asegurar una nutrición satisfactoria y equitativa de todos sus lechones, lo que resulta en una intensa competencia pre- y postnatal por unos nutrientes limitados y un alto riesgo de mortalidad para los más débiles (Ward et al., 2020).
La mayoría de los lechones con IUGR y bajo peso al nacimiento también suelen padecer efectos negativos a largo plazo en la estructura de sus órganos, en el crecimiento postnatal y en la eficiencia alimentaria (Ji et al., 2017).
IMPACTO DE LA PROGRAMACIÓN FETAL Y EL CRECIMIENTO INTRAUTERINO SOBRE LA EXPRESIÓN GÉNICA INTESTINAL
Durante el periodo de gestación se produce una programación fetal que conlleva cambios en la transcripción de los genes, lo que resulta en una alteración de determinadas vías metabólicas y procesos de control homeostático (Burdge et al., 2007).
DEFICIENCIAS EN LA NUTRICIÓN MATERNA DURANTE LA GESTACIÓN PUEDEN RESULTAR EN ALTERACIONES PERMANENTES EN LA PROGRAMACIÓN FETAL (Kwon y Kim, 2017)
|
MATERIALES & MÉTODOS
ANIMALES & ALOJAMIENTO
![]()
A los 113 días postcubrición (±1,27 días) se registraron[registrados] las características de 80 camadas (1.542 lechones nacidos en total) de 80 cerdas hiperprolíficas y se realizó un seguimiento de las cerdas y sus camadas hasta el destete (21,6 ± 1,27 días).
Las cerdas recibieron 2,4 kg de pienso/día desde el destete hasta los 35 días de gestación y 2,1 kg de pienso/día desde los 35 días de gestación hasta los 110 días de gestación.
El procesamiento de los lechones se realizó dentro de las 48 h posteriores al nacimiento y se realizaron adopciones cruzadas para estandarizar el tamaño de la camada a 15 lechones/camada.
DIETA EXPERIMENTAL & MEDICIONES
![]()
El peso corporal de las cerdas se registró a los 35 y 110 días de gestación y al destete. Además, durante este periodo, se registró diariamente la ingesta individual de pienso a través de estaciones de alimentación electrónica, mientras que durante la lactación la ingesta se registró manualmente ponderando diariamente la diferencia entre el pienso ofrecido y su desaparición.
Las dietas se formularon para cubrir las necesidades nutricionales (NRC, 2012).
| DIETA DE GESTACIÓN La composición de la dieta de gestación se basó en trigo (35%), cebada (23,5%), salvado de trigo (20%), torta de girasol (10%), maíz (7,70%) y lisina 50 (0,44%). El resto de ingredientes, aminoácidos y macro y microminerales representaron el 3,36% de la composición total. El contenido en nutrientes de la dieta de gestación fue de 2.260 kcal/kg de energía neta, 13,0% de proteína bruta y 0,67% de lisina. |
DIETA DE LACTACIÓN La dieta de lactación incluyó como ingredientes principales trigo (37%), maíz (30%), harina de soja (11,5%), torta de girasol (7%), lisina 50 (0,92%) y otros ingredientes (13,58%). Los valores de energía neta de la dieta de lactación fueron de 2.450 kcal/kg, 15,5% de proteína bruta y 1,08% de lisina. |
MUESTREO
![]()
Del total de 80 cerdas alojadas inicialmente, se eligió un subconjunto de 10 cerdas multíparas (3ª a 5ª paridad) para el muestreo. Se seleccionaron dos lechones de cada camada para tomar muestras de yeyuno durante el parto (antes de la toma de calostro) y durante la lactación (20 días).
El criterio de selección fue el peso corporal de los lechones, clasificado en dos niveles:
Las muestras para el análisis de expresión génica se tomaron según lo descrito en Villagómez-Estrada et al. (2021), obteniéndose a nivel del punto medio del yeyuno con un tamaño aproximado de 1,5 cm, enjuagándose en solución de PBS, congelándose posteriormente en 1 ml de RNAlater (Deltalab, Barcelona, España) y almacenándose a -80 °C hasta su procesamiento.

ANÁLISIS DE EXPRESIÓN GÉNICA
![]()
Se analizó la expresión de 56 genes en el tejido yeyunal, todos ellos implicados en múltiples funciones fisiológicas estrechamente relacionadas con la salud intestinal y seleccionados a partir de la bibliografía y agrupados según su función principal de la siguiente manera:
1 GENES QUE INTERVIENEN EN FUNCIONES DE BARRERA
|
2 GENES IMPLICADOS EN RESPUESTAS INMUNITARIAS E INFLAMATORIAS (receptores de reconocimiento de patrones, citoquinas, quimioquinas y proteínas de estrés):
|

|
4 GENES DE ENZIMAS DIGESTIVAS Y HORMONAS QUE INTERVIENEN EN LOS PROCESOS DE DIGESTIÓN Y METABOLISMO
|
5 GENES CODIFICANTES DE TRANSPORTADORES DE NUTRIENTES
|
6 GENES DE RESPUESTA AL ESTRÉS
|
Para calcular los valores relativos de los datos genéticos se utilizaron cuatro genes de control:
|
El análisis de la expresión génica del ARN se realizó según la metodología descrita en Villagómez-Estrada et al., (2021).

RESULTADOS
RENDIMIENTO & PESO CORPORAL
![]()
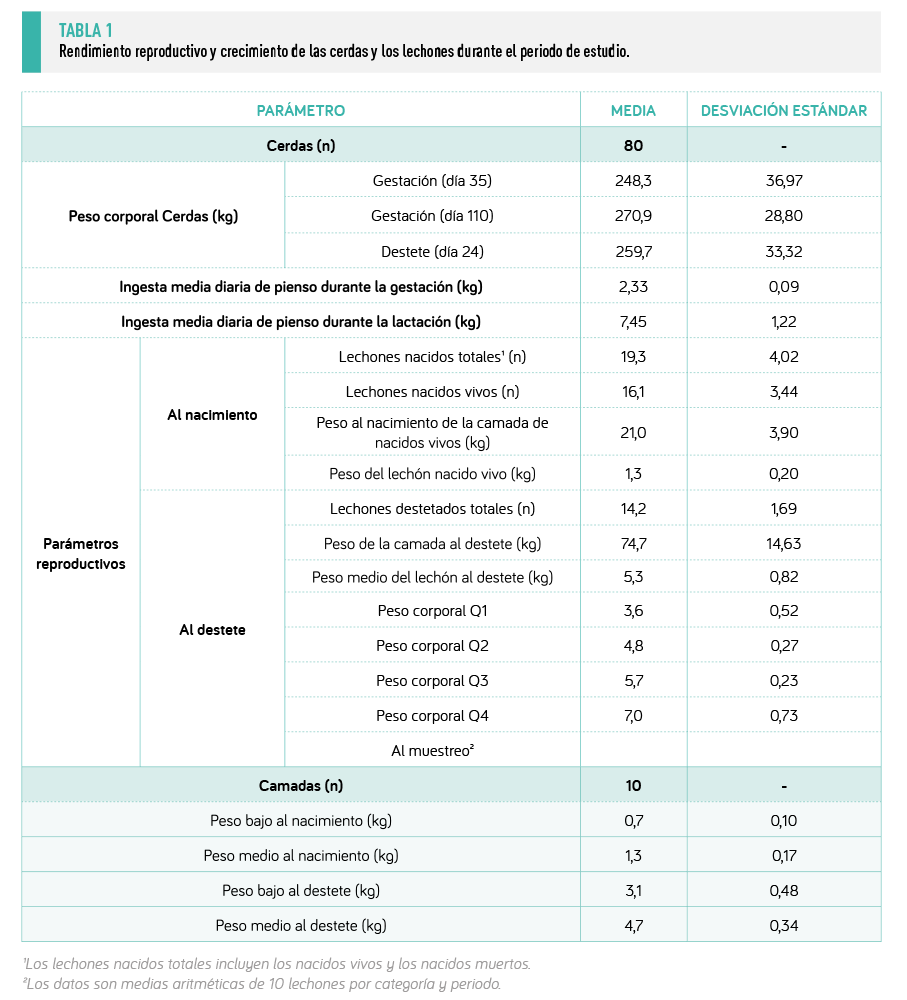
Los resultados del rendimiento de las cerdas y sus camadas se muestran en la Tabla 1.

EXPRESIÓN GÉNICA INTESTINAL
![]()
En la Tabla 2 se muestra el impacto del peso corporal del lechón sobre la expresión intestinal de algunos genes implicados en múltiples funciones fisiológicas.
Al nacimiento, los lechones de bajo peso presentaron una reducción en la expresión de los genes relacionados con la respuesta inmunitaria (FAXDC2, HSPB1, PPARGC1α), así como genes relacionados con enzimas antioxidantes (SOD2m), enzimas digestivas (ANPEP, IDO1, SI) y el transportador de nutrientes (SLC39A4) (P < 0,05).

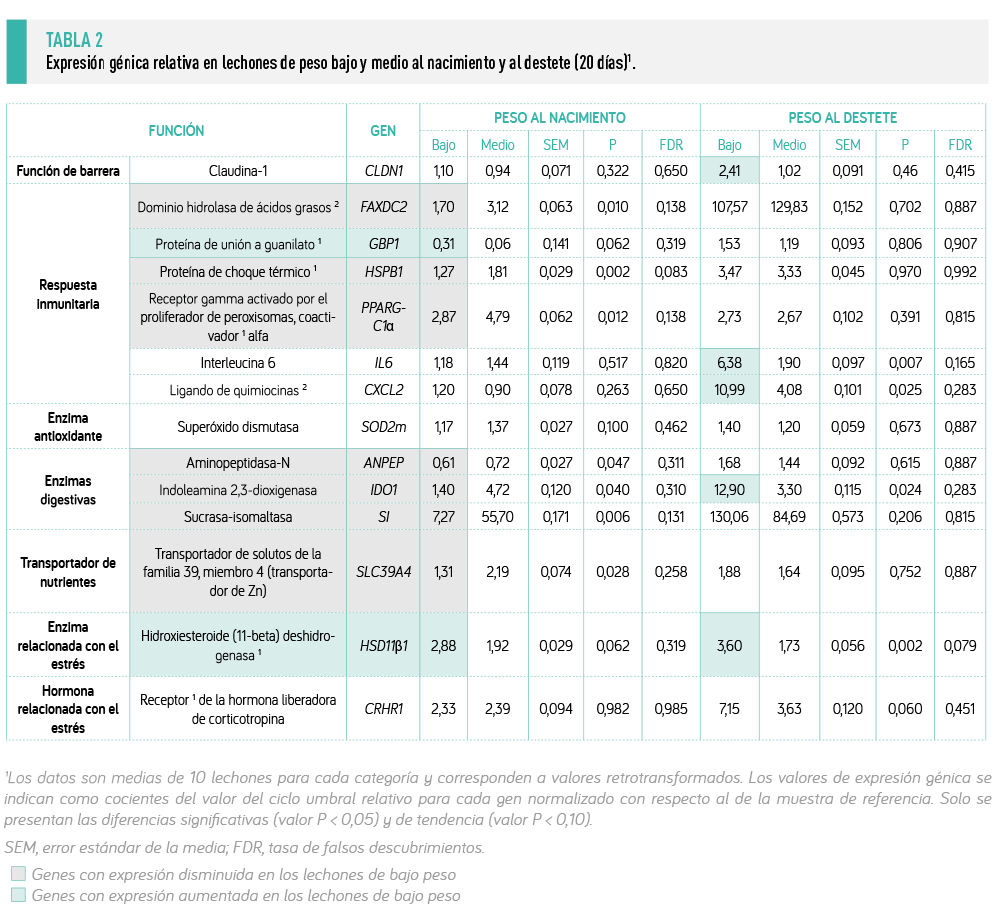
AL DESTETE, LOS LECHONES DE BAJO PESO PRESENTARON UNA MAYOR EXPRESIÓN DE GENES IMPLICADOS EN LA FUNCIÓN DE BARRERA (CLDN1), LA RESPUESTA PROINFLAMATORIA (CXCL2, IL6), LA DIGESTIÓN (IDO1) Y LA SEÑALIZACIÓN DE LA HORMONA DEL ESTRÉS (HSD11β1)

DISCUSIÓN
La mucosa intestinal posee una función compleja, no solo desempeña un papel importante en la barrera epitelial y la digestión de nutrientes, sino que también forma parte de un sistema inmunitario bien organizado (Okumura y Takeda, 2017).
Al igual que el peso corporal, el desarrollo y la funcionalidad del tracto gastrointestinal pueden verse alterados debido a acontecimientos prenatales (Dong et al., 2014; Farmer y Edwards, 2021).

| En el presente estudio, la expresión génica intestinal al nacimiento puso de manifiesto la inmadurez del intestino de los lechones de bajo peso relacionada con una menor activación de genes implicados en la digestión (ANPEP, IDO1, SI), transporte de nutrientes (SLC39A4), inmunidad/ inflamación (FAXDC2, GBP1, HSPB1, PPARGC1α) y función antioxidante (SOD2m), acompañada también de una sobreexpresión del gen de la enzima asociada al estrés HSD11β1. |
Los genes digestivos con bajo nivel de expresión, como ANPEP, IDO1 y SI, participan principalmente en el proceso digestivo final de proteínas, aminoácidos y carbohidratos, pero también pueden tener una acción antiinflamatoria (Trevisi et al., 2012; Xu et al., 2015).
Además, la baja expresión del gen transportador de nutrientes (SLC39A4), considerado como el principal transportador intracelular de Zn (Martin et al., 2013), puede estar implicada en los cambios observados en otros genes fisiológicos que requieren Zn para su correcta expresión (Suttle, 2010).
Teniendo en cuenta que el intestino delgado desempeña un papel esencial, no solo en la digestión y absorción de nutrientes, sino también en la respuesta inmunitaria, esta reducida expresión génica observada en lechones de bajo peso al nacimiento puede comprometer seriamente la función inmunitaria (Michiels et al., 2013; Qi et al., 2019; Li et al., 2021).
CABE DESTACAR LA SOBREEXPRESIÓN DEL GEN HSD11β1 EN LOS LECHONES CON MENOR PESO CORPORAL, TANTO AL NACIMIENTO COMO AL DESTETE
El gen HSD11β1 codifica para la enzima que transforma la cortisona inactiva en cortisol activo, regulando así los niveles tisulares de glucocorticoides y desempeñando un papel fundamental en el metabolismo y la respuesta inflamatoria (Nixon et al., 2012; Huang et al., 2020).
El hecho de que la expresión de este gen se mantuviera elevado hasta el final de la lactación demuestra que el sufrimiento fetal y el estado inflamatorio neonatal no se revierten con la edad, lo que sugiere que este impacto negativo puede durar hasta edades más avanzadas.
Dado que a los lechones recién nacidos no se les permitió consumir calostro, se necesitan más estudios para evaluar la influencia del calostro, fuente primaria de nutrientes e inmunoglobulinas para los lechones, en la mejora de estas funciones fisiológicas de los lechones deterioradas por la sobrepoblación intrauterina.
Exceptuando el gen HSD11β1, todas las diferencias de expresión génica intestinal observadas inicialmente al nacimiento entre lechones de peso bajo y medio desaparecieron al final del periodo de lactación, lo que indica la consolidación de estas funciones a lo largo de la fase de lactación.
| Curiosamente, al final de la lactación, se observó un aumento de la expresión del gen CLDN1 (función de barrera) en los lechones de bajo peso, junto con una sobreexpresión de algunos genes proinflamatorios importantes (IL6 y CXCL2, IDO1) y del receptor de la hormona del estrés (CRHR1, HSD11β1) en comparación con los lechones de mayor peso. |
El aumento de la expresión de CLDN1, un componente estructural y funcional esencial de las uniones estrechas (Günzel y Yu, 2013), podría apuntar hacia una mejora de la regulación de la permeabilidad intestinal.

Por otro lado, el gen IDO1 codifica la enzima indolamina 2,3-dioxigenasa que cataliza la degradación del L-triptófano, pero también actúa como inmunorregulador cuya actividad parece aumentar en circunstancias proinflamatorias (Frumento et al., 2002).
| Tomados estos hallazgos en su conjunto, el retraso del crecimiento postnatal no solo perjudica al rendimiento económico de las explotaciones, sino que también afecta negativamente a varias funciones fisiológicas al aumentar las respuestas proinflamatorias y de estrés. |
Entre los cambios fisiopatológicos asociados a las citoquinas proinflamatorias y las moléculas de estrés cabe destacar la redistribución de nutrientes, como la energía y los aminoácidos, que inicialmente estarían destinados al crecimiento (Huntley et al., 2018).


El deterioro de las funciones fisiológicas de los lechones de bajo peso observado en el presente estudio apoya el argumento de que el suministro insatisfactorio de nutrientes al feto/neonato es un factor importante que influye en su rendimiento fisiológico postnatal (Larriestra et al., 2006; Farmer y Edwards, 2021).
| En conclusión, los lechones de bajo peso al nacimiento y al final de la lactación parecen tener un desarrollo intestinal y una absorción de nutrientes deficientes, así como mayor tendencia a desarrollar respuestas proinflamatorias en comparación con sus compañeros de camada de peso medio. Se necesitan más estudios para determinar las consecuencias a corto y largo plazo de la inmadurez intestinal de los lechones de bajo peso al nacimiento procedentes de camadas grandes, así como sobre su eficiencia alimentaria y su capacidad para hacer frente a los retos posteriores al destete. |
Te puede interesar: Programación fetal – Impacto sobre marcadores epigenéticos de la inmunidad del lechón
BIBLIOGRAFÍA
van Barneveld, R. J., and R. J. E. Hewitt. 2016. Reducing variation in pork production systems through maternal and pre- and post-weaning nutrition strategies. Anim. Prod. Sci. 56:1248. doi:10.1071/AN15396.
Bérard, J., M. Kreuzer, and G. Bee. 2008. Effect of litter size and birth weight on growth, carcass and pork quality, and their relationship to postmortem proteolysis. J. Anim. Sci. 86:2357–2368. doi:10.2527/jas.2008-0893.
Burdge, G. C., M. A. Hanson, J. L. Slater-Jefferies, and K. A. Lillycrop. 2007. Epigenetic regulation of transcription: a mechanism for inducing variations in phenotype (fetal programming) by differences in nutrition during early life? Br. J. Nutr. 97:1036–1046. doi:10.1017/S0007114507682920.
Dong, L., X. Zhong, H. Ahmad, W. Li, Y. Wang, L. Zhang, and T. Wang. 2014. Intrauterine growth restriction impairs small intestinal mucosal immunity in neonatal Piglets. J. Histochem. Cytochem. 62:510–518. doi:10.1369/0022155414532655.
Farmer, C., and S. A. Edwards. 2021. Review: improving the performance of neonatal piglets. Animal 100350. doi:10.1016/j.animal. 2021.100350.
Frumento, G., R. Rotondo, M. Tonetti, G. Damonte, U. Benatti, and G. B. Ferrara. 2002. Tryptophan-derived catabolites are responsible for inhibition of T and natural killer cell proliferation induced by indoleamine 2,3 dioxygenase. J. Exp. Med. 196:459 468. doi:10.1084/jem.20020121.
Günzel, D., and A. S. L. Yu. 2013. Claudins and the modulation of tight junction permeability. Physiol. Rev. 93:525 569. doi:10.1152/physrev.00019.2012.
Huang, P., Y. Li, C. Xu, G. Melino, C. Shao, and Y. Shi. 2020. HSD11B1 is upregulated synergistically by IFNγ and TNFα and mediates TSG-6 expression in human UC-MSCs. Cell Death Discov. 6:24. doi:10.1038/s41420-020-0262-7.
Ji, Y., Z. Wu, Z. Dai, X. Wang, J. Li, B. Wang, and G. Wu. 2017. Fetal and neonatal programming of postnatal growth and feed efficiency in swine. J. Anim. Sci. Biotechnol. 8:1–15. doi:10.1186/s40104- 017-0173-5.
Kraeling, R. R., and S. K. Webel. 2015. Current strategies for reproductive management of gilts and sows in North America. J. Anim. Sci. Biotechnol. 6:3. doi:10.1186/2049-1891-6-3.
Kwon, E. J., and Y. J. Kim. 2017. What is fetal programming?: a lifetime health is under the control of in utero health. Obstet. Gynecol. Sci. 60:506. doi:10.5468/ogs.2017.60.6.506.
Larriestra, A. J., S. Wattanaphansak, E. J. Neumann, J. Bradford, R. B. Morrison, and J. Deen. 2006. Pig characteristics associated with mortality and light exit weight for the nursery phase. Can. Vet. J. 47(6):560–566. PMID: 16808228; PMCID: PMC1461411.
Li, T., S. Huang, L. Lei, S. Tao, Y. Xiong, G. Wu, J. Hu, X. Yuan, S. Zhao, B. Zuo, et al. 2021. Intrauterine growth restriction alters nutrient metabolism in the intestine of porcine offspring. J. Anim. Sci. Biotechnol. 12:15. doi:10.1186/s40104-020-00538-y.
Matheson, S. M., G. A. Walling, and S. A. Edwards. 2018. Genetic selection against intrauterine growth retardation in piglets: a problem at the piglet level with a solution at the sow level. Genet. Sel. Evol. 50:1–11. doi:10.1186/s12711-018-0417-7.
Meddings, J. B., and M. G. Swain. 2000. Environmental stress–induced gastrointestinal permeability is mediated by endogenous glucocorticoids in the rat. Gastroenterology 119:1019–1028. doi:10.1053/gast.2000.18152.
Michiels, J., M. De Vos, J. Missotten, A. Ovyn, S. De Smet, and C. Van Ginneken. 2013. Maturation of digestive function is retarded and plasma antioxidant capacity lowered in fully weaned low birth weight piglets. Br. J. Nutr. 109:65–75. doi:10.1017/S0007114512000670.
Nixon, M., D. J. Wake, D. E. Livingstone, R. H. Stimson, C. L. Esteves, J. R. Seckl, K. E. Chapman, R. Andrew, and B. R. Walker. 2012. Salicylate downregulates 11β-HSD1 expression in adipose tissue in obese mice and in humans, mediating insulin sensitization. Diabetes 61:790–796. doi:10.2337/db11-0931.
Okumura, R., and K. Takeda. 2017. Roles of intestinal epithelial cells in the maintenance of gut homeostasis. Exp. Mol. Med. 49:e338–e338. doi:10.1038/emm.2017.20.
Peltoniemi, O., J. Yun, S. Björkman, and T. Han. 2021. Coping with large litters: the management of neonatal piglets and sow reproduction. J. Anim. Sci. Technol. 63:1–15. doi:10.5187/jast.2021.e3.
Rehfeldt, C., and G. Kuhn. 2006. Consequences of birth weight for postnatal growth performance and carcass quality in pigs as related to myogenesis. J. Anim. Sci. 84:E113–E123. doi:10.2527/2006.8413_supplE113x.
Rodrigues, L. A., M. O. Wellington, J. M. Sands, L. P. Weber, T. D. Olver, D. P. Ferguson, and D. A. Columbus. 2020. Characterization of a swine model of birth weight and neonatal nutrient restriction. Curr. Dev. Nutr. 4(8):nzaa116:1–8. doi:10.1093/cdn/nzaa116.
Smith, F., J. E. Clark, B. L. Overman, C. C. Tozel, J. H. Huang, J. E. F. Rivier, A. T. Blisklager, and A. J. Moeser. 2010. Early weaning stress impairs development of mucosal barrier function in the porcine intestine. Am. J. Physiol. Liver Physiol. 298:G352 G363. doi:10.1152/ajpgi.00081.2009.
Suttle, N. F. 2010. Mineral Nutrition of Livestock, 4th ed. Oxon, United Kingdom.
Trevisi, P., E. Corrent, S. Messori, S. Formica, D. Priori, and P. Bosi. 2012. Supplementary tryptophan downregulates the expression of genes induced by the gut microbiota in healthy weaned pigs susceptible to enterotoxigenic Escherichia coli F4. Livest. Sci. 147:96–103. doi:10.1016/j.livsci.2012.04.008.
Villagómez-Estrada, S., J. F. Pérez, S. van Kuijk, D. Melo-Durán, A. Forouzandeh, F. Gonzalez-Solè, M. D., ’ Angelo, F. J. Pérez Cano, and D. Solà-Oriol. 2021. Strategies of inorganic and organic trace mineral supplementation in gestating hyperprolific sow diets: effects on the offspring performance and fetal programming. J. Anim. Sci. 99:1–14. doi:10.1093/jas/skab178.
Viott, R. C., T. A. Menezes, A. P. G. Mellagi, M. L. Bernardi, I. Wentz, and F. P. Bortolozzo. 2018. Performance of low birth-weight piglets upon protein-energy and/or colostrum supplementation. Arq. Bras. Med. Veterinária e Zootec. 70:1293–1300. doi:10.1590/1678-4162-9798.
Ward, S. A., R. N. Kirkwood, and K. J. Plush. 2020. Are larger litters a concern for piglet survival or an effectively manageable trait? Animals 10:309. doi:10.3390/ani10020309.
Xu, S., D. Wang, P. Zhang, Y. Lin, Z. Fang, L. Che, and D. Wu. 2015. Oral administration of Lactococcus lactis-expressed recombinant porcine epidermal growth factor stimulates the development and promotes the health of small intestines in early weaned piglets. J. Appl. Microbiol. 119:225–235. doi:10.1111/jam.12833.
[/registrados]
