El intestino, el órgano inmunitario más grande del organismo
Para leer más contenidos de Revista porciSapiens Abril 2023
Para leer más contenidos de Revista porciSapiens Abril 2023
| La integridad intestinal es crucial para la salud y el rendimiento de los cerdos dado que, además de las funciones digestivas del tracto gastrointestinal (TGI), las células inmunitarias y las estructuras linfoides presentes en el TGI constituyen el órgano inmunitario más grande del cuerpo. |
LOS PILARES DEL SISTEMA INMUNITARIO INTESTINAL
El sistema inmunitario asociado a la mucosa intestinal se sustenta en cinco pilares:
(Gonçalves et al., 2016)
IMPORTANCIA DE LA INTEGRIDAD DE LA BARRERA INTESTINAL
MUCOSA INTESTINAL
La superficie de la mucosa (Figura 1) está recubierta con un moco formado por mucinas que son secretadas por las células caliciformes, creando una barrera que evita que partículas más grandes, incluyendo la mayoría de las bacterias, entren en contacto directo con la capa de células epiteliales (Turner, 2009).
MUCINAS
![]()
Las mucinas contienen diferentes oligosacáridos, incluyendo las glicoproteínas secretadas y de superficie celular. Las mucinas secretadas (MUC2, MUC5 y MUC6) forman un gel hidratado de 300 a 700 μm de espesor que tiene dos capas:[registrados]
CÉLULAS DE PANETH
![]()
Las células de Paneth, situadas en las criptas del intestino delgado, secretan α-defensina, mientras que las células epiteliales presentes en las criptas intestinales del colon secretan β-defensinas, algunas de forma constitutiva y otras en respuesta a la citoquina proinflamatoria IL-1 (Abbas et al., 2015).
Además, las células de Paneth secretan una lectina de tipo C, la proteína regeneradora de epitelio derivada de islote 3 γ (REGIIIγ), que bloquea la colonización bacteriana en la superficie epitelial.
REGIIIγ Y SU HOMÓLOGA REGIIIα SE UNEN AL PEPTIDOGLICANO DE LAS BACTERIAS GRAM POSITIVAS
La expresión de REGIIIγ requiere señales de los receptores toll-like (TLR) en respuesta a organismos comensales y su producción aumenta tras la colonización y la infección con patógenos (Abbas et al., 2015).
PATRONES MOLECULARES DE RECONOCIMIENTO
La respuesta inmunitaria innata se inicia por mediación de patrones moleculares de reconocimiento asociados a patógenos (PAMP) y receptores celulares de reconocimiento de patrones (PRR).
En los mamíferos, los TLR (un tipo de PRR) desempeñan un papel esencial en el reconocimiento de componentes microbianos y en el desencadenamiento de la respuesta inmunitaria innata. Estos receptores se clasifican en dos subgrupos, dependiendo de su localización celular y especificidad hacia sus respectivos PAMP:
| RECEPTORES TLR-1, TLR-2, TLR-4, TLR-5, TLR-6 Y TLR-10 Se expresan en las superficies celulares y reconocen componentes de la membrana microbiana como lípidos, lipoproteínas y proteínas. |
RECEPTORES TLR-3, TLR-7, TLR-8 Y TLR-9 Se expresan exclusivamente en vesículas intracelulares y reconocen el ADN microbiano. |
(Cario, 2005)
| La alteración de la integridad de la barrera epitelial (Figura 2), caracterizada por un aumento de la permeabilidad intestinal, permite la invasión tisular por parte de bacterias patógenas, así como un aumento de la presencia de antígenos intactos procedentes de la dieta en la mucosa intestinal, lo que conduce a un aumento de la síntesis de citoquinas inflamatorias por parte de las células del sistema inmunitario de la mucosa, pudiendo dar lugar a una respuesta inmunitaria exacerbada y patológica que culmina en un proceso de inflamación intestinal (Gonçalves et al., 2016). |

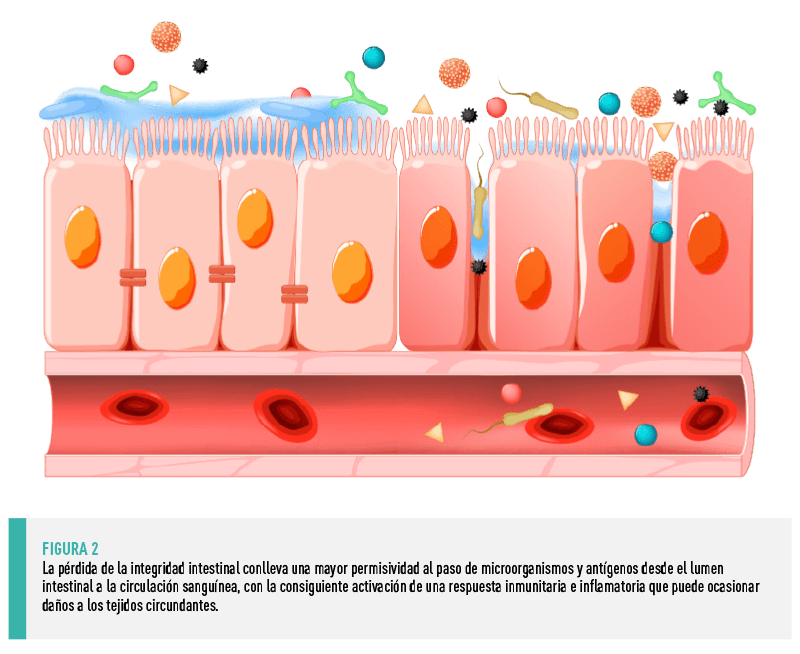

TEJIDO LINFOIDE ASOCIADO A LAS MUCOSAS
En el tracto gastrointestinal, las respuestas inmunitarias adaptativas se inician en conjuntos organizados de linfocitos y células presentadoras de antígenos estrechamente asociados con el revestimiento epitelial de la mucosa del intestino, así como en los ganglios linfáticos mesentéricos (Abbas et al., 2015).
Los tejidos linfoides organizados no encapsulados formados por células del sistema inmunitario que se encuentran asociadas a las superficies mucosas de los tractos respiratorio, gastrointestinal y urogenital se denominan colectivamente como tejido linfoide asociado a las mucosas (MALT, mucosa-asssociated lymphoid tissue).

En el GALT, el tejido linfoide se distribuye a lo largo de estructuras como:
(Vega-López et al., 2012)
Además de estas estructuras, el GALT está también constituido por células presentadoras de antígenos, células dendríticas y macrófagos, áreas de linfocitos T y B con centros germinales en la lámina propia y células Natural Killer (NK) (Cunha, 2013).
PLACAS DE PEYER
Entre las estructuras que componen el GALT destacan las placas de Peyer que se encuentran, principalmente, en el íleon distal estructuradas en forma de folículos linfoides con centros germinales que contienen linfocitos B, linfocitos T colaboradores, células dendríticas y macrófagos. Estos centros germinales están rodeados de linfocitos B inmaduros que producen IgM e IgD.

CÉLULAS M
La principal vía de distribución de antígenos desde el lumen hasta el GALT se produce a través de células especializadas, las células M (microfold), localizadas en la cúpula o epitelio asociado a folículos (FAE) (Abbas et al., 2015).

A pesar de que las células M desempeñan un papel primordial en la respuesta inmunitaria frente a microorganismos luminales, algunos microorganismos patógenos han evolucionado para sortear el mecanismo de acción de las células M, utilizándolas como vía de invasión a través de la barrera mucosa.
| El ejemplo mejor descrito de este fenómeno es el de Salmonella typhimurium. Las células M expresan lectinas que permiten la unión específica de estas bacterias y su posterior fagocitosis, pero, debido a sus propiedades citotóxicas para las células M, conducen a un aumento de la permeabilidad intestinal y favorecen la proliferación de microorganismos (Abbas et al., 2015). |

PROCESAMIENTO Y PRESENTACIÓN DE ANTÍGENOS
Las células dendríticas y los macrófagos son células centinela y procesadoras de antígenos, por lo que el procesamiento del antígeno se suele iniciar de forma simultánea a la eliminación del invasor por parte de las defensas innatas.
Tras la fagocitosis, los microorganismos invasores son procesados intracelularmente y fragmentados en péptidos más pequeños que se unen a moléculas del Complejo Mayor de Histocompatibilidad (CMH).

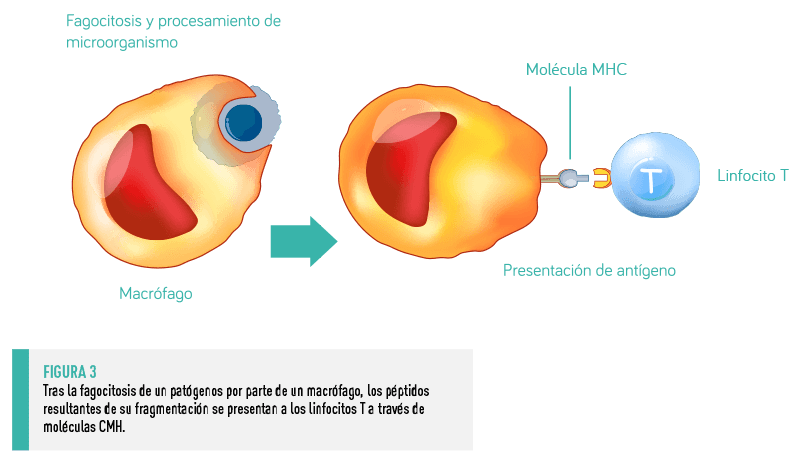
Las prolongaciones citoplasmáticas de algunas células dendríticas se intercalan entre las células epiteliales, lo que les permite captar, procesar y presentar antígenos directamente desde el lumen a los linfocitos intraepiteliales y a los linfocitos T de los folículos linfoides subyacentes.

LINFOCITOS T
Existen linfocitos T (linfocitos T CD4 colaboradores, linfocitos T CD8 citotóxicos y células plasmáticas secretoras de IgA) previamente activados/diferenciados en el GALT o en los ganglios linfáticos de drenaje (Gonçalves et al., 2016).
Además, ciertas poblaciones de linfocitos T se localizan específicamente encima de la lámina propia y la membrana basal del epitelio intestinal, situándose entre las células epiteliales y presentando características diferentes de otros linfocitos T que se encuentran en la región periférica.
Estos linfocitos son heterogéneos, mayoritariamente (80%) de fenotipo CD8, con abundantes gránulos citoplasmáticos que contienen moléculas citotóxicas, y capaces de producir varias citoquinas (IFN-γ, IL-2, IL-4 o IL-17) y de dividirse en poblaciones celulares que expresan en su superficie receptores de antígenos (TCR) formados por cadenas de tipo αβ o γδ (Gonçalves et al., 2016).
LOS LINFOCITOS T INTRAEPITELIALES PREDOMINANTES CORRESPONDEN A CD8αβ +/TCR αβ+, QUE PENETRAN EN EL EPITELIO INTESTINAL GRACIAS A UNA MAYOR EXPRESIÓN DE INTEGRINAS ESPECÍFICAS Y RECEPTORES DE QUIMIOQUINAS TRAS SU ACTIVACIÓN EN ÓRGANOS LINFOIDES SECUNDARIOS (GONÇALVES ET AL., 2016)
Por su parte, los linfocitos T intraepiteliales TCRγδ+ desempeñan funciones primordiales en la mucosa intestinal, entre ellas:



(Gonçalves et al., 2016)
Además de los linfocitos T intraepiteliales, la mucosa intestinal también contiene otras poblaciones de linfocitos T, localizados dentro de los GALT o de forma difusa a lo largo de la lámina propia del intestino.
| Los linfocitos T son esencialmente CD4+ o CD8+ (ambos TCRαβ+), presentando un fenotipo de memoria (CD45RD) y asociándose a la mucosa intestinal a través de la expresión de integrinas específicas (α4β7) y receptores de quimioquinas (CCR9) que dirigen a estos linfocitos tras su activación y diferenciación a células efectoras (Gonçalves et al., 2016). |
 |
A continuación, los linfocitos T efectores abandonan el tejido linfoide a través de los vasos linfáticos eferentes, pasando a la circulación sanguínea sistémica y regresando de nuevo al intestino donde colaborarán en la eliminación de un antígeno determinado (Gonçalves et al., 2016). |

Al regresar al intestino en un proceso denominado homing, los linfocitos T efectores vuelven a exponerse a los antígenos que desencadenaron la respuesta inmunitaria que, a su vez, ya está amplificada y cuenta con una población más diversa de células presentadoras de antígenos, como:

| Tras este nuevo contacto con el antígeno (promovido por las células presentadoras de antígeno), los linfocitos T efectores responden más rápida y vigorosamente, secretando citoquinas como IFN-γ, IL-17, TNF-α, linfotoxina-α o IL-2, dependiendo del perfil del linfocito T efector (Th1 o Th17). |
CADA CITOQUINA TIENE UNA FUNCIÓN ESPECÍFICA EN LA COORDINACIÓN DE LA RESPUESTA INMUNITARIA DESENCADENADA


LINFOCITOS B
Los linfocitos B desempeñan un papel fundamental en la respuesta inmunitaria de las mucosas mediante la producción de anticuerpos.

| Las IgA desempeñan un papel importante en la protección del epitelio de la mucosa frente a patógenos invasores, modulando la composición de la microbiota intestinal y manteniendo la homeostasis frente a antígenos comensales y de origen alimentario (Gonçalves et al., 2016). |
 |
Posteriormente, se estimula a las células dendríticas de fenotipo tolerante de la mucosa para que produzcan IL-10 e induzcan la producción de IgA por parte de los linfocitos B de las placas de Peyer. |

| Este mecanismo de “mostrar” microorganismos comensales a las células del sistema inmunitario en un microambiente regulador (antiinflamatorio) permite mantener la tolerancia a la microbiota intestinal (Gonçalves et al., 2016). |
EL INTESTINO, ADEMÁS DE SER EL ÓRGANO RESPONSABLE DE LOS PROCESOS DE DIGESTIÓN Y ABSORCIÓN DE NUTRIENTES, DESEMPEÑA UN PAPEL PRIMORDIAL EN LA DEFENSA Y LA RESPUESTA INMUNITARIA DEL ORGANISMO DE FORMA QUE EL MANTENIMIENTO DE LA SALUD INTESTINAL SE VE REFLEJADO EN LA SALUD Y EL RENDIMIENTO PRODUCTIVO DE LOS ANIMALES

BIBLIOGRAFÍA
Abbas, A. K.; Lichtman, A. H.; Pillai, S. Imunidadade Regional: Respostas imunes especializadas em tecidos epiteliais e imunoprivilegiados. Imunologia celular e molecular. 8. ed. Rio de Janeiro: Elsevier, 2015.
Gonçalves, J. L.; Yaochhite, J. N. U.; Queiroz, C. A. A.; Câmara, C. C.; Oriá, R. B. Bases do sistema imunológico associado à mucosa intestinal. Em: Sistema digestório: integração básico-clínica. Editora Edgard Blücher Ltda., ISBN 978-85-8039-189-3, p. 369-377, 2016.
Cario, E. Bacterial interactions with cells of the intestinal mucosa: Toll-like receptors and NOD2. Gut, v. 54, n. 8, p. 1182-1193, 2005.
Cunha, J. A. C. Importância do tecido linfóide associado ao intestino na infecção pelo VIH e suas implicações terapêuticas. Dissertação de mestrado, Universidade do Porto, Porto, p. 14, 2013.
Levinson, W. Microbiologia Médica e Imunologia. 13.ed. Porto Alegre: Amgh, 2016.
Mabbott, N. A.; Donaldson, D. S.; Ohno, H.; Williams, I.R.; Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunol., v. 6, n. 4, p. 666-677, 2013. Nature Video. Immunology in the Gut Mucosa. Disponible en: https://www.youtube.com/watch?v=gnZEge78_78. Acceso: 26 de junho de 2019. Publicado em 5 de fev de 2013.
Oliveira, C. M. B.; Sakata, R. K.; Issy, A. M.; Gerola, L. R.; Salomão, R. Citocina e dor. Rev Bras Anestesiol., v. 61, n. 2, p. 255-265, 2011. Rodrigues, F. A. P.; Medeiros, P. H. Q. S.; Prata, M. M.; Lima, A. A. M. Fisiologia da barreira epitelial intestinal. Em: Sistema digestório: integração básico-clínica. Editora Edgard Blücher Ltda., ISBN 978-85-8039-189-3, p. 441-475, 2016.
Sang, Y.; Yang, J.; Ross, C. R.; Rowland, R. R.; Blecha, F. Molecular identification and functional expression of porcine Toll-like receptor (TLR) 3 and TLR7. Vet. Immunol. Immunopathol., v.125, n. 1-2, p.162-167, 2008.
Shimosato T.; Tohno, M.; Kitazawa, H.; Katoh, S.; Watanabe, K.; Kawai, Y., et al. Toll-like receptor 9 is expressed on follicle-associated epithelia containing M cells in swine Peyer’s patches. Immunol. Lett., v. 98, n. 1, p.83-89, 2005.
Shinkai, H.; Muneta, Y.; Suzuki, K.; Eguchi-Ogawa, T.; Awata, T.; Uenishi, H. Porcine Toll-like receptor 1, 6, and 10 genes: complete sequencing of genomic region and expression analysis. Mol. Immunol., v. 43, n. 9, p. 1474 1480, 2006.
Tizard, I.R. Imunologia Veterinária: Uma Introdução. 8. ed. Rio de Janeiro: Elsevier, 2008.
Tohno, M.; Shimosato, T.; Kitazawa, H.; Katoh, S.; Iliev, I. D.; Kimura, T., et al. Toll-like receptor 2 is expressed on the intestinal M cells in swine. Biochem. Biophys. Res. Commun. v. 330, n. 2, p. 547- 554, 2005.
Tuner, J. R. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol., v. 9, n. 11, p. 799-809, 2009.
Uenishi, H.; Shinkai, H. Porcine Toll-like receptors: the front line of pathogen monitoring and possible implications for disease resistance. Dev. Comp. Immunol., v. 33, n.3, p.353-361, 2009.
Vega-López, M. A.; Cole, M. F.; Bellanti, J. A. The Mucosal Immune System in Health and Disease. Em: Immunology IV Clinical Applications in Health and Disease. 4th ed. Bethesda, p. 255-70, 2012.
Zhang, L.; Liu, J.; Bai, J.; Wang, X.; Li, Y.; Jiang, P. Comparative expression of Toll-like receptors and inflammatory cytokines in pigs infected with different virulent porcine reproductive and respiratory syndrome virus isolates. Virol. J., v.10, p. 135, 2013.

Te puede interesar: Desvelan el papel regulador de la Mucina 2 en la Diarrea Epidémica Porcina
[/registrados]
