*3 M Esponja seca; 3 M, Madrid, España
Para leer más contenidos de Revista porciSapiens Abril 2022
Para leer más contenidos de Revista porciSapiens Abril 2022
| La Peste Porcina Africana (PPA) representa actualmente el mayor desafío sanitario para el sector porcino a nivel global. Solo la detección temprana del virus de la PPA (VPPA) y las medidas de bioseguridad adecuadas son eficaces para frenar su expansión. Uno de los riesgos más reconocidos en cuanto a la introducción y difusión del VPPA en un país son los alimentos contaminados, animales infectados (domésticos o silvestres) y los vehículos de transporte de ganado contaminados.
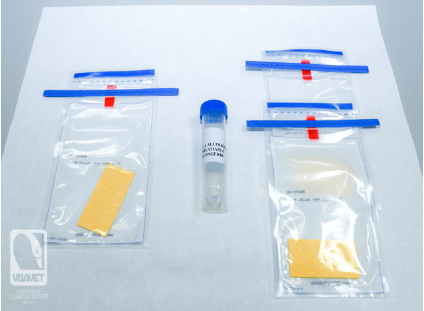
Para mejorar la vigilancia de la PPA, hemos evaluado un nuevo método de muestreo para la detección e inactivación del VPPA mediante el uso de las esponjas (3 M Esponja seca; 3 M, Madrid, España) hidratadas con un nuevo líquido inactivador del virus compuesto por una mezcla de alcoholes (patente n° P2115ES00). |
LA LUCHA GLOBAL CONTRA LA PPA
La PPA es una de las enfermedades porcinas más relevantes por su importancia sanitaria y sus consecuencias socioeconómicas para un número considerable de países1.
![]() En las últimas décadas, la PPA ha demostrado tener una notable capacidad de propagación transfronteriza y transcontinental, con un número creciente de brotes. Actualmente, la enfermedad está presente en cinco continentes y más de 50 países2.
En las últimas décadas, la PPA ha demostrado tener una notable capacidad de propagación transfronteriza y transcontinental, con un número creciente de brotes. Actualmente, la enfermedad está presente en cinco continentes y más de 50 países2.
Los países afectados luchan por controlar y minimizar las pérdidas, mientras que los países que aún están libres de PPA se enfrentan a un mayor riesgo de introducción del patógeno3.
Con el actual proceso de globalización, la introducción del virus en un país se ve facilitada principalmente por los animales infectados y sus productos, que pueden ser transportados a grandes distancias desde países infectados5,6.
![]() Otras fuentes de infección están relacionadas con fómites, como los vehículos de transporte de ganado, los piensos o la ropa y el calzado de los trabajadores de la granja7.
Otras fuentes de infección están relacionadas con fómites, como los vehículos de transporte de ganado, los piensos o la ropa y el calzado de los trabajadores de la granja7.

El papel de los vehículos contaminados se ha evaluado en varios estudios en los que se ha concluido que los camiones que regresan al país de origen, representan el mayor riesgo de introducción de la PPA en la Unión Europea en comparación con otras rutas asociadas al transporte8,9.
| Dado que el nivel de desinfección de los vehículos es un parámetro importante para la evaluación del riesgo de introducción de la PPA, sería aconsejable incluir el muestreo ambiental en los puntos de desinfección para prevenir la posible transmisión del virus entre explotaciones porcinas6. |
APOSTANDO POR LA DETECCIÓN PRECOZ
En la actualidad, la prevención y control de la PPA se basan, principalmente, en el diagnóstico precoz de la enfermedad mediante la detección temprana en el campo y el diagnóstico eficiente en el laboratorio10,11.
En este sentido, un buen programa de vigilancia, la disponibilidad de instalaciones, recursos y la preparación de los servicios veterinarios son factores determinantes para controlar la enfermedad. Las muestras potencialmente contaminadas con el VPPA deben manipularse en los laboratorios de un alto nivel de biocontención (BSL-3). Sin embargo, un virus inactivado podría analizarse en laboratorios básicos (BSL-2).
Nuevos casos de la PPA en República Dominicana revelaron el problema de seguridad de envío de las muestras potencialmente contaminadas con el VPPA.
Sin embargo, enviar una muestra inactivada que permite poder ser efectiva para el diagnóstico virológico por PCR es una solución segura.
![]() Por lo tanto, [registrados]contar con un nuevo método que garantice la inactivación completa del virus, pero que también permita la conservación del material genético viral, sería de gran interés para facilitar y acelerar el diagnóstico, permitiendo el envío seguro de las muestras potencialmente contaminadas con el VPPA y realización de los controles en los puntos críticos, por ejemplo, en la desinfección de vehículos y el transporte de animales.
Por lo tanto, [registrados]contar con un nuevo método que garantice la inactivación completa del virus, pero que también permita la conservación del material genético viral, sería de gran interés para facilitar y acelerar el diagnóstico, permitiendo el envío seguro de las muestras potencialmente contaminadas con el VPPA y realización de los controles en los puntos críticos, por ejemplo, en la desinfección de vehículos y el transporte de animales.
MUESTREO BASADO EN ESPONJAS HIDRATADAS CON LÍQUIDO INACTIVADOR

![]() Este método de muestreo seguro y sencillo podría ser útil para el control de los vehículos de transporte de ganado y la vigilancia eficaz de la PPA en muestras de animales o ambiente.
Este método de muestreo seguro y sencillo podría ser útil para el control de los vehículos de transporte de ganado y la vigilancia eficaz de la PPA en muestras de animales o ambiente.
*3 M Esponja seca; 3 M, Madrid, España
| Con el fin de adoptar medidas eficaces para la rápida identificación y posterior control de la PPA, los objetivos específicos de este trabajo fueron:
|
![]() Se realizaron dos tipos de muestreos independientes para evaluar la capacidad de detección y preservación del material genético del VPPA. Los resultados de las esponjas hidratadas con el líquido inactivador han sido comparados con los resultados de muestreo realizado con un hisopo de algodón convencional.
Se realizaron dos tipos de muestreos independientes para evaluar la capacidad de detección y preservación del material genético del VPPA. Los resultados de las esponjas hidratadas con el líquido inactivador han sido comparados con los resultados de muestreo realizado con un hisopo de algodón convencional.
ENSAYO 1 – DETERMINACIÓN DE LA EFICACIA PARA LA DETECCIÓN DEL GENOMA DEL VPPA
![]()
| Para evaluar la eficacia de las esponjas a la hora de preservar el genoma del VPPA y permitir la detección viral, se realizó un muestreo ambiental en un entorno contaminado por el virus y de piel de los animales. Para realizar el estudio, se infectaron cinco hembras de jabalí (Sus scrofa) con el aislado del VPPA Armenia07 (Arm07) mediante inoculación intramuscular con 10 dosis de hemadsorción al 50% (HAD50). Durante el periodo experimental, las instalaciones fueron desinfectadas tres veces por semana con un desinfectante de amplio espectro y se tomaron muestras de varias superficies utilizando las esponjas hidratadas con el líquido inactivador e hisopos convencionales para comparar la sensibilidad de ambos métodos. |
DISEÑO EXPERIMENTAL
MATERIAL DE MUESTREO
Las esponjas de celulosa libres de biocidas fueron hidratadas con un líquido surfactante isotónico compuesto por solución alcohólica registrada con la patente española n° P2115ES00.
![]() Los alcoholes se utilizan habitualmente con fines de desinfección debido a su amplia actividad contra bacterias, virus y hongos12. Son compuestos con capacidad para disolver las membranas lipídicas y desnaturalizar las proteínas, de modo que el VPPA, al tener envoltura, es vulnerable a ellos13.
Los alcoholes se utilizan habitualmente con fines de desinfección debido a su amplia actividad contra bacterias, virus y hongos12. Son compuestos con capacidad para disolver las membranas lipídicas y desnaturalizar las proteínas, de modo que el VPPA, al tener envoltura, es vulnerable a ellos13.

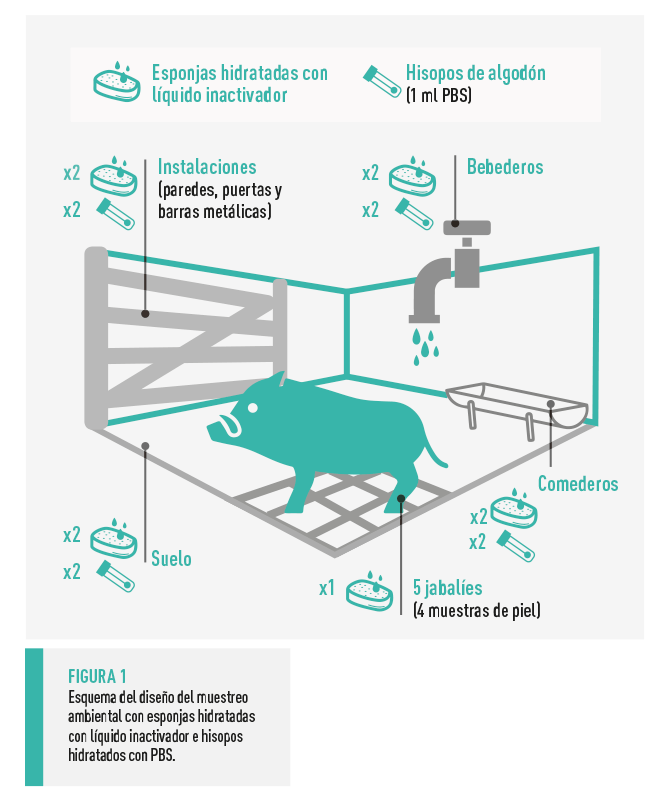
MUESTREO AMBIENTAL

![]() Se emplearon dos esponjas para cada punto de muestreo y una esponja por animal frotando suavemente sobre las regiones de la escápula y el flanco izquierdos.
Se emplearon dos esponjas para cada punto de muestreo y una esponja por animal frotando suavemente sobre las regiones de la escápula y el flanco izquierdos.
Los mismos puntos, a excepción de las pieles de los animales, fueron muestreados previamente con hisopos de algodón hidratados con 1 ml de solución salina tamponada con fosfato (PBS) 1X.
Todas las muestras se procesaron inmediatamente después de su recogida y se almacenaron a – 80°C hasta su posterior utilización.
En el laboratorio, se extrajeron 1,5 ml de líquido de cada esponja, mientras que los hisopos se sumergieron directamente en 800 μl de PBS 1X. Seguidamente, se procedió a la extracción y cuantificación del ADN viral mediante qPCR, confirmándose la presencia del genoma del VPPA en las muestras ambientales positivas mediante ambientales14.
RESULTADOS
HALLAZGOS CLÍNICOS EN EL ENTORNO CONTAMINADO POR EL VPPA
Todos los jabalíes inoculados por vía intramuscular se infectaron con el aislado virulento del VPPA y desarrollaron signos clínicos compatibles con la enfermedad. El virus provocó rápida progresión de la enfermedad. Los animales presentaron fiebre, depresión y anorexia. Uno de ellos tenía disnea y diarrea hemorrágica.
En el momento de la muerte, todos los animales presentaron una importante viremia.
La necropsia reveló hallazgos patológicos compatibles con la PPA y la presencia del virus en los tejidos ha sido confirmada por la prueba de la qPCR.
ESTOS RESULTADOS CONFIRMAN QUE EL ENTORNO ESTABA CONTAMINADO CON EL VIRUS
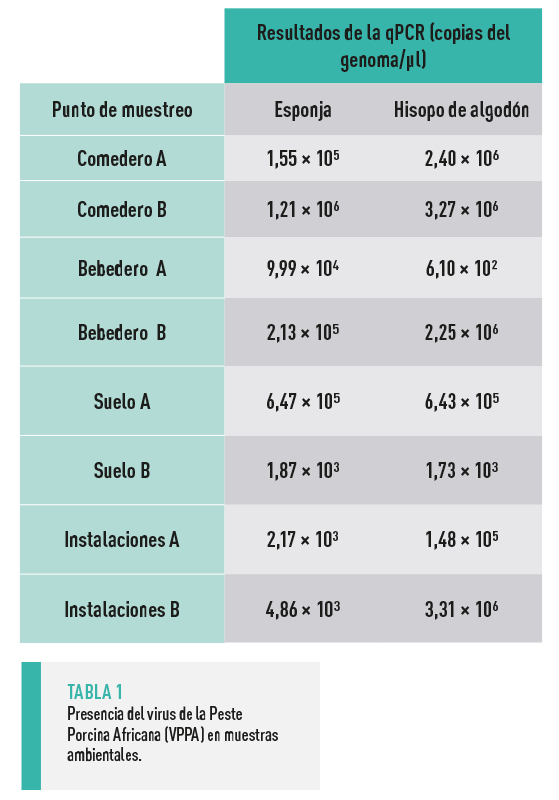
Todas las muestras recogidas de superficies confirmaron la presencia de ADN del VPPA en el ambiente y se obtuvieron resultados similares utilizando ambos métodos de muestreo ambiental (Tabla 1).
![]() No hubo diferencias significativas en la detección del ADN del VPPA cuando se tomaron muestras con esponjas o con hisopos de algodón.
No hubo diferencias significativas en la detección del ADN del VPPA cuando se tomaron muestras con esponjas o con hisopos de algodón.
![]() Las muestras recogidas de superficies en contacto directo con los animales presentaban, en general, un mayor número de copias del genoma del VPPA que las recogidas de superficies a las que los animales no podían acceder directamente a las instalaciones.
Las muestras recogidas de superficies en contacto directo con los animales presentaban, en general, un mayor número de copias del genoma del VPPA que las recogidas de superficies a las que los animales no podían acceder directamente a las instalaciones.
![]() Las muestras recogidas de las pieles de los animales utilizando esponjas contenían una carga menor de ADN del VPPA (1,08 × 103 ± 0,63 × 103 copias/μl) que las superficies ambientales (2,92 × 105 ± 1,5 × 105 copias/μl).
Las muestras recogidas de las pieles de los animales utilizando esponjas contenían una carga menor de ADN del VPPA (1,08 × 103 ± 0,63 × 103 copias/μl) que las superficies ambientales (2,92 × 105 ± 1,5 × 105 copias/μl).
ENSAYO 2 – VALIDACIÓN DE LAS PROPIEDADES INACTIVADORAS DEL LÍQUIDO TENSIOACTIVO (EXPERIMENTO IN VIVO)
![]()
DISEÑO EXPERIMENTAL
INOCULACIÓN DE LOS LECHONES
Diez lechones de 3 meses de vida y 20-25 kg fueron divididos aleatoriamente en cuatro grupos experimentales, tres de ellos inoculados con 1 ml de inóculo, quedando un grupo sin inocular (grupo centinela) (Tabla 2).
El primer grupo de cerdos (Ambiente; n = 2) se inoculó con el pool de muestras ambientales recogidas con esponjas hidratadas con el líquido inactivador de un entorno contaminado por el VPPA.
![]() El inóculo se preparó como un pool de muestras ambientales recogidas con las esponjas hidratadas con el líquido inactivador. Se seleccionaron cuatro muestras ambientales: dos muestras con una baja carga viral (Instalaciones A, Instalaciones B) y otras dos con una alta carga viral (Comedero B, Suelo A). Se tomaron 500 μl de cada muestra, preparándose un total de 2 ml de inóculo (1 ml/animal).
El inóculo se preparó como un pool de muestras ambientales recogidas con las esponjas hidratadas con el líquido inactivador. Se seleccionaron cuatro muestras ambientales: dos muestras con una baja carga viral (Instalaciones A, Instalaciones B) y otras dos con una alta carga viral (Comedero B, Suelo A). Se tomaron 500 μl de cada muestra, preparándose un total de 2 ml de inóculo (1 ml/animal).
El segundo grupo (Armenia07; n = 2) se inoculó con un aislado del genotipo II del VPPA altamente virulento y hemadsorbente, Armenia07, previamente inactivado con el líquido tensioactivo. Para el inóculo se seleccionó una carga viral alta de 105 HAD50.
![]() El efecto letal del modelo de infección por exposición directa con el aislado virulento procedente de animales o ambientes contaminados ha sido ampliamente descrito en cerdo y jabalí.
El efecto letal del modelo de infección por exposición directa con el aislado virulento procedente de animales o ambientes contaminados ha sido ampliamente descrito en cerdo y jabalí.
El tercer grupo (Control; n = 2) se inoculó con el líquido estéril utilizado para hidratar la esponja.
Cuatro cerdos centinela se mantuvieron en contacto y se alojaron en el mismo box que los animales inoculados (Centinela; n = 4).

EXAMEN CLÍNICO Y EUTANASIA
Los signos clínicos se registraron diariamente y se representaron con una puntuación clínica cuantitativa obtenida mediante la suma de los valores de ocho signos clínicos, según lo descrito por Gallardo et al.15,16:
La temperatura corporal se midió antes de cada muestreo y también, a los 3, 6, 10 y 14 días postinoculación (dpi).
MUESTREO Y DETECCIÓN DEL ADN DEL VPPA
Se tomaron muestras de sangre con EDTA y sangre coagulada para la preparación del suero de cada animal el día 0 (antes de la inoculación) y a los 4, 7, 12, 17, 19, 24 y 28 dpi. Posteriormente, las muestras fueron analizadas mediante técnicas de biología molecular como la qPCR.
Asimismo, durante la necropsia de los animales, se recogieron muestras de tejido (ganglios linfáticos, bazo, hígado, pulmón, corazón, riñón y médula ósea) para la detección del VPPA.
| RESULTADOS Todos los animales sobrevivieron hasta el final del experimento (28 dpi).
|

DISCUSIÓN
Los resultados obtenidos en dos estudios independientes confirmaron que el método permite la detección del genoma viral a partir de diferentes superficies con una sensibilidad similar a la de otros métodos comúnmente utilizados. Al mismo tiempo, el líquido tensioactivo utilizado para la hidratación de las esponjas permite realizar una inactivación completa del virus.
Las implicaciones prácticas derivadas de estos resultados son numerosas, ya que el nuevo método de muestreo puede agilizar el diagnóstico precoz de la PPA.
El muestreo ambiental mediante las esponjas hidratadas con el líquido inactivador reveló una carga de VPPA similar a la obtenida con muestras recogidas con un método tradicional, utilizando un hisopo de algodón con PBS.
Dado que la sensibilidad de la prueba se mantiene con el nuevo método de muestreo, esto podría ser indicativo de que:
![]() El ADN del VPPA se conserva bien a pesar de la inactivación viral.
El ADN del VPPA se conserva bien a pesar de la inactivación viral.
![]() Es posible realizar ensayos de biología molecular para detectar el ADN del VPPA obtenido de muestras recogidas con estas esponjas.
Es posible realizar ensayos de biología molecular para detectar el ADN del VPPA obtenido de muestras recogidas con estas esponjas.
|
En este estudio, la piel de los animales contenía una cantidad menor de ADN viral que las demás superficies muestreadas.
![]() Esto podría explicarse por el hecho de que la piel/pelo de los animales es una superficie dinámica en la que las partículas víricas no permanecen mucho tiempo en comparación con otras superficies estáticas.
Esto podría explicarse por el hecho de que la piel/pelo de los animales es una superficie dinámica en la que las partículas víricas no permanecen mucho tiempo en comparación con otras superficies estáticas.
![]() En cambio, las instalaciones, el suelo, los comederos o los bebederos pueden acumular grandes cantidades del genoma vírico durante largos periodos, debido a la estabilidad del virus. No obstante, es necesario conocer mejor la supervivencia del virus en la piel de los animales y en otras superficies ambientales.
En cambio, las instalaciones, el suelo, los comederos o los bebederos pueden acumular grandes cantidades del genoma vírico durante largos periodos, debido a la estabilidad del virus. No obstante, es necesario conocer mejor la supervivencia del virus en la piel de los animales y en otras superficies ambientales.
| No solo se ha demostrado que el presente método de muestreo tiene una sensibilidad suficiente para detectar el ADN viral, sino que también se ha confirmado su capacidad de inactivación del virus.
|
ESTOS RESULTADOS CONFIRMAN QUE EL MÉTODO DE MUESTREO DESCRITO INACTIVA EFICAZMENTE EL VIRUS, PROPORCIONANDO UNA VALIOSA HERRAMIENTA PARA LA FUTURA VIGILANCIA DE LA PPA
Uno de los factores de riesgo más reconocidos de la introducción del VPPA son los vehículos de transporte de ganado contaminados.
![]() Los análisis epidemiológicos previos de los brotes en Estonia (2015-2017) han demostrado que lo más probable es que el virus se haya introducido por una vía de transmisión indirecta. En la mayoría de las explotaciones comerciales, el virus se introdujo principalmente por fómites contaminados (vehículos, personas, herramientas)17.
Los análisis epidemiológicos previos de los brotes en Estonia (2015-2017) han demostrado que lo más probable es que el virus se haya introducido por una vía de transmisión indirecta. En la mayoría de las explotaciones comerciales, el virus se introdujo principalmente por fómites contaminados (vehículos, personas, herramientas)17.
La posible contaminación de los vehículos de ganado puede proceder de las excreciones (heces, orina, secreción oral/nasal) de los animales infectados18. La limpieza y desinfección adecuada es una acción preventiva crucial para evitar la reinfección a partir de fuentes ambientales (SANTE/7113/2015: Enfoque estratégico de la gestión de la peste porcina africana para la UE).
LA IMPLEMENTACIÓN DE ESTA NUEVA METODOLOGÍA DE MUESTREO PODRÍA AYUDAR A EVALUAR LA CONTAMINACIÓN EN PUNTOS CRÍTICOS, CONTRIBUYENDO A LA PREVENCIÓN Y CONTROL DE LA ENFERMEDAD
La reciente introducción de la PPA en países previamente libres de la enfermedad ha confirmado que es necesario mejorar las técnicas de muestreo no invasivas y las pruebas de diagnóstico de las muestras ambientales para optimizar el control de la enfermedad19. Dado que la ausencia del ADN residual del virus de la PPA es una garantía para la seguridad de los animales vivos, la capacidad de las esponjas para la detección del virus en las pieles de los animales podría ser especialmente interesante en el caso de los cerdos transportados.
![]() Esta metodología podría emplearse como una herramienta adicional en el diagnóstico de la PPA, permitiendo la detección temprana de la posible infección por VPPA en los animales transportados y mejorando en gran medida el bienestar animal. Sin embargo, estas propiedades necesitarían más estudios de validación.
Esta metodología podría emplearse como una herramienta adicional en el diagnóstico de la PPA, permitiendo la detección temprana de la posible infección por VPPA en los animales transportados y mejorando en gran medida el bienestar animal. Sin embargo, estas propiedades necesitarían más estudios de validación.
Es la primera vez que se confirman las propiedades inactivadoras del líquido tensioactivo frente al VPPA, a pesar de mantenerse el genoma vírico. Si el virus es inactivado en la muestra original, el procesamiento puede acelerarse significativamente, facilitando el envío de las muestras potencialmente contaminadas con el VPPA en los países con niveles de bioseguridad más bajos.

La aplicación de esta nueva metodología de muestreo puede ayudar a aumentar la capacidad de diagnóstico en los principales puntos de riesgo, contribuyendo así a la prevención y el control de la enfermedad.
Es una herramienta muy valiosa para monitorizar la presencia del virus en las granjas de traspatio donde los animales viven en semi-libertad.
| En conclusión, se trata de un método eficaz para recuperar sistemáticamente muestras genómicas VPPA en diferentes superficies, lo que tiene una gran importancia práctica para evaluar la eficacia de la desinfección de vehículos que transportan animales vivos o productos con riesgo de contaminación. Este método proporciona una base importante para la validación y las pruebas de detección temprana del VPPA que pueden evaluarse sin los requisitos de bioseguridad de un laboratorio de nivel 3 (BSL-3), al menos en los países afectados por la PPA. |
Artículo traducido y adaptado de: Kosowska, A., Barasona, J., Barroso-Arévalo, S., Rivera, B., Domínguez, L., & Sánchez-Vizcaíno, J. (2021). A new method for sampling African swine fever virus genome and its inactivation in environmental samples. Scientific Reports, 11(1). doi: 10.1038/s41598-021-00552-8. (CC BY 4.0).
BIBLIOGRAFÍA
1. Arias, M., Jurado, C., Gallardo, C., Fernández-Pinero, J. & Sánchez-Vizcaíno, J. M. Gaps in African swine fever: Analysis and priorities. Transbound. Emerg. Dis. 65, 235–247 (2018).
2. OIE. 2020 WAHID Database. https:// www. oie. int/wahis_2/ public/ wahid. php/ Diseaseinformation/Diseasedistributionmap. Accessed 18/01/2020.
3. OIE. 2020. https:// oiebu lletin. com/? page_ id= 150. Accessed 09/10/2020.
4. Dixon, L. K., Escribano, J. M., Martins, C., Rock, D. L., Salas, M. L., & Wilkinson, P. J. (2005). Asfarviridae. Virus Taxonomy, Eighth Report of the ICTV, 135–143.
5. Bosch, J. et al. Update on the risk of introduction of African swine fever by wild boar into disease-free european union countries. Transbound. Emerg. Dis. 64, 1424–1432 (2017).
6. Beltrán-Alcrudo, D., Arias, M., Gallardo, C., Kramer, S. & Penrith, M. L. African swine fever: detection and diagnosis—A manual for veterinarians. FAO Animal Production and Health Manual. (2017).
7. Sánchez-Vizcaíno, J. M., Mur, L., Gomez-Villamandos, J. C. & Carrasco, L. An update on the epidemiology and pathology of African swine fever. J. Comp. Pathol. 152, 9–21 (2015).
8. Bellini, S., Rutili, D. & Guberti, V. Preventive measures aimed at minimizing the risk of African swine fever virus spread in pig farming systems. Acta Vet. Scand. 58, 1–10 (2016).
9. Mur, L., Martínez-López, B. & Manuel Sánchez-Vizcaíno, J. Risk of African swine fever introduction into the European Union through transport-associated routes: returning trucks and waste from international ships and planes. (2012).
10. Gallardo, M. C. et al. African swine fever: A global view of the current challenge. Porc. Heal. Manag. 1, 1–14 (2015).
11. Costard, S. et al. African swine fever: How can global spread be prevented?. Philos. Trans. R. Soc. B Biol. Sci. 364, 2683–2696 (2009).
12. Singh, D., Joshi, K., Samuel, A., Patra, J. & Mahindroo, N. Alcohol-based hand sanitizers as first line of defense against SARS CoV-2: A review of biology, chemistry and formulations. Epidemiol. Infect. (2020).
13. Juszkiewicz, M., Walczak, M., Mazur-Panasiuk, N. & Woźniakowski, G. Effectiveness of chemical compounds used against African swine fever virus in commercial available disinfectants. Pathogens 9, 1–10 (2020).
14. Quembo, C. J., Jori, F., Vosloo, W. & Heath, L. Genetic characterization of African swine fever virus isolates from soft ticks at the wildlife/domestic interface in Mozambique and identification of a novel genotype. Transbound. Emerg. Dis. 65, 420–431 (2018).
15. Gallardo, C. et al. Assessment of African swine fever diagnostic techniques as a response to the epidemic outbreaks in eastern european union countries: How to improve surveillance and control programs. J. Clin. Microbiol. 53, 2555–2565 (2015).
16. Gallardo, C. et al. Experimental transmission of African swine fever (ASF) low virulent isolate NH/P68 by surviving pigs. Transbound. Emerg. Dis. 62, 612–622 (2015).
17. Nurmoja, I. et al. Epidemiological analysis of the 2015–2017 African swine fever outbreaks in Estonia. (2018).
18. Davies, K. et al. Survival of African swine fever virus in excretions from pigs experimentally infected with the Georgia 2007/1 Isolate. Transbound. Emerg. Dis. 64, 425–431 (2017).
[/registrados]
