Nuevas perspectivas sobre la Enfermedad de los Edemas en cerdos
Para leer más contenidos de Revista porciSapiens Abril 2024
Para leer más contenidos de Revista porciSapiens Abril 2024
| La salud intestinal es crucial para mantener la salud y el alto rendimiento de la producción porcina moderna1. En este sentido, la protección adecuada frente a los patógenos intestinales y el tratamiento oportuno de las infecciones correspondientes favorecen la digestión y la absorción de los nutrientes ingeridos, lo que beneficia el crecimiento de los cerdos durante todas sus fases productivas2. |
UN ACERCAMIENTO AL AGENTE ETIOLÓGICO DE LA ENFERMEDAD DE LOS EDEMAS
Escherichia coli (E. coli) es uno de los patógenos intestinales más importantes del ganado porcino.
Se ha sugerido que, principalmente, E. coli enterotoxigénica (ETEC) es una causa muy importante de diarrea postdestete (DPD) en lechones, responsable del 50% de las muertes anuales en todo el mundo3.
Los principales patotipos de E. coli son4:
| Algunas cepas específicas de ETEC causantes de DPD poseen genes adicionales que codifican la toxina Shiga 2e (Stx2e) o verotoxina 2e (VT2e), lo que les permite inducir la enfermedad de los edemas5. |  |
Estas cepas se denominan E. coli productoras de toxina Shiga (STEC) o E. coli productoras de verotoxina (VTEC), designándose como E. coli de la enfermedad de los edemas (EDEC)6. Adicionalmente, estas cepas poseen fimbrias F18 o F4 (K88)7. |
La Enfermedad de los Edemas se diagnostica en granjas porcinas de todo el mundo y suele ocurrir durante el periodo de crecimiento de los lechones7, observándose con mayor frecuencia durante las 2 primeras semanas tras el destete8 debido, principalmente, a la reducción de los anticuerpos maternales durante la transición (disminución de la protección pasiva lactogénica).
Las alteraciones del microbioma y los cambios en la estructura intestinal probablemente aumentan la susceptibilidad de los lechones destetados a las infecciones intestinales y a la Enfermedad de los Edemas. Sin embargo, cabe destacar que esta patología también puede observarse en cerdos jóvenes en fase de engorde7.

PATOGÉNESIS DE LA ENFERMEDAD DE LOS EDEMAS[registrados]
| 1. COLONIZACIÓN La patogénesis de la enfermedad se inicia con la multiplicación de las bacterias en el tracto digestivo del lechón tras la ingestión oral y la colonización de la mucosa del intestino delgado a través de las fimbrias F18 (raramente F4) que se adhieren al glicocálix de los enterocitos porcinos mediante una interacción adhesina-receptor específica9-12. |
2. PRODUCCIÓN DE TOXINAS Seguidamente, la VT2e producida por las cepas EDEC pasa al torrente sanguíneo induciendo una microangiopatía en las paredes de los vasos sanguíneos, lo que permite la salida de fluidos (la presión sanguínea venosa aumenta hasta 20 mmHg), provocando edemas en distintos órganos.
|
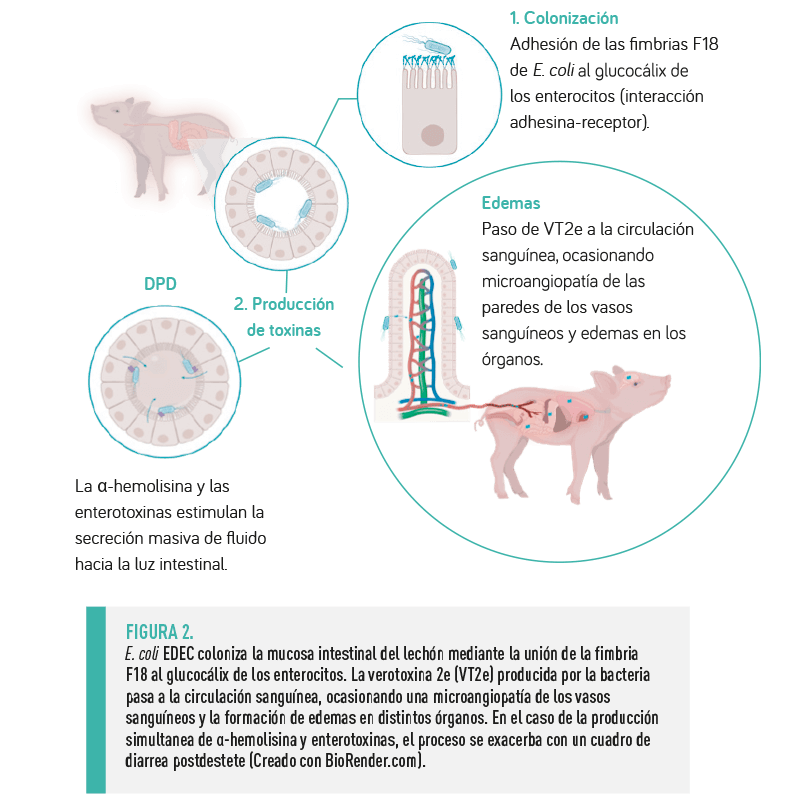

| Las alteraciones de la barrera intestinal están relacionadas con la producción acelerada de enterocitos que, al ser inmaduros, tienen una función exudativa más que absorbente y permiten un mayor paso a través de la barrera celular de toxinas bacterianas como la VT2e en el caso de la Enfermedad de los Edemas19. |

CUADRO CLÍNICO Y DIAGNÓSTICOS DE LA ENFERMEDAD DE LOS EDEMAS
SIGNOS CLÍNICOS
![]()
Los signos clínicos agudos de la Enfermedad de los Edemas incluyen:
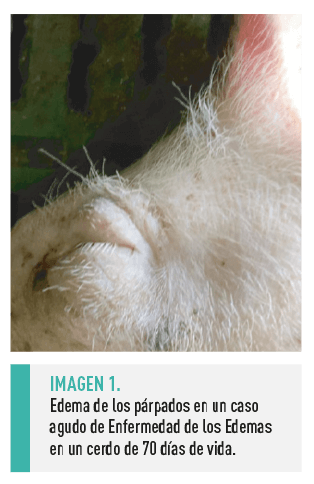
El curso de la enfermedad en condiciones de campo varía de 4 a 14 días, siendo frecuencia su recurrencia en la misma explotación:
Cabe destacar las importantes pérdidas económicas ocasionadas por la Enfermedad de los Edemas.
LA ELEVADA LETALIDAD (50-90% EN LOS CASOS AGUDOS)10 Y LOS COSTES DE LOS ANTIMICROBIANOS UTILIZADOS PARA LA METAFILAXIS DE LA ENFERMEDAD AUMENTAN SUS REPERCUSIONES ECONÓMICAS
HALLAZGOS DE NECROPSIA E HISTOPATOLÓGICOS
![]()
Los hallazgos de necropsia incluyen:
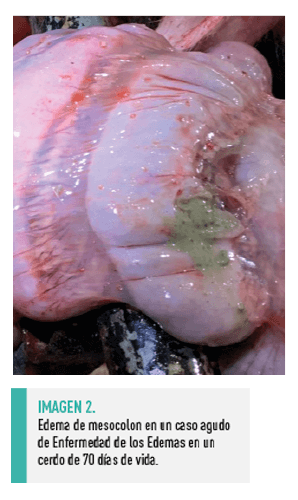
| La angiopatía degenerativa que afecta a pequeñas arterias y arteriolas, junto con edema asociado de los tejidos circundantes, son los hallazgos microscópicos predominantes en los casos de la Enfermedad de los Edemas7. |

DIAGNÓSTICO
![]()
El diagnóstico de la Enfermedad de los Edemas se basa en:

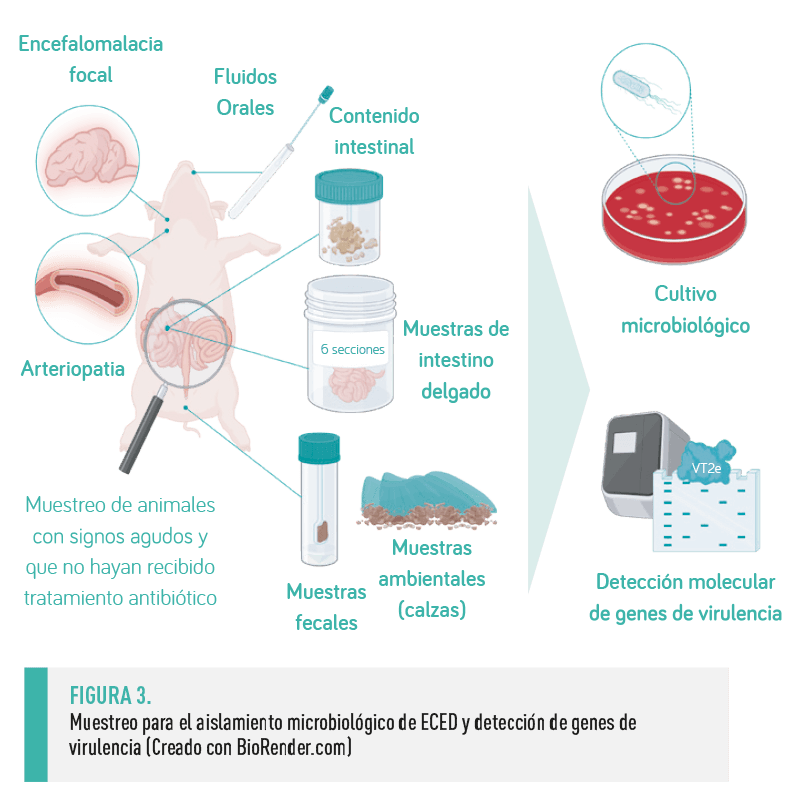
UN MUESTREO ADECUADO ES FUNDAMENTAL PARA UN DIAGNÓSTICO PRECISO
Para el diagnóstico de la Enfermedad de los Edemas, el envío de aproximadamente 6 secciones de intestino delgado es significativo, ya que las cepas EDEC no son sistémicas, sino que se distribuyen de forma desigual en el intestino7.
Las muestras fecales (por ejemplo, hisopos) y el contenido luminal del intestino delgado distal (por ejemplo, después de la eutanasia) también son matrices de diagnóstico significativas. Además, las muestras ambientales del suelo obtenidas con calzas también se pueden utilizar para el aislamiento bacteriano, mientras que los fluidos orales también sirven para la detección de VT2e por PCR8.
| Se recomienda remitir muestras de animales infectados de forma aguda que no hayan recibido terapia antimicrobiana. |
En cuanto a la forma subaguda o crónica, la identificación de lesiones específicas es crítica, especialmente la arteriopatía subaguda a crónica y posiblemente las lesiones de encefalomalacia focal7.
TRATAMIENTO Y PREVENCIÓN DE LA ENFERMEDAD DE LOS EDEMAS
El tratamiento de la Enfermedad de los Edemas se basa en la retirada inmediata del pienso para reducir la colonización bacteriana, junto con medicación en el pienso o en el agua seleccionada en función de las pruebas de sensibilidad de las cepas de EDEC aisladas.
| El manejo adecuado y las intervenciones de bioseguridad, así como la vacunación de los animales con vacunas toxoides producidas en base a la toxina VT2e modificada a los 4 días de vida parecen ser el núcleo de un programa de prevención de la Enfermedad de los Edemas en las explotaciones porcinas. |
Entre las prácticas de manejo que deben mejorarse se incluyen7,8:






Un extenso metaanálisis reciente (12 estudios que contenían 31 ensayos) realizado por Lee et al.20 destacó los principales hallazgos de los estudios con el uso de vacuna toxoide, antisuero, vacuna de ADN basada en plásmidos o vacuna toxoide recombinante frente a la Enfermedad de los Edemas.
|
 |
Las vías de administración de las vacunas mencionadas fueron oral o subcutánea (2 estudios en total) o, predominantemente, intramuscular. |
Los análisis mostraron que los cerdos vacunados presentaban un GMD significativamente mayor y tenían menos probabilidades de morir por la Enfermedad de los Edemas que los animales no vacunados. Además, se observó una reducción significativa de los signos clínicos en los cerdos vacunados en comparación con los no vacunados.
La excreción fecal de E. coli no se redujo significativamente en los cerdos vacunados en comparación con los no vacunados. Sin embargo, las observaciones sobre la excreción fecal de EDEC no pudieron confirmarse plenamente debido al número insuficiente de estudios pertinentes.
La comparación entre los diferentes tipos de vacunas demostró que todos los tipos de vacunas habían sido eficaces en la prevención de la Enfermedad de los Edemas, aunque la vacuna de ADN basada en plásmidos demostró ser la más eficaz en la reducción de los signos clínicos y la mortalidad, así como en el aumento de la GMD.
EL DESARROLLO DE UNA VACUNA COMERCIAL FRENTE A LA ENFERMEDAD DE LOS EDEMAS BASADA EN PLÁSMIDOS DE ADN PARECE UN OBJETIVO PROMETEDOR PARA FUTURAS INVESTIGACIONES
PERSPECTIVAS DE FUTURO FRENTE A LA ENFERMEDAD DE LOS EDEMAS
Como hallazgo significativo, cabe destacar el desplazamiento temporal de los casos clínicos de la Enfermedad de los Edemas hacia fases de producción más tardías en las explotaciones porcinas.

En estudios realizados en explotaciones porcinas de EE.UU., se constató que más del 60% de los cerdos experimentaron una infección por EDEC durante el periodo de engorde21,22.
Lo más probable es que la reducción del uso de antimicrobianos en las primeras etapas del engorde, la escasa aplicación de medidas de bioseguridad en esa etapa, junto con infecciones intestinales concurrentes por otros patógenos, favorezcan la colonización del intestino por cepas de EDEC.
Tal y como se ha observado en granjas griegas, unos métodos de desinfección inadecuados aumentan significativamente la posible prevalencia de la Enfermedad de los Edemas (datos no publicados). Además, el papel de los ingredientes de los piensos y de los nuevos productos alternativos a los antibióticos, así como el efecto de los cambios en la microbiota intestinal que se producen al inicio del engorde, podrían afectar a la prevalencia y a la presentación clínica de esta enfermedad, por lo que en futuros estudios se debería seguir evaluando estos factores.
Otra cuestión que requiere más investigación es el alcance de los daños producidos por los casos subclínicos de Enfermedad de los Edemas.

Hallazgos recientes en granjas griegas han demostrado una prevalencia significativa de cepas de EDEC junto con casos de posible aparición de Enfermedad de los edemas subclínica (datos no publicados).
En las condiciones actuales de aumento de casos de resistencia antimicrobiana de E. coli25 y las restricciones de uso de ZnO, es probable que la relevancia de esta forma subclínica “silenciosa” sea mayor de lo esperado, especialmente si se tienen en cuenta los fenómenos de disbiosis intestinal que podrían producirse tras la colonización intestinal por cepas de EDEC.
ES IMPORTANTE AMPLIAR EN EL FUTURO LA INVESTIGACIÓN DE LA PREVALENCIA DE LA ENFERMEDAD DE LOS EDEMAS SUBCLÍNICA Y SUS CARACTERÍSTICAS EN UN MAYOR NÚMERO DE EXPLOTACIONES
| Son esperanzadores los posibles avances en la selección de cerdos con una mayor presencia de loci de resistencia a F18 y F4. Este enfoque parece atractivo para prevenir la Enfermedad de los Edemas, aunque hay que tener cuidado, ya que la selección de cerdos resistentes a F18 y F4 podría conllevar la aparición de otros tipos de fimbrias adhesivas o de nuevas variantes de los tipos conocidos que podrían unirse a receptores aún no identificados7. |
Te puede interesar: Diagnóstico de laboratorio de procesos infecciosos – Toma de muestras y técnicas
BIBLIOGRAFÍA
1. Adewole DI, Kim IH, Nyachoti CM. Gut Health of Pigs: Challenge Models and Response Criteria with a Critical Analysis of the Effectiveness of Selected Feed Additives – A Review. Asian-Australas J Anim Sci. 2016 Jul;29(7):909-24. doi: 10.5713/ajas.15.0795.
2. Szabó C, Kachungwa Lugata J, Ortega ADSV. Gut Health and Influencing Factors in Pigs. Animals (Basel). 2023 Apr 14;13(8):1350. doi: 10.3390/ani13081350.
3. Gresse R., Chaucheyras-Durand F., Fleury M.A., Van de Wiele T., Forano E., Blanquet-Diot S. Gut Microbiota Dysbiosis in Post-weaning Piglets: Understanding the Keys to Health. Trends Microbiol. 2017;25:851–873. doi: 10.1016/j.tim.2017.05.004.
4. Nataro JP, Kaper JB. Diarrheagenic Escherichia coli . Clin Microbiol Rev (1998) 11:142–201. doi: 10.1128/CMR.11.1.142.
5. Fairbrother JM, Nadeau E, Gyles CL. Escherichia coli in postweaning diarrhea in pigs: an update on bacterial types, pathogenesis, and prevention strategies. Anim Health Res Rev. 2005 Jun;6(1):17-39. doi: 10.1079/ahr2005105.
6. Nagy B and Fekete PZ (1999). Enterotoxigenic Escherichia coli (ETEC) in farm animals. Veterinary Research 130: 259–284.
7. Zimmerman JJ, Karriker LA, Ramirez A, Schwartz KJ, Stevenson GW, Zhang Diseases of swine. 11th ed. Hoboken: Wiley; 2019.
8. Berger PI, Hermanns S, Kerner K, Schmelz F, Schüler V, Ewers C, Bauerfeind R, Doherr MG. Cross sectional study: prevalence of oedema disease Escherichia coli (EDEC) in weaned piglets in Germany at pen and farm levels. Porcine Health Manag. 2023 Oct 26;9(1):49. doi: 10.1186/s40813-023-00343-9.
9. Imberechts H, De Greve H, Lintermans P. The pathogenesis of edema disease in pigs. A review. Vet Microbiol. 1992 Jun 1;31(2-3):221-33. doi: 10.1016/0378-1135(92)90080-d.
10. Casanova NA, Redondo LM, Dailoff GC, Arenas D, Fernández Miyakawa ME. Overview of the role of Shiga toxins in porcine edema disease pathogenesis. Toxicon. 2018;148:149–54
11. Nagy B, Whipp SC, Imberechts H, Bertschinger HU, Dean-Nystrom EA, Casey TA, et al. Biological relationship between F18ab and F18ac fimbriae of enterotoxigenic and verotoxigenic Escherichia coli from weaned pigs with oedema disease or diarrhoea. Microb Pathog. 1997;22(1):1–11.
12. Coddens A, Diswall M, Angström J, Breimer ME, Goddeeris B, Cox E, et al. Recognition of blood group ABH type 1 determinants by the FedF adhesin of F18-fimbriated Escherichia coli. J Biol Chem. 2009;284(15):9713–26.
13. Moxley RA. Edema disease. Vet Clin North Am Food Anim Pract. 2000;16(1):175–85.
14. Müthing J, Meisen I, Zhang W, Bielaszewska M, Mormann M, Bauerfeind R, et al. Promiscuous Shiga toxin 2e and its intimate relationship to Forssman. Glycobiology. 2012;22(6):849–62.
15. Cornick NA, Matise I, Samuel JE, Bosworth BT, Moon HW. Shiga toxin-producing Escherichia coli infection: temporal and quantitative relationships among colonization, toxin production, and systemic disease. J Infect Dis. 2000;181:242–51.
16. Carr J, Chen SP, Connor JF, Kirkwood R, and Segales J. Pig health. 1st ed. Boca Raton, FL: CRC Press (2018). p. 240. doi: 10.4324/9781315157061
17. Barth S, Tscholshiew A, Menge C, Weiss R, Baljer G, Bauerfeind R. Virulence and fitness gene patterns of Shiga toxin-encoding Escherichia coli isolated from pigs with edema disease or diarrhea in Germany. Berl Munch Tierarztl Wochenschr. 2007;120(7–8):307–16.
18. de Lange C.F.M., Pluske J., Gong J., Nyachoti C.M. Strategic use of feed ingredients and feed additives to stimulate gut health and development in young pigs. Livest. Sci. 2010;134:124–134. doi: 10.1016/j.livsci.2010.06.117.
19. Marchetti R, Faeti V, Gallo M, Pindo M, Bochicchio D, Buttazzoni L, Della Casa G. Protein Content in the Diet Influences Growth and Diarrhea in Weaning Piglets. Animals (Basel). 2023 Feb 22;13(5):795. doi: 10.3390/ani13050795.
20. Lee SI, Ntakiyisumba E, Won G. Systematic review and network meta-analysis to compare vaccine effectiveness against porcine edema disease caused by Shiga toxin-producing Escherichia coli. Sci Rep. 2022 Apr 19;12(1):6460. doi: 10.1038/s41598-022-10439-x.
21. Cha W, Fratamico PM, Ruth LE, Bowman AS, Nolting JM, Manning SD, et al. Prevalence and characteristics of Shiga toxin-producing Escherichia coli in finishing pigs: Implications on public health. Int J Food Microbiol. 2018;264:8–15.
22. Tseng M, Fratamico PM, Bagi L, Manzinger D, Funk JA. Shiga toxin-producing E. coli (STEC) in swine: prevalence over the finishing period and characteristics of the STEC isolates. Epidemiol Infect. 2015;143(3):505–14.
23. Kausche FM, Dean EA, Arp LH, Samuel JE, Moon HW. An experimental model for subclinical edema disease (Escherichia coli enterotoxemia) manifest as vascular necrosis in pigs. Am J Vet Res. 1992;53(3):281–7.
24. Leneveu P, Collet J, Sévin J, Durand A, Solignac T, Jardin A, Creac’h P, Amenna N, Turci S, Moalic P, Schüler V. Investigation of subacute edema disease in France. Impact on swine performance. In: Abstract book, 11th European symposium of porcine health management, Utrecht/Netherlands; 2019. p. 201.
25. Rhouma M, Beaudry F, Thériault W, Letellier A. Colistin in pig production: chemistry, mechanism of antibacterial action, microbial resistance emergence, and one health perspectives. Front Microbiol. 2016;7:1789.
[/registrados]
