Seguridad del candidato vacunal LV17/WB/RIE1 frente a la PPA en jabalíes: sobredosis y dosis repetidas
Para leer más contenidos de Revista porciSapiens Julio 2022
Para leer más contenidos de Revista porciSapiens Julio 2022
| La peste porcina africana (PPA) es una enfermedad infecciosa altamente letal que afecta a los cerdos domésticos y a los jabalíes, estando su control dificultado por la falta de un tratamiento o vacuna eficaz. Teniendo en cuenta el importante papel del jabalí en la propagación del virus, la vacunación oral de estos animales sería una esperanza para hacer frente a este problema.
El presente estudio tuvo como objetivo evaluar la seguridad de un candidato vacunal (Lv17/WB/RIE1), con eficacia evaluada previamente, en términos de sobredosis (dosis alta) y dosis repetidas (revacunación) en jabalíes. Teniendo en cuenta los resultados y la situación epidemiológica actual de la PPA en los jabalíes, este prototipo de vacuna es una herramienta prometedora para el control de la enfermedad en estas poblaciones silvestres, aunque se necesitan más estudios. |
LA AMENAZA DE LA PESTE PORCINA AFRICANA
La peste porcina africana (PPA) es una de las enfermedades infecciosas más relevantes que afectan a los suidos, tanto en cerdos domésticos como en jabalíes euroasiáticos (Sus scrofa).
 La enfermedad está causada por un virus de ADN grande y complejo perteneciente a la familia Asfarviridae que evolucionó en el sureste de África en un ciclo selvático entre facóqueros comunes (Phacochoerus africanus) y garrapatas de la familia Argasidae1.
La enfermedad está causada por un virus de ADN grande y complejo perteneciente a la familia Asfarviridae que evolucionó en el sureste de África en un ciclo selvático entre facóqueros comunes (Phacochoerus africanus) y garrapatas de la familia Argasidae1.
El control de la PPA se ve dificultado por la falta de un tratamiento o vacuna eficaz, por lo que las medidas de control se basan en la aplicación de estrictas medidas sanitarias que implican la despoblación de las explotaciones afectadas y medidas preventivas4.
Los países afectados por la PPA luchan por controlar y minimizar las pérdidas, mientras que los países que aún están libres se enfrentan a un mayor riesgo de introducción del patógeno. Estas medidas tienen un gran impacto sanitario y económico, por lo que la PPA es una enfermedad de declaración obligatoria para la Organización Mundial de Sanidad Animal (OMSA).
En Asia, la enfermedad se ha notificado principalmente en cerdos domésticos, con notificaciones esporádicas en jabalíes3,7. Sin embargo, la situación en Europa es la opuesta: el jabalí es el principal hospedador afectado en la mayoría de los países europeos, excepto en Rusia, Ucrania, Rumanía y Serbia2.


Esto complica aún más el control de la enfermedad y las estrictas medidas sanitarias empleadas tradicionalmente para controlar la PPA no son suficientes cuando la enfermedad está extendida en estas poblaciones silvestres9.
EN ESTE CONTEXTO, EXISTE UN ENORME INTERÉS EN EL DESARROLLO DE UNA VACUNA SEGURA Y EFICAZ PARA LOS CERDOS DOMÉSTICOS, ASÍ COMO UNA VACUNA ORAL PARA LOS JABALÍES
| En 2019, se publicaron por primera vez los detalles de un ensayo de vacunación oral realizado con jabalíes frente un aislado de PPA que circula actualmente en Europa10. Los resultados obtenidos fueron muy prometedores en términos de eficacia, ya que lograron un 92% de protección. Sin embargo, este candidato vacunal se basa en un virus naturalmente atenuado, lo que plantea ciertas preocupaciones de seguridad11. Esto significa que, aunque se observó una atenuación prácticamente completa en el estudio anterior, se requieren más estudios con los que evaluar su seguridad.
|
SEGURIDAD DEL CANDIDATO VACUNAL LV17/WB/RIE1 EN JABALÍES
MATERIALES Y MÉTODOS
AISLADOS DE VPPA
![]()
| CANDIDATO VACUNAL El candidato vacunal, una cepa natural atenuada del genotipo II Lv17/WB/Rie1 del VPPA, se cultivó en monocitos de sangre porcina (PBM) durante 7 días. Posteriormente, se recogió el medio de cultivo que contenía el virus extracelular y se centrifugó a baja velocidad para eliminar los restos celulares y luego a alta velocidad para sedimentar el virus12. El título viral se definió como la cantidad de virus que causaba efectos citopáticos en el 50% de los cultivos infectados (TCID50/mL)19. |
VIRUS DE DESAFÍO Se utilizó como virus de desafío el aislado del genotipo II del VPPA Arm07, altamente virulento y con capacidad de hemadsorción. El virus se propagó en PBM como se ha descrito anteriormente12. El título viral se definió como la cantidad de virus que causaba hemadsorción en el 50% de los cultivos infectados (HAD50/mL). |
ANIMALES
![]()
El estudio se realizó [registrados]en las instalaciones de bioseguridad de nivel 3 del Centro de Vigilancia Sanitaria VISAVET con 15 rayones de 3-4 meses de vida procedentes de una explotación comercial de jabalíes de Andalucía.
Estos animales no habían sido vacunados frente a ninguna enfermedad infecciosa antes del estudio y fueron ELISA negativos frente a Virus de Aujeszky, Mycobacterium bovis, virus de la peste porcina clásica (VPPC), VPPA, virus de la enfermedad vesicular porcina (VEVP), Mycoplasma hyopneumoniae, virus del síndrome reproductivo y respiratorio porcino (VPRRS) y circovirus porcino tipo 2 (PCV2).
A su llegada, todos los animales fueron identificados individualmente y colocados aleatoriamente en los grupos de estudio. Durante la fase de aclimatación (2 semanas), los rayones recibieron un tratamiento metafiláctico con oxitetraciclina dihidratada e ivermectina para eliminar los parásitos y controlar cualquier infección bacteriana subyacente.
Los procedimientos de manejo y toma de muestras se llevaron a cabo de acuerdo con la normativa regional, nacional y europea, y el protocolo experimental in vivo fue aprobado previamente por los Comités de Ética de la Universidad Complutense de Madrid y de la Comunidad de Madrid (referencia PROEX 159/19).
El protocolo incluía una descripción detallada de los esfuerzos para prevenir y evitar el sufrimiento innecesario de los animales, incluyendo criterios de valoración humanitaria y directrices relativas a la eutanasia.
 Todos los procedimientos fueron diseñados y llevados a cabo por personal y veterinarios especialmente formados (categorías B, C y D de experimentación animal) siguiendo la Directiva 86/609/CEE de la CE.
Todos los procedimientos fueron diseñados y llevados a cabo por personal y veterinarios especialmente formados (categorías B, C y D de experimentación animal) siguiendo la Directiva 86/609/CEE de la CE.

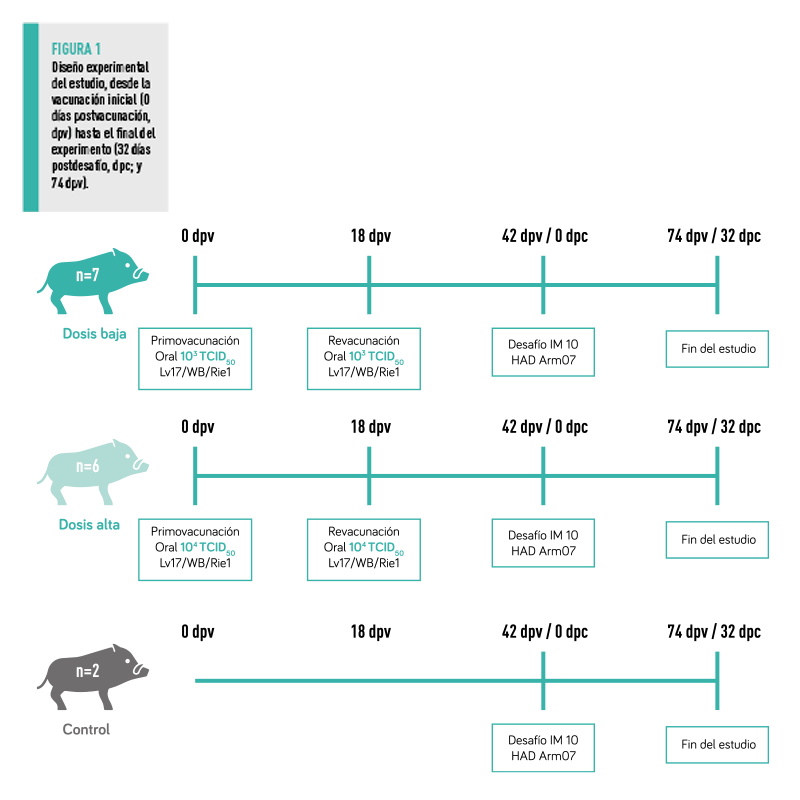
DISEÑO EXPERIMENTAL
![]()
VACUNACIÓN Y REVACUNACIÓN
A lo largo del estudio, se evaluó la inocuidad y eficacia del candidato vacunal Lv17/WB/Rie1 a diferentes dosis y durante la revacunación mediante administración oral, 103 y 104 TCID50 (Figura 1):
La revacunación se realizó por vía oral a los 18 dpv con la dosis de administración correspondiente, 103 TCID50 para el grupo de dosis baja y 104 TCID50 para el grupo de dosis alta.
 42 días después de la primovacunación (42 dpv), todos los animales fueron desafiados mediante la administración intramuscular de 1 ml de 10 TCID50 del VPPA Arm07.
42 días después de la primovacunación (42 dpv), todos los animales fueron desafiados mediante la administración intramuscular de 1 ml de 10 TCID50 del VPPA Arm07.
Los animales se mantuvieron durante 32 días después del desafío (dpc) o hasta que sucumbieron a la enfermedad y, en consecuencia, se establecieron los puntos finales humanitarios.
| Durante el periodo de vacunación, que puede entenderse como el periodo entre la primovacunación y el desafío (42 dpv), se tomaron muestras de sangre y suero una vez a la semana, los días 0, 7, 11, 18, 25, 32 y 39 dpv para la detección del genoma del VPPA y sus anticuerpos. Durante el periodo de desafío, entre 0 dpc/42 dpv hasta el final del experimento (32 dpc/74 dpv), se mantuvo la frecuencia de muestreo en 0, 4, 7, 11, 18, 25 y 32 dpc o el último día de vida de cada animal. |
EVALUACIÓN CLÍNICA
![]()
Se llevó a cabo una evaluación clínica diaria de los animales con el fin de detectar cualquier signo clínico durante los períodos de vacunación y desafío y poder evaluar la atenuación y eficacia del candidato vacunal.
Los animales fueron observados cada día del experimento mediante una cámara de vídeo de 24 horas y visitas in situ de veterinarios especialistas en fauna silvestre para registrar sus signos clínicos diarios.
Los signos clínicos se expresaron en términos de una puntuación cuantitativa (CS, clinical score) siguiendo las directrices específicas para la evaluación de la enfermedad clínica de la PPA en jabalíes descritas previamente por Cadenas-Fernández et al. (2020)13. Este sistema de puntuación incluye:
El único parámetro clínico que no se registró diariamente fue la temperatura rectal para reducir al máximo el manejo de los animales, midiéndola solamente 2 veces a la semana y en animales con algún signo grave, definiéndose como fiebre una temperatura rectal superior a 40,0˚C.
ANÁLISIS DE MUESTRAS
![]()
DETECCIÓN DE ANTICUERPOS FRENTE A VPPA
La presencia de anticuerpos frente al VPPA se determinó mediante un test ELISA comercial y una prueba de inmunoperoxidasa indirecta (IPT), tal y como realiza el Laboratorio de Referencia de la Unión Europea14.
DETECCIÓN DE ADN DEL VPPA
El genoma viral de la PPA obtenido de la sangre (viremia) se amplificó empleando el protocolo de PCR a tiempo real de la Universal Probe Library (UPL), utilizando el ADN extraído sin diluir para cada muestra15.
![]() Los resultados se expresaron en valores Cq (equivalente al ciclo umbral, Ct), considerándolos positivos cuando Cq < 40,0.
Los resultados se expresaron en valores Cq (equivalente al ciclo umbral, Ct), considerándolos positivos cuando Cq < 40,0.
EVALUACIÓN DE LA HEMADSORCIÓN
Se aisló el VPPA de desafío mediante células PBM, como se describe en el Manual de Pruebas de Diagnóstico y Vacunas para Animales Terrestres16.
![]() Las placas se examinaron para la determinación del nivel de hemadsorción durante seis días, realizando pases ciegos tres veces en las células PBM.
Las placas se examinaron para la determinación del nivel de hemadsorción durante seis días, realizando pases ciegos tres veces en las células PBM.

RESULTADOS
PERIODO VACUNAL
![]()
SIGNOS CLÍNICOS
| GRUPO DOSIS BAJA Tras la primovacunación, dos de los siete rayones vacunados con dosis baja (28,8%) presentaron una ligera fiebre (40,45 ± 0,35˚C) y un ligero letargo a partir de los 11 y 18 días postvacunación (dpv), respectivamente (esto se observó solo en un día de muestreo). Tras la revacunación, estos dos rayones, y otros tres del mismo grupo, presentaron una ligera fiebre (40,50 ± 0,29˚C) a los 12 días post revacunación (25 – 39 dpv). Dos de estos animales tuvieron fiebre leve en dos días de muestreo consecutivos, durante los cuales también se observó un ligero letargo además de la fiebre.
En estos animales, la puntuación clínica (CS) más alta registrada fue de 5,5 a los 25 dpv (7 días después de la revacunación), siendo el promedio de la CS durante este periodo de 0,7 ± 1,4 (Gráfica 1). |
GRUPO DOSIS ALTA Tras la primovacunación, solo tres de los seis animales (50%) desarrollaron una ligera fiebre (40,15 ± 0,10˚C) a partir de los 11 dpv, lo que se observó en dos días de muestreo consecutivos. Tras la revacunación, uno de estos animales, junto a otro más, presentó una ligera fiebre (40,10 ± 0,14˚C) a los 10 días de la revacunación (25 – 32 dpv), y uno de ellos también presentó un ligero letargo. Uno de los rayones de este grupo presentó una fiebre elevada (41,5˚C) a los 14 días de la revacunación (32 dpv). Este fue el único animal vacunado que sucumbió durante el periodo de vacunación, ya que desarrolló un curso clínico que comenzó tras una pelea muy agresiva. A pesar de recibir tratamiento, comenzó a mostrar signos de fiebre seguidos de letargo y finalmente anorexia, hasta su eutanasia a los 21 días post revacunación (39 dpv). El análisis de sus muestras reveló la presencia del ADN del VPPA en sangre junto con una septicemia debida al Streptococcus suis y la detección del ADN bacteriano en el cerebro.
En estos animales, la puntuación CS más alta registrada, aparte del del animal que no sobrevivió, fue de 2 a los 7dpv, con un promedio durante este de 0,5 ± 1,2 (Gráfica 1). |
No se observaron diferencias estadísticamente significativas entre los grupos de dosis baja y dosis alta durante el periodo de vacunación en cuanto a las variaciones de temperatura y CS.
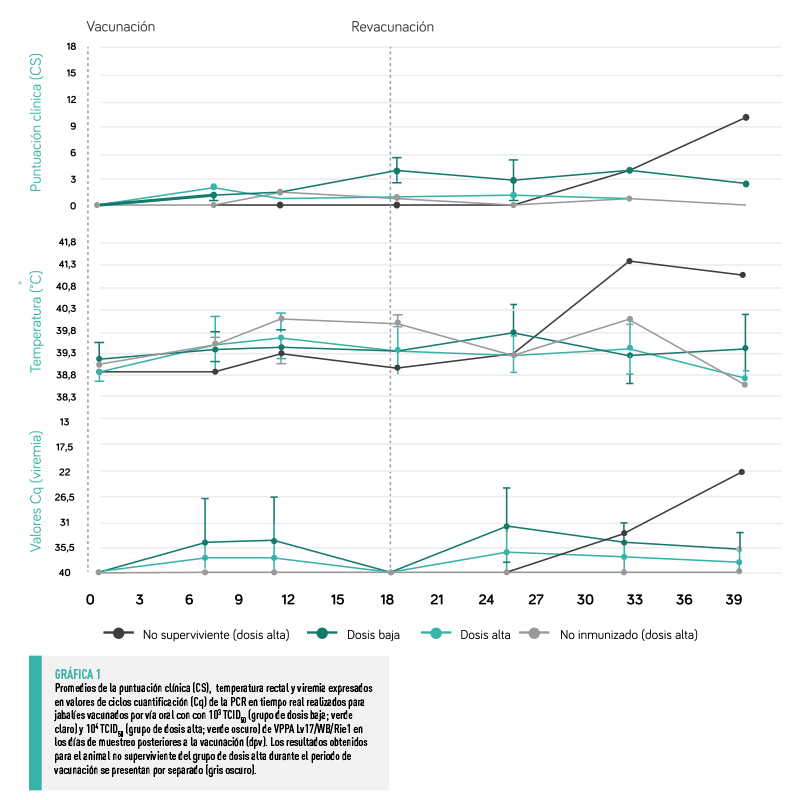

En general, se observaron dos picos transitorios de detección del genoma viral del VPPA en sangre en los animales vacunados.
El primer pico se observó tras la primovacunación en 5 de los 13 animales (38,5%), mientras que el segundo se observó tras la revacunación en 11 animales, es decir, en el 84,6% de ellos (Gráfica 1).
SE OBSERVÓ UNA CORRELACIÓN DIRECTA ENTRE LOS PICOS DE VIREMIA Y EL AUMENTO DE LA TEMPERATURA CORPORAL
| VIREMIA TRAS LA PRIMOVACUNACIÓN Tras la primovacunación, se detectó el genoma viral del VPPA de forma transitoria en la sangre de tres rayones del grupo de dosis baja a partir de los 7 dpv con un valor Cq medio de 27,1 ± 4,0. Solo uno de estos animales tuvo fiebre antes de la revacunación. Tras la primovacunación, dos rayones del grupo de dosis alta empezaron a mostrar una viremia positiva a partir de los 7 dpv, con valores medios de Cq de 32,1 ± 4,5, presentando uno de estos animales fiebre antes de la revacunación. |
VIREMIA TRAS LA REVACUNACIÓN Tras la revacunación, el genoma viral del VPPA se detectó de forma transitoria en la sangre de los animales mencionados (tras la primovacunación), así como en la de los demás animales del grupo de dosis baja y en la de otros dos rayones del grupo de dosis alta a partir de los 7 a los 21 días post revacunación (25 – 39 dpv; valores medios de Cq de 32,9 ± 3,7 y 34,4 ± 4,7, respectivamente). No hubo diferencias estadísticamente significativas en cuanto a la viremia entre los grupos de dosis baja y alta durante todo el periodo de vacunación. |
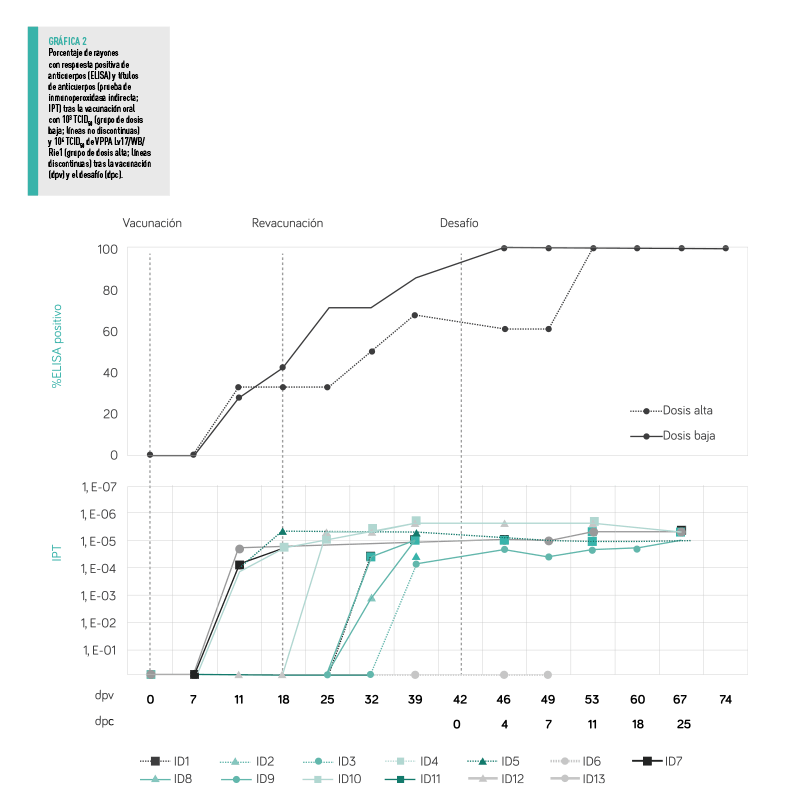
RESPUESTA DE ANTICUERPOS
Antes del desafío, todos los animales del grupo de dosis baja presentaron una respuesta de anticuerpos positiva al VPPA, tanto en la prueba ELISA como en la prueba de inmunoperoxidasa indirecta (IPT), con la excepción de uno que dio positivo a los anticuerpos solo en la IPT (Gráfica 2).
 Los mismos tres animales del grupo de dosis baja que presentaban viremia antes de la revacunación fueron positivos a los anticuerpos frente al VPPA antes de la revacunación, a partir de los 11 dpv, y los cuatro animales restantes empezaron a mostrar una respuesta de anticuerpos entre los 7 y los 21 días post revacunación (25 – 39 dpv).
Los mismos tres animales del grupo de dosis baja que presentaban viremia antes de la revacunación fueron positivos a los anticuerpos frente al VPPA antes de la revacunación, a partir de los 11 dpv, y los cuatro animales restantes empezaron a mostrar una respuesta de anticuerpos entre los 7 y los 21 días post revacunación (25 – 39 dpv).
En cuanto al grupo de dosis alta, cuatro de los seis animales (66,6%) presentaron una respuesta positiva de anticuerpos frente al VPPA en las pruebas ELISA e IPT.
 Lo mismo ocurrió con los dos animales del grupo de dosis alta que tenían viremia antes de la revacunación y desarrollaron anticuerpos frente al VPPA antes de la revacunación (a partir de los 11 dpv), mientras que los dos animales restantes fueron seropositivos entre los 14 y los 21 días post revacunación (32 – 39 dpv).
Lo mismo ocurrió con los dos animales del grupo de dosis alta que tenían viremia antes de la revacunación y desarrollaron anticuerpos frente al VPPA antes de la revacunación (a partir de los 11 dpv), mientras que los dos animales restantes fueron seropositivos entre los 14 y los 21 días post revacunación (32 – 39 dpv).

HUBO UNA CORRELACIÓN DIRECTA ENTRE EL INICIO DE UNA RESPUESTA POSITIVA DE ANTICUERPOS FRENTE AL VPPA Y LA PRIMERA DETECCIÓN DE UN GENOMA VIRAL
PERIODO DE DESAFÍO
![]()
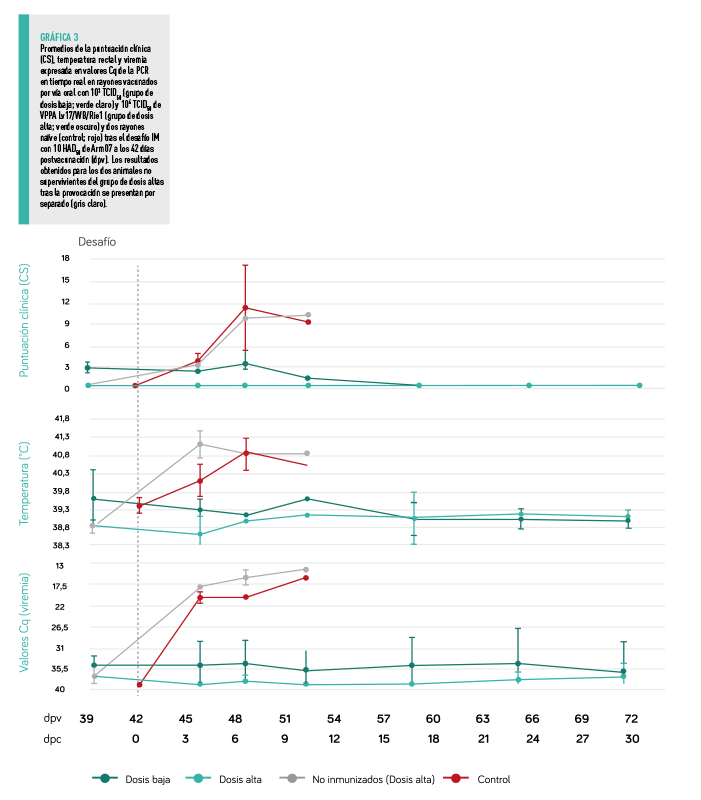
EFICACIA PROTECTORA
Todos los animales del grupo de dosis baja resultaron estar totalmente protegidos y sobrevivieron al desafío con Arm07 10 HAD50 a las 32 dpc (100% de eficacia protectora). En cambio, los dos animales vacunados con dosis altas que no tuvieron una respuesta positiva de anticuerpos durante el periodo de vacunación no sobrevivieron tras el desafío (desprotegidos; eficacia protectora del 60% en este grupo), y presentaron los mismos signos compatibles con la PPA que los observados en el grupo de control.
EL RESULTADO DE LA PROTECCIÓN DE AMBOS GRUPOS DE JABALÍES VACUNADOS Y REVACUNADOS POR VÍA ORAL FUE DEL 83,3%
SIGNOS CLÍNICOS Y VIREMIA
No se observaron signos clínicos en el grupo de dosis bajas tras el desafío IM, salvo un aumento muy ligero de la temperatura corporal en un animal (40,2˚C) a los 11 dpc (Gráfica 3).
En cuanto a la detección del genoma viral del VPPA en sangre, cinco animales de este grupo presentaron una viremia transitoria tras el desafío, a partir de los 4 dpc (46 dpv), con un valor Cq medio de 36,4 ± 2,0 (Gráfica 3), mientras que solo un animal mantuvo una viremia constante desde los 4 dpc hasta el final del experimento, con un valor Cq medio de 25,5 ± 0,8.
NINGUNO DE LOS SUPERVIVIENTES DEL GRUPO DE DOSIS ALTA DESARROLLÓ SIGNOS CLÍNICOS TRAS EL DESAFÍO
HALLAZGOS POSTMORTEM
![]()
Los animales control desafiados y no vacunados mostraron lesiones patológicas consistentes con la PPA, confirmadas por qPCR, aislamiento del virus y hemadsorción.
Los principales hallazgos de la necropsia fueron congestión y hemorragias focales en la superficie pulmonar, el bazo (esplenomegalia), los ganglios linfáticos (linfadenomegalia), los riñones, el hígado (hepatomegalia) y la mucosa intestinal.
 Además, se observó con frecuencia una acumulación de líquido amarillento-rojizo en la cavidad abdominal (ascitis), el tórax (hidrotórax) y el saco pericárdico (hidropericardio). Todos los tejidos (100%) de estos animales fueron positivos al genoma viral del VPPA (20 tejidos diferentes).
Además, se observó con frecuencia una acumulación de líquido amarillento-rojizo en la cavidad abdominal (ascitis), el tórax (hidrotórax) y el saco pericárdico (hidropericardio). Todos los tejidos (100%) de estos animales fueron positivos al genoma viral del VPPA (20 tejidos diferentes).
| Los animales vacunados supervivientes de los grupos de dosis baja y alta que sobrevivieron al desafío no mostraron lesiones compatibles con la PPA a los 32 días de vida. En promedio, solo 7 ± 3 tejidos (35%) de los jabalíes de estos grupos fueron positivos al genoma viral de la PPA, solamente pudiéndose aislar el virus en un ganglio linfático retrofaríngeo de los 20 tejidos analizados de estos animales. Este virus aislado no era hemadsorbente. El valor Cq medio de los tejidos de los animales supervivientes del grupo de dosis baja fue de 37,1 ± 0,5, muy similar al valor Cq medio de los tejidos de los animales supervivientes del grupo de dosis alta, 36,3 ± 2,0.
|

CONCLUSIONES
SEGURIDAD
La capacidad de replicación viral de las vacunas atenuadas las convierte en una gran herramienta para el control eficaz de diversas enfermedades17.
Comúnmente, se han descrito como insuficientemente seguras frente a la PPA debido a las formas clínicas crónicas, los efectos secundarios y la inmunidad no estéril21, pero este ensayo clínico proporciona resultados prometedores en términos de inocuidad y seguridad en jabalíes vacunados por vía oral.
La razón para evaluar esta vacuna en condiciones de revacunación y con una dosis elevada residía en simular la administración de cebos vacunales orales y su consumo por parte de los jabalíes en el campo.
En este caso, leves diferencias en términos de seguridad según la dosis utilizada para la vacunación.
 Dos de los siete rayones que recibieron una dosis baja y dos de los cinco que recibieron una dosis alta no mostraron signos clínicos tras la primo- y revacunación. Los animales restantes solo presentaron una ligera fiebre transitoria, junto con un ligero letargo, similar a las observaciones realizadas anteriormente tras una vacunación oral10. Asimismo, se están evaluando actualmente otros candidatos vacunales con deleción genética artificial con la finalidad de incrementar aún más la seguridad del protocolo vacunal.
Dos de los siete rayones que recibieron una dosis baja y dos de los cinco que recibieron una dosis alta no mostraron signos clínicos tras la primo- y revacunación. Los animales restantes solo presentaron una ligera fiebre transitoria, junto con un ligero letargo, similar a las observaciones realizadas anteriormente tras una vacunación oral10. Asimismo, se están evaluando actualmente otros candidatos vacunales con deleción genética artificial con la finalidad de incrementar aún más la seguridad del protocolo vacunal.
EFICACIA
En lo que respecta a la eficacia, todos los animales con una respuesta de anticuerpos positiva antes del desafío (el 100% del grupo de dosis baja y el 60% del grupo de dosis alta) estaban totalmente protegidos.

DOSIFICACIÓN IDEAL
Dado que la eficacia vacunal no parece verse afectada por la dosis, sugerimos llevar a cabo estudios con dosis aún más bajas.
Igualmente, sería recomendable evaluar dosis aún más altas para comprobar la relación entre la seguridad de la vacuna y la dosis por dos razones:
1. Se trata de una vacuna viva atenuada.
2. El jabalí debe ser vacunado por vía oral a partir de cebos. En estas condiciones, el control de la dosis por individuo en el campo es complejo, por lo que hay que tener en cuenta el riesgo de que los animales tomen dosis mucho más altas.
Por otro lado, es probable que no podamos definir una dosis muy baja por el mismo hecho de que la vacunación se realiza a partir de cebos lanzados en el campo, que pueden permanecer durante horas o incluso días, lo que puede afectar a la viabilidad de la vacuna y a su eficacia.
SE NECESITAN ESTUDIOS QUE EVALÚEN LA ESTABILIDAD DEL VIRUS EN EL CEBO EN DIFERENTES CONDICIONES AMBIENTALES Y EN DIFERENTES MOMENTOS
CORRELACIÓN ENTRE VIREMIA Y EFICACIA PROTECTORA

Aunque se desconocen y existen contradicciones en cuanto a los mecanismos inmunitarios específicos que intervienen en la respuesta protectora frente a la infección por el VPPA18, la aparición de anticuerpos ha sido, en el presente estudio, indicativa de una protección eficaz frente al desafío.
Los resultados de este estudio también ponen de manifiesto la importancia potencial de la inmunidad asociada a las mucosas, siendo necesario realizar más estudios que evalúen el desafío de contacto/natural, ya que la inmunización se realiza por vía oral.
 Esto nos permitiría comprender y evaluar el efecto de las barreras mucosas, previamente activadas por la inmunización oral, frente a la infección por el VPPA.
Esto nos permitiría comprender y evaluar el efecto de las barreras mucosas, previamente activadas por la inmunización oral, frente a la infección por el VPPA.
| A pesar de que aún existen dudas sobre la seguridad de este candidato vacunal, hay muchas razones de peso para seguir estudiándolo y buscar formas de hacerlo más seguro, siendo el único que ha tenido resultados altamente efectivos en jabalíes por administración oral10 hasta la fecha. Disponer de una herramienta como esta vacuna candidata para el control de la PPA en jabalíes ayudaría enormemente a controlar la propagación de la enfermedad en estas poblaciones. |

Te puede interesar:
BIBLIOGRAFÍA
1. Gallardo MC, de la Torre A, Fernández-Pinero J, Iglesias I, Muñoz MJ, Arias ML. African Swine Fever: A Global View of the Current Challenge. Porc Heal Manag (2015) 1:21. doi: 10.1186/s40813-015-0013-y – DOI – PMC– PubMed
2. OIE WAHIS . World Animal Health Information System (2021). Available at: http://www.oie.int/wahis_2/public/wahid.php/Diseaseinformation/reportarc
3. Zhou X, Li N, Luo Y, Liu Y, Miao F, Chen T, et al. Emergence of African Swine Fever in China, 2018. Transbound Emerg Dis (2018) 66:1482–4. doi: 10.1111/tbed.12989 –DOI – PubMed
4. Arias M, Jurado C, Gallardo C, Fernández-Pinero J, Sánchez-Vizcaíno JM. Gaps in African Swine Fever: Analysis and Priorities. Transbound Emerg Dis (2018) 65:235–47. doi: 10.1111/tbed.12695 – DOI – PubMed
5. Li L, Wang Q, Ge S, Liu Y, Liu C, Liu F, et al. Infection of African Swine Fever in Wild Boar, China, 2018. Transbound Emerg Dis (2019) 66:1395–8. doi: 10.1111/tbed.13114 – DOI – PubMed
6. Cukor J, Linda R, Václavek P, Mahlerová K, Šatrán P, Havránek F. Confirmed Cannibalism in Wild Boar and Its Possible Role in African Swine Fever Transmission. Transbound Emerg Dis (2019) 67:1068–73. doi: 10.1111/tbed.13468 – DOI – PubMed
7. Nurmoja I, Mõtus K, Kristian M, Niine T, Schulz K, Depner K, et al. Epidemiological Analysis of the 2015–2017 African Swine Fever Outbreaks in Estonia. Prev Vet Med (2018) 181:104556. doi: 10.1016/J.PREVETMED. 2018.10.001 – DOI – PubMed
8. Barasona JA, Gallardo C, Cadenas-Fernández E, Jurado C, Rivera B, Rodríguez-Bertos A, et al. First Oral Vaccination of Eurasian Wild Boar Against African Swine Fever Virus Genotype II. Front Vet Sci (2019) 6:137. doi: 10.3389/fvets.2019.00137 – DOI – PMC – PubMed
9. Arias M, de la Torre A, Dixon L, Gallardo C, Jori F, Laddomada A, et al. Approaches and Perspectives for Development of African Swine Fever Virus Vaccines. Vaccines (2017) 5:35. doi: 10.3390/vaccines5040035 –DOI – PMC – PubMed
10. World Organisation for Animal Health (OIE) – Chapter 1.1.8 . Principles of Veterinary Vaccine Production. In Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 8th Ed. OIE, Paris, France (2019). Available at: https://www.oie.int/en/what-we-do/standards/codes-and-manuals/terrestria.
11. Gallardo C, Soler A, Rodze I, Nieto R, Cano-Gómez C, Fernandez-Pinero J, et al. . Attenuated and Non-Haemadsorbing (Non-HAD) Genotype II African Swine Fever Virus (ASFV) Isolated in Europe, Latvia 2017. Transbound Emerg Dis (2019) 66:1399–404. doi: 10.1111/tbed.13132 – DOI – PubMed
12. Cadenas-Fernández E, Sánchez-Vizcaíno JM, Kosowska A, Rivera B, Mayoral-Alegre F, Rodríguez Bertos A, et al. Adenovirus-Vectored African Swine Fever Virus Antigens Cocktail Is Not Protective Against Virulent Arm07 Isolate in Eurasian Wild Boar. Pathogens (2020) 9:1–14. doi: 10.3390/pathogens9030171 – DOI– PMC – PubMed
13. Fernández-Pinero J, Gallardo C, Elizalde M, Robles A, Gómez C, Bishop R, et al. . Molecular Diagnosis of African Swine Fever by a New Real‐Time PCR Using Universal Probe Library. Transbound Emerg Dis (2013) 60:48–58. doi: 10.1111/j.1865-1682.2012.01317.x – DOI– PubMed
14. OIE – World Organization For Animal Health . Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 8th Ed. OIE, Paris, France (2019). Available at: https://www.oie.int/en/what-we-do/standards/codes-and-manuals/terrestria….
15. Team Core R Development . R: A Language and Environment for Statistical Computing. In: R Foundation for Statistical Computing. Vienna, Austria: (2013). Available at: http://www.r-project.org.
16. Bull JJ. Evolutionary Reversion of Live Viral Vaccines: Can Genetic Engineering Subdue It? Virus Evol (2015) 1:vev005. doi: 10.1093/ve/vev005 – DOI – PMC – PubMed
17. Rossi S, Staubach C, Blome S, Guberti V, Thulke H-H, Vos A, et al. . Controlling of CSFV in European Wild Boar Using Oral Vaccination: A Review. Front Microbiol (2015) 6:1141. doi: 10.3389/fmicb.2015.01141 – DOI – PMC –PubMed
18. Tizard I. Veterinary Immunology (2017). Elsevier Saunders. Available at: https://www.elsevier.com/books/veterinary-immunology/tizard/978-0-323-52… (Accessed July 27, 2020).
19. Sánchez-Cordón PJ, Chapman D, Jabbar T, Reis AL, Goatley L, Netherton CL, et al. . Different Routes and Doses Influence Protection in Pigs Immunised With the Naturally Attenuated African Swine Fever Virus Isolate OURT88/3. Antiviral Res (2017) 138:1–8. doi: 10.1016/j. antiviral.2016.11.021 – DOI – PMC – PubMed
20. Mulumba-Mfumu LK, Goatley LC, Saegerman C, Takamatsu HH, Dixon LK. Immunization of African Indigenous Pigs With Attenuated Genotype I African Swine Fever Virus OURT88/3 Induces Protection Against Challenge With Virulent Strains of Genotype I. Transbound Emerg Dis (2016) 63:e323–7. doi: 10.1111/tbed.12303 – DOI – PubMed
21. Rock DL. Challenges for African swine fever vaccine development—“… perhaps the end of 510 the beginning.” Vet Microbiol (2017) 206:52–58. doi:10.1016/j. vetmic.2016.10.003
[/registrados]
