ESTRUCTURA QUÍMICA
![]()
Las sulfamidas fueron el primer gran grupo de medicamentos utilizados para el tratamiento de infecciones bacterianas en el ser humano, especialmente las causadas por estreptococos.
Para leer más contenidos de Revista porciSapiens Abril 2023



| En la primera parte de este artículo abordamos los antibióticos que ejercen su mecanismo de acción a través de la inhibición de los ácidos nucleicos ARN y ADN, centrándonos en las fluoroquinolonas.
En la segunda parte de este artículo, nos ocuparemos de las sulfamidas e inhibidores de la dihidrofolato reductasa, rifamicinas, novobiocina y nitrofuranos y nitroimidazoles. No obstante, estos dos últimos no están autorizados en animales productores de alimentos, al no poder establecer sus LMR (Límite Máximo de Residuos) (Anexo 2 del Reglamento 37/2010). |
SULFAMIDAS (SULFONAMIDAS) Y TRIMETOPRIMA
ESTRUCTURA QUÍMICA
Las sulfamidas fueron el primer gran grupo de medicamentos utilizados para el tratamiento de infecciones bacterianas en el ser humano, especialmente las causadas por estreptococos.![]()

ESPECTRO DE ACTIVIDAD
![]()
| SULFAMIDAS Las sulfamidas o “sulfas” son un grupo de compuestos sintéticos derivados amida del ácido sulfónico benceno (sulfonamidas) con un amplio espectro de acción antibacteriana bacteriostática (Gram positivas, Gram negativas y protozoos como los coccidios), pero ineficaces, en gran medida, frente a anaerobios obligados. |
TRIMETOPRIMA La trimetoprima (TMP) es un fármaco diaminopirimidina sintético activo frente a bacilos Gram negativos aerobios y algunos microorganismos Gram positivos. |

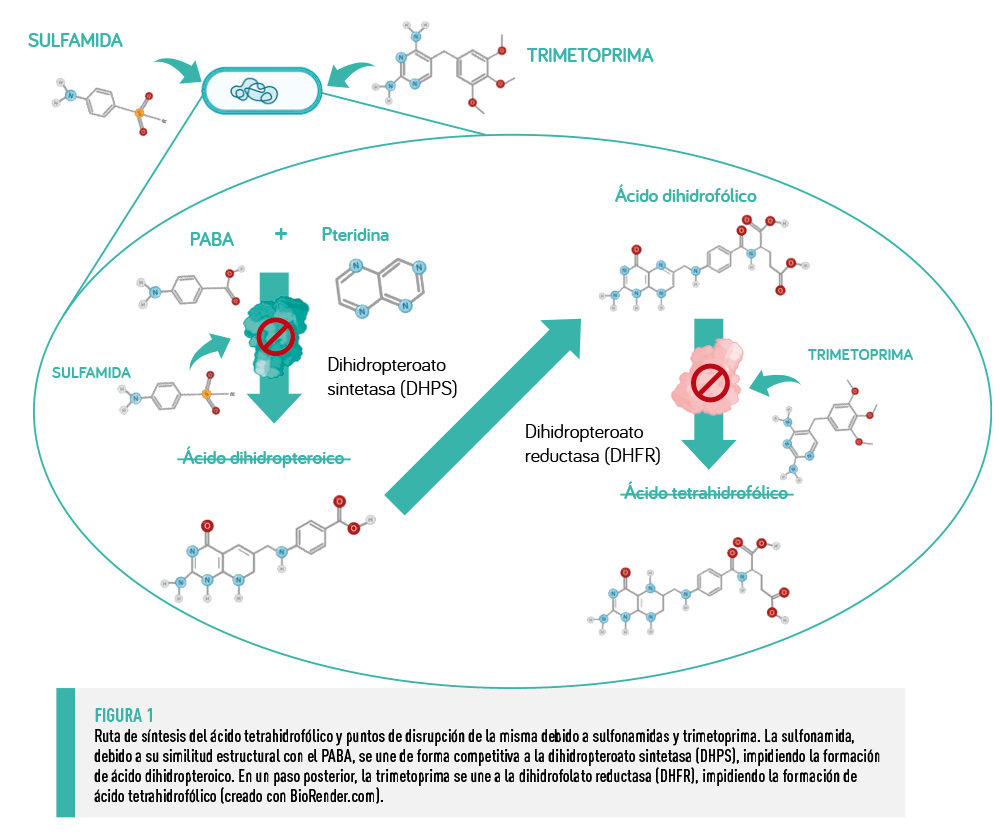
Las sulfamidas y la trimetoprima se suelen usar en asociación, ya que inhiben pasos enzimáticos secuenciales en la ruta de síntesis del ácido fólico en las bacterias que no pueden obtenerlo del medio (Figura 1), como ocurre en los mamíferos.


MECANISMO DE ACCIÓN
![]()
| SULFAMIDAS Debido a su analogía estructural con el PABA, las sulfamidas se unen de forma competitiva a la enzima dihidropteroato sintetasa que se encarga de sintetizar dihidropteroato (ácido dihidropteroico) a partir de PABA y pteridina (dihidropteroato difosfato), y al cual se unirá seguidamente ácido glutámico para formar ácido dihidrofólico (ácido fólico). |
TRIMETOPRIMA La TMP impide la síntesis de ácido tetrahidrofólico (o ácido folínico) a partir de dihidrofolato al unirse a la enzima dihidrofolato reductasa (DHFR) con una afinidad 10.000 veces mayor por la DHFR bacteriana que por la de los mamíferos, por lo que representa una diana selectiva.
|

CARACTERÍSTICAS FARMACOCINÉTICAS
![]()
SULFAMIDAS
Las sulfamidas son fármacos poco solubles, más solubles a pH alcalino, por lo que cuando aumenta la diferencia entre su pK y el pH del medio (ej. orina) precipitan.

LA MAYORÍA DE LAS SULFAMIDAS SE ABSORBEN BIEN EN EL TRACTO GASTROINTESTINAL Y TIENEN UNA AMPLIA DISTRIBUCIÓN ALCANZANDO INCLUSO LOS LÍQUIDOS SINOVIAL Y CEFALORRAQUÍDEO
Al ser un grupo de compuestos muy amplio, las propiedades de las sulfamidas pueden ser muy variables. Por ejemplo, sus tasas de unión a proteínas plasmáticas suelen ser altas y sus semividas muy variables.
El metabolismo de las sulfamidas es principalmente hepático y se inactivan por acetilación, glucuronoconjugación e hidroxilación, excretándose el fármaco y sus metabolitos principalmente a través del riñón.

TRIMETOPRIMA
Las diaminopirimidinas (trimetoprima) son bases débiles y muy liposolubles, con una absorción oral muy rápida. Tienen una amplia distribución en el organismo y persisten unidas a los tejidos, pudiendo quedar retenidas en próstata y leche debido a que su pH es menor que el del plasma.

LAS DIAMINOPIRIMIDINAS SE USAN NORMALMENTE COMO POTENCIADORAS DE LAS SULFAMIDAS EN UNA RELACIÓN 1:5
| El efecto de la trimetoprima es bacteriostático, pero cuando se combina con las sulfonamidas es bactericida.
|

MECANISMOS DE RESISTENCIA
![]()
SULFAMIDAS
La resistencia a las sulfamidas es frecuente y puede producirse por distintos mecanismos. Dado que son compuestos muy similares estructuralmente, la resistencia cruzada entre las diferentes sulfamidas es completa y aquellas cepas bacterianas resistentes a una sulfamida serán resistentes a muchas otras, por lo queno se debe cambiar de una a otra si el tratamiento no es satisfactorio.


TRIMETOPRIMA
La resistencia a la TMP suele estar mediada por cambios en la enzima DHFR que reduce su afinidad por el fármaco.
Debido a la probable variabilidad (temporal, geográfica) en la sensibilidad bacteriana a las sulfamidas potenciadas, la aparición de las resistencias bacterianas puede diferir de un área geográfica o región a otra e incluso de una explotación a otra, por lo que se recomienda efectuar un muestreo bacteriológico y ensayos de sensibilidad.
EL USO DE ESTOS ANTIMICROBIANOS DEBE BASARSE EN LA SENSIBILIDAD DE LOS MICROORGANISMOS EN CULTIVO AISLADOS DE ANIMALES ENFERMOS DE LA PROPIA EXPLOTACIÓN O EN LA EXPERIENCIA PREVIA RECIENTE DE ÉSTA
| Hoy en día, en algunas patologías como la colibacilosis hay un aumento en el uso de alternativas como la vacunación y mejoras en la nutrición, medidas que deben ir acompañadas de una focalización en la mejora de las condiciones de manejo, de higiene y de bioseguridad. |

INTERACCIONES, EFECTOS SECUNDARIOS Y TOXICIDAD
![]()
Las sulfamidas presentan antagonismo con el ácido p-aminobenzoico (PABA) y sus derivados (procaína -penicilina-, benzocaína, tetracaína, etc.) por lo que no deben administrarse simultáneamente con estos compuestos ni con sustancias que aporten o liberen PABA y/o ácido fólico. Tampoco se debería administrar con anticoagulantes orales o acidificantes urinarios.
Los efectos secundarios principales de las sulfamidas, aunque se producen en muy raras ocasiones (1 cada 10.000 animales) son:
| El uso de estos medicamentos implica que se excreten en mayor o menor medida al medio ambiente a través de la orina o de las heces. Los antibióticos mal metabolizados también se pueden acumular en el suelo, lo que puede afectar las comunidades y funciones microbianas del mismo o pueden bioacumularse también en el medio acuático si no están expuestos a la luz solar. Por otro lado, se puedan encontrar en niveles bajos, pero detectables, en los tejidos comestibles de animales productores de carne tratados. |
USO TERAPÉUTICO
![]()
SOLAS
| SULFADIMIDINA (Categoría D) Existen autorizadas 2 especialidades de sulfadimidina sódica en polvo para la administración en agua de bebida. Posee un amplio espectro de acción frente a un gran número de patógenos entre los que caben destacar bacterias Gram negativas (Salmonella spp., E. coli, Klebsiella spp., Haemophilus spp., Pasteurella spp., Bordetella bronchiseptica, Fusobacterium necrophorum, etc.), algunas bacterias Gram positivas (Streptoccoccus spp.) y coccidios.
Tras la administración por vía oral, la sulfadimidina se absorbe rápidamente y se distribuye ampliamente por el organismo, alcanzando la concentración plasmática máxima entre 1 y 2 horas. La posología es de una dosis de choque de 110 mg de sulfadimidina/ kg peso vivo (p.v.) el primer día y 55 mg de sulfadimidina/kg p.v./día durante 4 días consecutivos.
Se debe manipular el medicamento con cuidado para evitar el contacto durante la incorporación al agua, así como durante la administración a los animales, tomando precauciones específicas como la de llevar equipo de protección individual (mascarilla antipolvo, guantes, mono de trabajo y gafas de seguridad aprobadas). El tiempo de espera en carne es de 28 o 40 días (según la especialidad). |

COMBINACIONES
 La asociación de sulfadiazina con trimetropima se presenta en varias especialidades y formas.
La sulfadiazina se considera una sulfonamida semiretardada con una persistencia de sus niveles plasmáticos bastante larga, con una buena distribución y alta unión a proteínas plasmáticas. Ambos ingredientes activos se metabolizan parcialmente en el hígado. Su excreción es esencialmente renal. |

| Existen autorizadas 5 especialidades como premezcla medicamentosa para mezclar con el alimento con 250 mg de sulfadiazina y 50 mg de trimetoprima (5:1). La dosis para administrar es de 25 mg de sulfadiazina y 5 mg de trimetoprima/kg de p.v./día durante 5 días, constituyendo este pienso medicado la única ración durante este período. Se debe evitar el contacto con la piel y los ojos y, en caso de contacto con la piel, lavar el área expuesta con agua. Los tiempos de espera para animales productores de carne son:
|
Existen 2 especialidades como polvo para administración en agua de bebida. La dosis es de 25 mg de sulfadiazina + 5 mg de trimetoprima/kg de p.v./día durante 5 días consecutivos. El tiempo de espera para animales productores de carne es 4 o 19 días (según especialidad).
|
Existen 2 especialidades como solución para la administración en agua de bebida o en leche. La dosis es de 25 mg de sulfadiazina y 5 mg de trimetoprima por kg de p.v. por día, durante 4 a 7 días consecutivos, por vía oral, diluidos en agua potable o leche. El agua medicada será la única fuente de bebida y deberá ser renovada cada 24 horas. El tiempo de espera es de 6 o 12 días (según especialidad). |
| SULFAMETOXAZOL CON TRIMETOPRIMA (COTRIMOXAZOL) (Categoría D) El sulfametoxazol es una sulfamida de acción corta a intermedia. La asociación sulfametoxazol con trimetoprima (SMX+TMP) también se conoce con el nombre de cotrimoxazol. La dosis recomendada es de 20 mg de trimetoprima y 100 mg de sulfametoxazol por ml o 1:5, lo que en el plasma se transforma en 1:20, dado que trimetoprima tiene un volumen de distribución más amplio que sulfametoxazol.
Existen autorizadas tres especialidades que se presentan en la forma de solución para administración en agua de bebida. La dosis recomendada en cerdos de engorde es de 5 mg de trimetoprima y 25 mg de sulfametoxazol/kg de p.v./día durante 4 a 7 días. Tras la administración oral, los dos principios activos se absorben rápidamente a nivel intestinal y se observan concentraciones elevadas de trimetoprima en los riñones, el hígado y los pulmones. Salvo en el caso de los riñones, las concentraciones de sulfametoxazol en los tejidos son significativamente menores que en el plasma. La unión a proteínas de la trimetoprima y el sulfametoxazol no es muy alta. En porcino, la semivida de eliminación de las dos sustancias es de aproximadamente 2,5 horas. En las 48 horas posteriores a la administración de la última dosis, la trimetoprima, el sulfametoxazol y sus metabolitos ya no son detectables en la orina ni en las heces.
Los tiempos de espera en carne son de 5 u 8 días (según la especialidad). |
| SULFADOXINA CON TRIMETOPRIMA (Categoría D) La asociación de sulfadoxina con trimetoprima se presenta en una sola especialidad en forma de solución inyectable para su administración por vía intramuscular en cerdos.
La dosis recomendada es de 12,5 mg de sulfadoxina + 2,5 mg de trimetoprima/kg de p.v. en dosis única. En la mayoría de los casos, una única dosis es suficiente, pero si no se alcanza un efecto terapéutico puede repetirse el tratamiento a intervalos de 24 horas durante un máximo de 3 días. No debe de inyectarse un volumen superior a 10 ml en un mismo punto.
El tiempo de espera en carne es de 10 días. |

NOVOBIOCINA
ESTRUCTURA QUÍMICA
![]()
La novobiocina, también conocida como albamicina o catomicina, es un antibiótico aminocumarina (contiene un núcleo cumarínico) producido por la bacteria Streptomyces niveus.
ESPECTRO DE ACTIVIDAD
![]()
El espectro de la novobiocina es reducido, limitándose a bacterias Gram positivas (Staphycolococcus aureus y Streptococcus) y Gram negativas Brucella spp. y Haemophilus spp.
EN VETERINARIA, LA NOVOBIOCINA SE USA CASI EXCLUSIVAMENTE EN EL TRATAMIENTO DE MASTITIS
MECANISMO DE ACCIÓN
![]()
La novobiocina actúa sobre la topoisomerasa II, concretamente sobre la subunidad GyrB de la enzima involucrada en la transducción de energía.

CARACTERÍSTICAS FARMACOCINÉTICAS
![]()
La novobiocina tiene buena absorción oral (60-70%), pero su volumen de distribución es escaso. Una vez metabolizado, se elimina a través de la bilis y un poco por orina, sufriendo circulación enterohepática.
MECANISMOS DE RESISTENCIA
![]()
En el caso de la novobiocina, es frecuente observar resistencias de tipo cromosómico.
INTERACCIONES, EFECTOS SECUNDARIOS Y TOXICIDAD
![]()
La novobiocina puede provocar reacciones alérgicas, náuseas, vómitos y alteraciones hemáticas como eosinofilia, trombocitopenia y leucopenia.
RIFAMICINAS
ESTRUCTURA QUÍMICA
![]()
Las rifamicinas son moléculas complejas derivadas del Streptomyces Amycolatopsis mediterranei.
Poseen estructura naftoquinónica, con una larga cadena alifática. Pertenecen al grupo de las ansamicinas.
LA RIFAMPICINA ES LA RIFAMICINA MÁS UTILIZADA EN VETERINARIA
ESPECTRO DE ACTIVIDAD
![]()
Las rifamicinas afectan a microrganismos extra e intracelulares, incluidos los que se encuentran dentro de macrófagos y neutrófilos, sin afectar la fagocitosis, entre ellos a bacterias Gram positivas, micobacterias, Chlamydia, Rickettsiae, Haemophilus, Brucella, protozoos, hongos y poxvirus.
![]()
El mecanismo de acción de las rifamicinas consiste en bloquear la subunidad β ARN-polimerasa, dependiente del ADN, impidiendo la síntesis del ARNm. A dosis terapéuticas no afecta a la enzima polimerasa de los mamíferos.
CARACTERÍSTICAS FARMACOCINÉTICAS
![]()
La rifampicina tiene una absorción oral del 40-68% (según especies), no debiendo administrarse con alimentos porque interfieren su absorción. Se absorben bien vía parenteral y tienen una amplia distribución, alcanzando concentraciones tisulares superiores a las plasmáticas, excepto en líquido cefalorraquídeo (LCR) donde su acceso es muy limitado.
Se metaboliza en hígado (25-40%) y se excreta a través de la bilis y poco por orina, existiendo circulación enterohepática.
LA RIFAMPICINA SE TRANSFORMA EN 25-DESACETILRIFAMPICINA, UN POTENTE INDUCTOR ENZIMÁTICO DEL P-450
NITROFURANOS
ESTRUCTURA QUÍMICA
![]()
Los nitrofuranos son compuestos sintéticos de amplio espectro basados en el 5-nitrofuraldehido.
EL POTENCIAL EFECTO CARCINÓGENO DE LOS NITROFURANOS HA HECHO QUE EN LA UE ESTÉ PROHIBIDO SU USO EN ANIMALES PRODUCTORES DE ALIMENTOS
ESPECTRO DE ACTIVIDAD
![]()
Los nitrofuranos tienen un amplio espectro de acción frente a bacterias Gram positivas (Staphylococcus aureus, Streptococcus spp. y Corynebacterium) y Gram negativas (E. coli, Salmonella y Klebsiella), micoplasmas, protozoos (coccidios, tripanosomas) y algunos hongos, mejorando su eficacia a pH 5,5 y reduciéndose ésta en medio alcalino.
Las bacterias anaerobias en condiciones de anaerobiosis son algo sensibles, mientras que las bacterias aerobias son sensibles tanto en condiciones de aerobiosis como de anaerobiosis.
En países donde no está prohibido, se utilizan en cerdos frente a diarrea hemorrágica, diarrea infecciosa, tifosis y paratifosis.
MECANISMO DE ACCIÓN
![]()
El mecanismo de acción de los nitrofuranos se basa en la actividad de las nitrorreductasas bacterianas que los degradan, convirtiéndolos en productos de reducción poco definidos y cuya composición varía de acuerdo con el nitrofurano del que proceden.

CARACTERÍSTICAS FARMACOCINÉTICAS
![]()
La nitrofurantoina se absorbe bien vía oral, tiene una semivida corta y un volumen de distribución bajo, excretándose por orina tras filtración renal, dando un color amarillo. En cambio, la nitrofurazona y furazolidona no se absorben vía oral, utilizándose para procesos intestinales asociados a Salmonella, Treponema o Giardia.
MECANISMOS DE RESISTENCIA
![]()
Los nitrofuranos presentan escasas resistencias por su variedad de mecanismos de acción y, cuando aparecen, son de tipo cromosómico, manifestándose con una menor capacidad de penetración del antibiótico o disminución de síntesis de reductasas bacterianas.
INTERACCIONES, EFECTOS SECUNDARIOS Y TOXICIDAD
![]()
Los nitrofuranos pueden inducir fenómenos de mutagénesis y son procancerígenos, ocasionando también trastornos a nivel del sistema nervioso central (SNC), diátesis hemorrágica, trombocitopenia, anemia, leucocitopenia, aumento del tiempo de hemorragia, anorexia y vómitos.

NITROIMIDAZOLES
ESTRUCTURA QUÍMICA
![]()
Los nitroimidazoles son compuestos heterocíclicos con un núcleo básico que es un anillo pentagonal similar al nitrofurano (grupos 5-nitro).
En este grupo se incluyen el metronidazol (categoría D, según clasificación UE AMEG), el dimetridazol, ronidazol, tinidazol, ipronodazol y cornidazol.
ESPECTRO DE ACTIVIDAD
![]()
condiciones de anaerobiosis, teniendo actividad bactericida sobre casi todas las bacterias Gram negativas y sobre muchas Gram positivas anaerobias y protozoos.

EL USO DE LOS NITROIMIDAZOLES ESTÁ PROHIBIDO EN ANIMALES PRODUCTORES DE ALIMENTOS POR SU POTENCIAL CARCINOGÉNICO
En los países donde esta aceptado su uso se emplean frente a disentería porcina e infecciones por Trichomonas foetus.
MECANISMO DE ACCIÓN
![]()
Cuando entran en la bacteria los nitroimidazoles sufren una nitrorreducción en condiciones de anaerobiosis que, a diferencia de los nitrofuranos, no es controlada enzimáticamente.

CARACTERÍSTICAS FARMACOCINÉTICAS
![]()
Los nitroimidazoles son liposolubles y se absorben bien por vía oral y parenteral, con un amplio volumen de distribución y penetración tisular, incluyendo LCR.
Se oxidan en el hígado y se conjugan dando formas menos activas, excretándose 2/3 partes a través de la orina, la mayor parte de forma activa.
MECANISMOS DE RESISTENCIA
![]()
Los nitroimidazoles apenas presentan resistencias.
INTERACCIONES, EFECTOS SECUNDARIOS Y TOXICIDAD
![]()
Debido a su potencial efecto carcinogénico en animales de laboratorio, no se deben usar los nitroimidazoles al principio de gestación. También se han observado neuropatías periféricas, ataques epileptiformes, orina oscura, náuseas y exantemas.
Te puede interesar: Uso racional de antimicrobianos en porcino: antimicrobianos inhibidores de la síntesis de ARN y ADN – Parte I
BIBLIOGRAFÍA
AEMPS. (2021) Agencia Española de Medicamentos y Productos Sanitarios. Guía de Prescripción Terapéutica: Información de medicamentos autorizados en España. http://www.aemps.gob.es.
AEMPS. Base de datos CIMAVET. Disponible en línea: https://cimavet.aemps.es/cimavet/publico/home.html
Botana, L.M. Farmacología Veterinaria. (2022). Fundamentos y aplicaciones terapéuticas. 2ª ed. Editorial Médica Panamericana.
Botana, L.M. Farmacología Veterinaria. Fundamentos y aplicaciones terapéuticas. 2ª ed. Editorial Médica Panamericana. 2022
Brunton,L.; Hilal-Dandan, R.; Knollmann, B.C.; Goodman, L.S. y Goodman Gilman, A. (2018). The pharmacologial basis of therapeutics.
Bush, N.; Diez-Santos, I.; Abbott, L.R. y Maxwell, A. (2020). Quinolones: Mechanism, Lethality and Their Contributions to Antibiotic Resistance.. Molecules, 25(23), 5662.
Calvo, J.; Martínez-Martínez, L. (2009). Mecanismos de acción de los antimicrobianos. Enfermedades Infecciosas y Microbiología Clínica, 27(1): 44–52.
EMA (European Medicines Agency) and ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) (2018). Sales of veterinary antimicrobial agents.
European Commission, ECDC (European Center for Disease prevention and control) (2017). EU Guideline for the prudent use of antimicrobial in human health.
https://ec.europa.eu/health/amr/sites/amr/files/amr_guidelines_prudent_use_en.pdf
https://www.ema.europa.eu/en/documents/report/sales-veterinary antimicrobial-agents-30-european-countries-2016-trends-2010-2016-eighth-esvac_en.pdf
Millanao, A.; Mora, A.; Villagra, N.; Bucarey, S. e Hidalgo, A. (2021). Biological Effects of Quinolones: A Family of Broad-Spectrum Antimicrobial Agents. Molecules. Nov 25;26(23):7153.
Ovung, A.; Bhattacharyya, J. (2021). Sulfonamide drugs: structure, antibacterial property, toxicity, and biophysical interactions. Biophysical Reviews, 13: 259-272.
Perez-Trallero, D.V. Tetraciclinas, sulfamidas y metronidazol. Enferm Infecc Microbiol Clin 2010; 28:122-30. 10.1016
Riviere, J.E.; Papich, M.G. (2017) Journal of Veterinary Pharmacology and Therapeutics. 10th ed. Wiley- Blackwell.
Scott, H.M.; Acuff, G.; Bergeron, G.; Bourassa, M.W.; Gill, J.; Graham, D.W.; (2019) Critically important antibiotics: criteria and approaches for measuring and reducing their use in food animal agriculture. Annals of the New York Academy of Sciences, 2019, 1441: 8-16.
Silva J. M. B.; Hollembach, C.B. (2010) Fluoroquinolonas X resistência bacteriana na medicina veterinária. Arquivos do Instituto Biológico de São Paulo, 77(2):363-369.
Stahl, J.; Zessel, K.; Schulz, J.; Finke, J.H., Müller-Goymann, C.C.; Kietzmann M. (2016). The effect of miscellaneous oral dosage forms on the environmental pollution of sulfonamides in pig holdings. BMC Veterinary Research 12: 68.
Vicente, D.; Pérez-Trallero, E. (2010). Tetraciclinas, sulfamidas y metronidazol. Enfermedades Infecciosas y Microbiología Clínica, 28(2): 122-130.
Yang, F.; Liu, Y.; Li, Z.; Wang, Y.; Liu M.B.;, Zhao, Z.; Zhou, B. y Wang, G. (2017) Tissue distribution of marbofloxacin in pigs after a single intramuscular injection. J Vet Scim, Jun 30;18(2):169-173.
[/registrados]
