LAS CAUSAS DEL ESTRÉS EN LOS CERDOS SON MULTIFACTORIALES Y PUEDEN CLASIFICARSE COMO SOCIALES, AMBIENTALES, METABÓLICAS, INMUNOLÓGICAS O ASOCIADAS AL MANEJO8
Para leer más contenidos de porciSapiens Julio 2021
Para leer más contenidos de porciSapiens Julio 2021
| El bienestar animal en la producción porcina intensiva se ha convertido en un tema cada vez más relevante para la opinión pública en los últimos años1.
Se ha demostrado que las jaulas de partos restringen a las cerdas, no sólo en su locomoción sino también en otros comportamientos naturales2, lo que les provoca estrés. Los sistemas de alojamiento libre, sin jaulas de parto, parecen ser ventajosos en este sentido3, por lo que actualmente se están estudiando distintos sistemas alternativos para mejorar el bienestar animal. Para evaluar los sistemas de alojamiento en relación al bienestar animal, se utilizan indicadores específicos que se centran, sobre todo, en los impactos físicos y en el comportamiento de las cerdas4. Sin embargo, un sistema de alojamiento también se debe evaluar en relación al nivel de estrés que experimentan los animales en él5. Por ello, los estudios que comparan diferentes sistemas de alojamiento suelen incluir también la medición de marcadores de niveles de estrés. |
CORTISOL
BIOMARCADOR DE ESTRÉS
Un método muy utilizado para cuantificar el estrés es medir el nivel de cortisol en los fluidos corporales o en las secreciones como biomarcador.
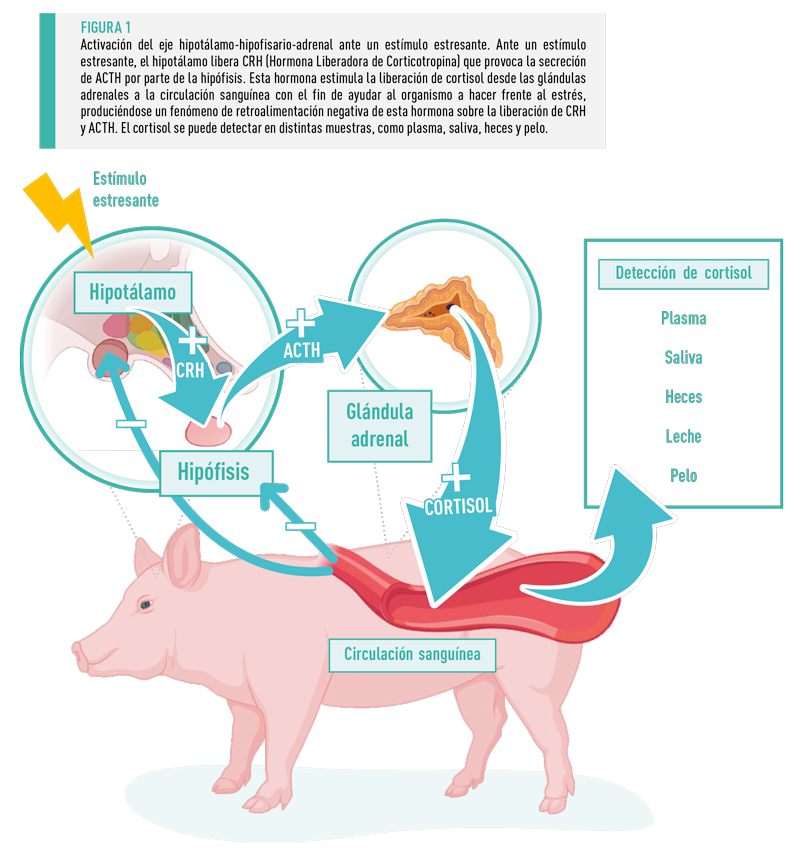
El cortisol es el principal glucocorticoide en la mayoría de los mamíferos6 y es producido y liberado en la sangre por las glándulas adrenales tras el estímulo por parte de la hormona adrenocorticotrópica (ACTH). Esta hormona es liberada por el eje hipotálamo-hipófisis-adrenal (eje HHA) que se activa7 cuando el animal se enfrenta a un factor estresante.
![]() En caso de estrés crónico, un nivel elevado de glucocorticoides a largo plazo puede ser perjudicial en muchos sentidos9.
En caso de estrés crónico, un nivel elevado de glucocorticoides a largo plazo puede ser perjudicial en muchos sentidos9.
LAS CAUSAS DEL ESTRÉS EN LOS CERDOS SON MULTIFACTORIALES Y PUEDEN CLASIFICARSE COMO SOCIALES, AMBIENTALES, METABÓLICAS, INMUNOLÓGICAS O ASOCIADAS AL MANEJO8
Se pueden utilizar varias muestras para el análisis del nivel de cortisol como[registrados] plasma, saliva, orina, heces, leche y pelo7,10.
Debido al rápido aumento tras la aparición de un estímulo y a la disminución igualmente rápida tras su eliminación, los niveles de cortisol en plasma y saliva son muestras puntuales muy variables. En la orina y las heces el cortisol representa solamente un período de 24 horas o menos de una situación de estrés, por lo que ninguna de estas muestras proporciona una visión a largo plazo de la actividad del eje HHA11,12.
DETECCIÓN DE CORTISOL EN EL PELO
Koren et al.13 realizaron uno de los primeros estudios sobre la posibilidad de medir el cortisol en el pelo de los animales. Desde entonces, la investigación sobre este tema se ha intensificado cada vez más para poder medir esta hormona como biomarcador de estrés crónico12. Además de permitir un análisis a largo plazo, la obtención de pelo es un método no invasivo, y el procedimiento de toma de muestras no influye en los valores medidos. Por el contrario, la toma de muestras de sangre es estresante y dolorosa, pudiendo afectar a los niveles de cortisol detectado en el plasma11.
VÍAS DE ACUMULACIÓN DE CORTISOL EN EL PELO
![]()
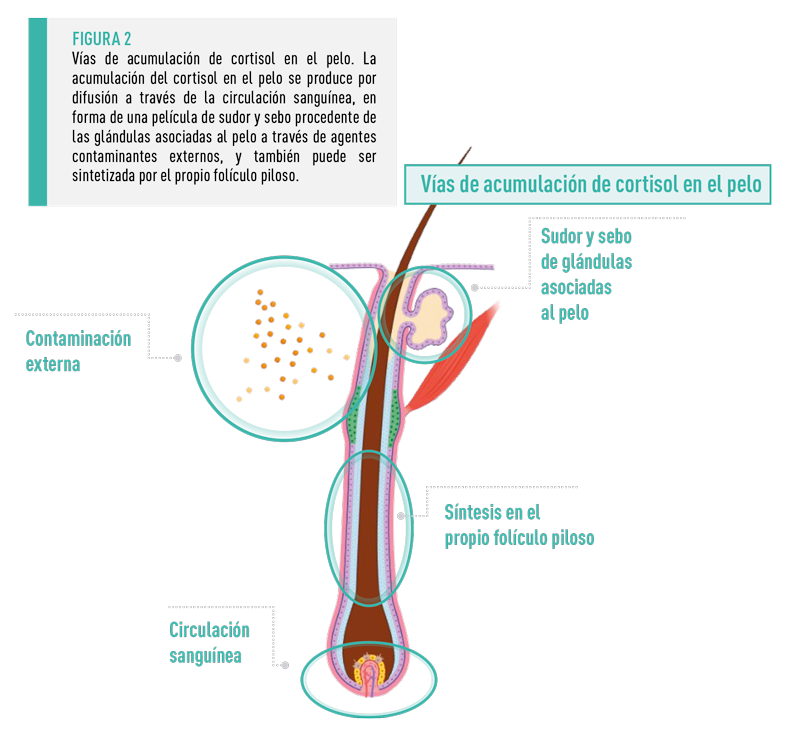
![]() Para explicar las formas de acumulación del cortisol en el tallo piloso, se suele sugerir como hipótesis básica el modelo multicompartimental14. Según este modelo, la acumulación de cortisol en el pelo no sólo se produce por difusión desde la sangre hasta el folículo durante la fase anágena de la formación del pelo, sino que también puede incorporarse al pelo en la forma de una película de sudor y sebo procedente de las glándulas asociadas al pelo.
Para explicar las formas de acumulación del cortisol en el tallo piloso, se suele sugerir como hipótesis básica el modelo multicompartimental14. Según este modelo, la acumulación de cortisol en el pelo no sólo se produce por difusión desde la sangre hasta el folículo durante la fase anágena de la formación del pelo, sino que también puede incorporarse al pelo en la forma de una película de sudor y sebo procedente de las glándulas asociadas al pelo.
 Otra forma posible es la incorporación de cortisol al pelo a través de sustancias externas procedentes del entorno, después de que haya crecido más allá de la capa externa de la piel. En este caso, sería incluso concebible que el cortisol se pueda incorporar tras la toma de muestras, contribuyendo a su contaminación.
Otra forma posible es la incorporación de cortisol al pelo a través de sustancias externas procedentes del entorno, después de que haya crecido más allá de la capa externa de la piel. En este caso, sería incluso concebible que el cortisol se pueda incorporar tras la toma de muestras, contribuyendo a su contaminación.
 El cortisol puede ser sintetizado y secretado por el propio folículo piloso en respuesta a estresores locales en la piel y el pelo. Dado que esta reacción es independiente de la actividad del eje HHA central, cabe suponer que existe un eje de estrés “periférico” adicional, con su propia respuesta de estrés local además de la reacción sistémica15,16.
El cortisol puede ser sintetizado y secretado por el propio folículo piloso en respuesta a estresores locales en la piel y el pelo. Dado que esta reacción es independiente de la actividad del eje HHA central, cabe suponer que existe un eje de estrés “periférico” adicional, con su propia respuesta de estrés local además de la reacción sistémica15,16.
Teniendo en cuenta todos estos posibles orígenes, la cuestión sigue siendo hasta qué punto la concentración de cortisol en el pelo está influida por los niveles de cortisol sistémico y si realmente refleja la actividad del eje HHA.
Algunos estudios han demostrado que el nivel de cortisol en el pelo aumenta con niveles plasmáticos más elevados o tras la administración de ACTH de forma experimental17-19. Así, la concentración de cortisol dependiente del eje HHA en el pelo parece ser lo suficientemente elevada como para poder considerarla como una muestra apropiada para la identificación del estrés crónico.
CORTISOL EN PELO VS SISTEMA DE ALOJAMIENTO

El objetivo de este estudio fue explorar la aplicabilidad de la medición del cortisol en el pelo para evaluar el nivel de estrés crónico en cerdas alojadas en distintos tipos de alojamiento en maternidad.
MATERIAL & MÉTODOS
![]()
| DISEÑO EXPERIMENTAL El estudio se realizó entre junio de 2018 y enero de 2019 en Alemania y se compararon dos sistemas de alojamiento en maternidad distintos: corrales convencionales con jaulas de partos (FC) y un sistema de alojamiento libre sin jaulas de partos (LH):
|
Ambos sistemas estaban equipados con el mismo tipo de suelo de slat y estaban sujetos a los mismos procedimientos de gestión. Además, en ambos casos se proporcionó un saco de yute como material de construcción del nido y cuerdas de algodón como material manipulable adicional, instalando también un estante con heno en cada corral del sistema LH.
El manejo de la alimentación en los dos sistemas fue el mismo: las cerdas recibían una dieta de lactación dos veces al día. La cantidad de pienso se racionó durante los días previos al parto (un máximo de 5 kg/día) y el día del parto (un máximo de 2 kg/día). Tras el parto, la cantidad de alimento se incrementó en unos 0,5 kg/día hasta alcanzar un nivel de alimentación ad libitum al cabo de unos 14 días (8-9 kg/día).
En un total de seis lotes, se obtuvieron datos de 69 cerdas. En cinco de ellos, se registraron los datos de todos los parámetros de todas las cerdas (n = 60) y con el fin de aumentar el número de muestras de pelo para los análisis de cortisol, se añadió un lote adicional.
Como algunas cerdas fueron enviadas al matadero antes de la toma de muestras de pelo y no fue posible medir la longitud del pelo de todos los animales, se redujo ligeramente el número de cerdas a examinar para varios parámetros.
TOMA DE MUESTRAS DE PELO
Mediante el uso de maquinillas eléctricas, se afeitó una zona bilateral simétrica de 20 × 30 cm en la zona de transición entre el cuello y las escápulas (Figura 3) lo más próxima posible a la piel.
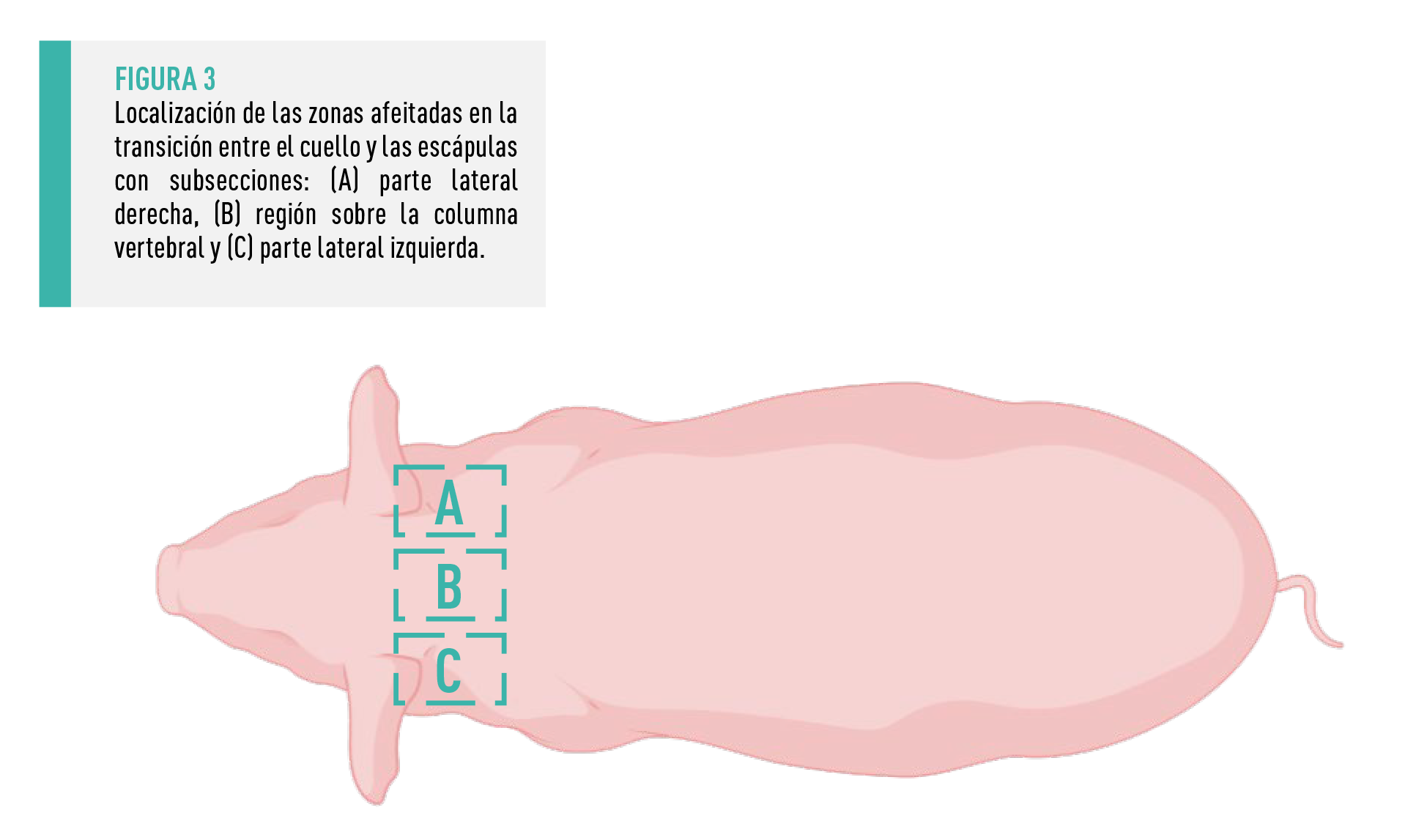
Con el fin de obtener muestras del pelo de nuevo crecimiento representativas del período de estancia en la maternidad, se afeitó la superficie de interés dos veces (Figura 4).
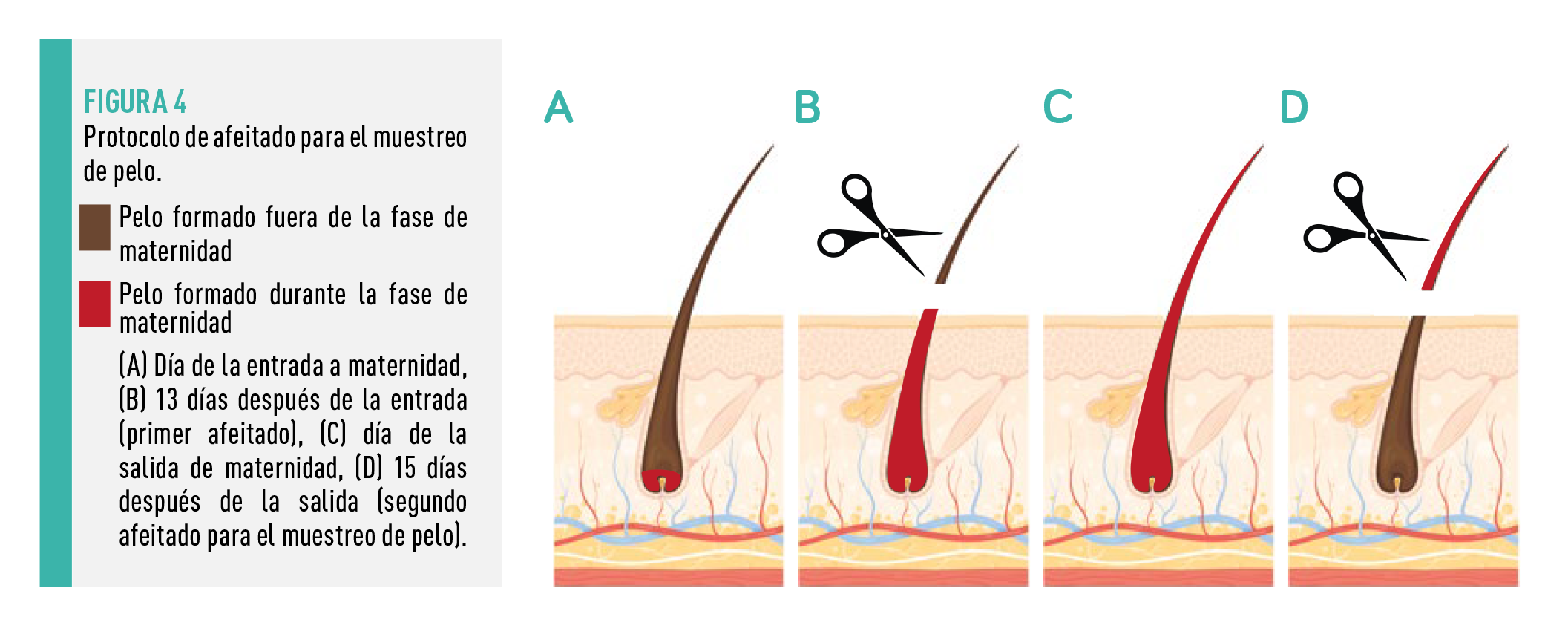
![]() Primer afeitado: teniendo en cuenta que el tallo piloso tiene una profundidad en la piel de 3-4 mm20 y una supuesta tasa de crecimiento de 0,7 cm/mes21, se estima que tarda unas 2 semanas en alcanzar la capa más externa de la piel. Por ello, se afeitó a las cerdas 13 días después de entrar a las instalaciones de maternidad, obteniéndose así muestras de pelo representativas del periodo de estudio.
Primer afeitado: teniendo en cuenta que el tallo piloso tiene una profundidad en la piel de 3-4 mm20 y una supuesta tasa de crecimiento de 0,7 cm/mes21, se estima que tarda unas 2 semanas en alcanzar la capa más externa de la piel. Por ello, se afeitó a las cerdas 13 días después de entrar a las instalaciones de maternidad, obteniéndose así muestras de pelo representativas del periodo de estudio.
 Segundo afeitado: para asegurarse de que el pelo formado durante el periodo experimental había crecido fuera de la piel, se afeitó a las cerdas 15 días después de salir de las instalaciones de maternidad, es decir, 35 días después de su primer afeitado.
Segundo afeitado: para asegurarse de que el pelo formado durante el periodo experimental había crecido fuera de la piel, se afeitó a las cerdas 15 días después de salir de las instalaciones de maternidad, es decir, 35 días después de su primer afeitado.
Se analizó un total de 61 muestras (31 de cerdas FC y 30 de cerdas LH) y para cada sección se determinó la longitud de cinco pelos por cerda, calculando la tasa de crecimiento del pelo durante un periodo de 30 días para comparar los resultados con los de estudios anteriores.
DETERMINACIÓN DE LA CONCENTRACIÓN DE CORTISOL EN EL PELO
La concentración de cortisol en el pelo se analizó mediante un inmunoensayo comercial con detección por quimioluminiscencia.
RESULTADOS
![]()
TASA DE CRECIMIENTO DEL PELO
Se encontraron diferencias muy significativas en la tasa de crecimiento del pelo entre las distintas regiones de la zona afeitada. Mientras que el pelo de las zonas laterales creció de forma casi idéntica a lo largo de 30 días (lado izquierdo: 7,48 ± 3,52mm, lado derecho: 7,44 ± 3,24mm), hubo un crecimiento considerablemente mayor en la zona de 10 cm de ancho por encima de la columna vertebral (12,27 ± 3,95mm).
CONCENTRACIÓN DE CORTISOL EN EL PELO

El promedio de la concentración de cortisol en pelo no difirió significativamente entre los sistemas de alojamiento en maternidad (LH: 1,85 + 0,82 pg/mg, FC: 2,13 + 1,53 pg/mg, P = 0,631) (Tabla 1).
La concentración de cortisol en pelo tampoco se vio afectada por la paridad de las cerdas, el número de lechones nacidos vivos, el número de lechones destetados, la puntuación de lesiones cutáneas, la puntuación de lesiones mamarias, la pérdida de peso corporal individual durante el periodo de estudio, la aparición de estereotipias o las condiciones ambientales en las instalaciones (P > 0,05).

NO HUBO DIFERENCIAS SIGNIFICATIVAS EN LOS NIVELES DE CORTISOL EN PELO ENTRE LOS SISTEMAS COMPARADOS
| DISCUSIÓN
TASA DE CRECIMIENTO DEL PELO Para utilizar la concentración de cortisol en pelo como biomarcador retrospectivo del nivel de estrés, es importante conocer la velocidad de crecimiento del pelo. Se debe tener en cuenta que la variación de la velocidad de crecimiento del pelo en las distintas regiones del cuerpo puede dar resultados diferentes al determinar la concentración de cortisol en las muestras dentro del mismo período de estudio22. Por ello, determinar la tasa de crecimiento del pelo es indispensable a la hora de evaluar el cortisol en pelo como indicador del estrés crónico durante un periodo de tiempo específico. Actualmente, no existe un procedimiento estandarizado para la toma de muestras de pelo en cerdos, siendo necesario identificar las regiones corporales más adecuadas para obtener resultados fiables y representativos. Se ha demostrado que la concentración de cortisol en el pelo a nivel del cuello es inferior que en la región lumbar22, que a su vez es inferior al de la cola23. Asimismo, la tasa de crecimiento del pelo en estas regiones difiere significativamente, siendo más baja a nivel del cuello23. En este estudio, la tasa de crecimiento del pelo en las zonas laterales de la región afeitada fue casi idéntica a la descrita por Bacci et al.21 en la región de la grupa de las cerdas y similar a las encontradas por Heimbürge et al.23 en el cuello. Sin embargo, se encontraron variaciones en la tasa de crecimiento en la zona encima de la columna vertebral con respecto a las zonas laterales de la región afeitada. Así, mientras que Heimbürge et al.23 revelaron diferencias en la tasa de crecimiento del pelo entre las distintas regiones corporales, el presente estudio también aporta pruebas de que tales diferencias se dan dentro de una misma región corporal en los cerdos. Este hallazgo, que podría influir en los resultados de las mediciones de la concentración de cortisol en pelo, debería tenerse en cuenta en futuros estudios. |
LA VARIACIÓN EN LA TASA DE CRECIMIENTO DEL PELO EN DISTINTAS REGIONES Y SUBREGIONES CORPORALES PUEDE INFLUIR LA REPRESENTATIVIDAD Y FIABILIDAD DE LOS RESULTADOS OBTENIDOS AL MEDIR LA CONCENTRACIÓN DE CORTISOL
CONCENTRACIÓN DE CORTISOL EN EL PELO
Se asume que el estrés crónico puede provocar un aumento o una disminución de la respuesta del eje HHA en diferentes momentos a lo largo de una situación estresante: la activación del HHA y unos niveles elevados de cortisol al principio pueden ir seguidos de una respuesta de contrarregulación a lo largo del tiempo, con unos niveles de glucocorticoides por debajo de lo normal por mecanismos de retroalimentación24.
La adaptación a los llamados estresores homotípicos recurrentes o persistentes en términos de una regulación del eje HHA, con una respuesta fisiológica disminuida en comparación con las respuestas de estrés agudo, se conoce como “habituación”.
Este fenómeno depende de las particularidades de la situación de estrés, como la gravedad, la forma de presentación y la duración25, y es específico del factor estresante26. Sin embargo, el eje HHA no se habitúa a los estresores especialmente amenazantes27.
El confinamiento de las cerdas en jaulas podría considerarse una causa de estrés crónico, de modo que, aunque la hipercortisolemia relacionada con el alojamiento puede ser transitoria28, la determinación del nivel de cortisol en el pelo se ha recomendado en estudios anteriores como un buen indicador de estrés crónico.
En este estudio, se evaluó si los métodos adaptados de anteriores estudios exitosos de extracción de cortisol del pelo21,22,23 también son aplicables a las cerdas en maternidad alojadas en diferentes sistemas, tratando de identificar diferentes factores de estrés específicos en las salas de maternidad.
Sin embargo, los resultados del estudio no revelaron diferencias significativas en los niveles de cortisol en el pelo entre los sistemas de alojamiento, lo que parece ser parcialmente contradictorio con los resultados de estudios anteriores.
El procedimiento de muestreo podría ser una causa de resultados contradictorios. El método descrito en este estudio fue un intento de mejora con respecto a los métodos anteriores al tener en cuenta el crecimiento del pelo.
Debido al procedimiento estandarizado utilizado, se asume que se obtuvieron resultados significativos, intentando medir el cortisol solamente en pelo formado durante el período de estudio. Para ello, se tuvo en cuenta el tiempo que transcurre entre la incorporación de cortisol en el pelo y la aparición de esta sección de pelo en la superficie cutánea29.
Como este procedimiento no se llevó a cabo en todos los estudios anteriores y en el caso de Bacci et al.21, las muestras de pelo se tomaron de distintas partes del cuerpo, la comparabilidad de los resultados puede ser limitada.
Independientemente de la región del cuerpo seleccionada para la toma de muestras de pelo, es importante muestrear la misma zona en todos los sujetos12.
Casal et al.22 encontraron una menor concentración de cortisol en el pelo de la parte dorsal del cuello de los cerdos en comparación con otras regiones del cuerpo, algo que podría relacionarse con un menor ensuciamiento con heces, por ello, esta región también fue elegida para el muestreo en este estudio.
Bacci et al.21 encontraron que las cerdas tenían valores de cortisol en el pelo más elevados cuando se mantenían en jaulas en comparación con el alojamiento en grupo en la zona de gestación. Sin embargo, los sistemas de alojamiento en gestación son distintos a los de maternidad y los altos niveles de cortisol en las cerdas alojadas en jaulas también pueden explicarse por el aumento sistémico de la concentración de cortisol durante el parto30.
En cambio, en este estudio se compararon los niveles de cortisol en el pelo de las cerdas en diferentes sistemas de alojamiento durante la misma fase del ciclo reproductivo, lo que permite determinar mejor el efecto del sistema de alojamiento. En este caso, ni el sistema de alojamiento ni el peso corporal ni otros factores investigados afectaron a los niveles de cortisol en el pelo de las cerdas.
La mayoría de los estudios anteriores sobre los niveles de estrés de las cerdas en maternidad alojadas en jaulas o sueltas se han basado en la medición del cortisol en saliva o en sangre, por lo tanto, no son directamente comparables con este estudio30-35.

Se considera que el cortisol en el pelo es un indicador de la actividad adrenocortical de las semanas o meses previos12, ya que representa la producción hormonal acumulada durante el periodo de crecimiento del pelo10.
En este estudio, un periodo de investigación bastante largo tras el parto pudo haber “diluido” los niveles de cortisol más elevados durante el periparto al ir seguidos de valores de cortisol más bajos después. En consecuencia, las diferencias en los niveles de estrés entre los dos sistemas de alojamiento en nuestro estudio podrían no ser tan evidentes al medir el cortisol en el pelo.
Este estudio no puso de manifiesto otros factores que influyeran en los niveles de cortisol en el pelo de las cerdas, como el número de lechones lactantes o destetados. Esto podría explicarse por la habituación a los constantes factores estresantes durante el periodo de estudio.
Se comprobó que el amamantamiento es un factor de estrés para las cerdas, ya que se encontraron niveles plasmáticos de cortisol más altos el día antes del destete en comparación con el día después del destete. Mientras que el procedimiento de destete es breve, un período de lactación más largo puede tener un mayor impacto en los niveles de cortisol. Aparte de la posibilidad de que los estímulos no sean lo suficientemente estresantes como para causar niveles elevados de cortisol en las cerdas36, existe la posibilidad de una regulación a la baja del eje HHA en este caso. También es posible que los estresores dominantes con mayor influencia en los niveles de cortisol enmascaren el impacto de otros estresores de menor efecto en el eje HHA. Por tanto, la influencia de estos otros estresores (por ejemplo, el sistema de alojamiento) podría no estar representada por los valores de cortisol registrados.
Por último, también cabe pensar que la medición del cortisol en el pelo de los cerdos no es el método más adecuado para determinar los niveles de estrés.
Heimbürge et al.37 no encontraron diferencias en la concentración de cortisol en el pelo entre cerdos previamente tratados con ACTH y cerdos control, mientras que en el ganado vacuno sí se encontró un efecto del tratamiento con ACTH sobre el nivel de cortisol en el pelo. Los autores concluyeron que esto puede estar relacionado con una menor respuesta sistémica del cortisol en los cerdos, aunque tampoco se puede descartar un menor crecimiento estacional del pelo o una contaminación cruzada externa del mismo.
CONCLUSIONES

Sigue siendo cuestionable el uso rutinario de la concentración de cortisol en el pelo en cerdas para comparar el efecto de diferentes sistemas de maternidad sobre el bienestar animal y es importante seguir investigando sobre la evolución temporal de los niveles de cortisol registrados en el pelo para validar los valores medidos.
Además, la tasa de crecimiento del pelo debería tenerse en cuenta en futuros estudios a la hora de medir la concentración de cortisol en el pelo. Sólo si el pelo recogido crece de forma más o menos homogénea se puede definir el periodo de tiempo del análisis del pelo.
EN FUTUROS ESTUDIOS DEBERÍAN TENERSE EN CUENTA LAS DIFERENCIAS REGIONALES EN LA TASA DE CRECIMIENTO DEL PELO DENTRO DE LA MISMA ZONA AFEITADA
REFERENCIAS
1. Lassen J, Sandøe P, Forkman B. Happy pigs are dirty! – conflicting perspectives on animal welfare. Livestock Sci. (2006) 103:221–30. doi: 10.1016/j.livsci.2006.05.008
2. EFSA (European Food Safety Authority). Scientific opinion of the panel on animal health and welfare on a request from the commission on animal health and welfare aspects of different housing and husbandry systems for adult breeding boars, pregnant, farrowing sows and unweaned piglets. EFSA J. (2007) 572:1–13. doi: 10.2903/j.efsa.2007.572
3. Pedersen LJ,Malmkvist J, Andersen HML. Housing of sows during farrowing: a review on pen design, welfare and productivity. In: Aland A, Banhazi T, editors. Livestock Housing: Modern Management to Ensure Optimal Health and Welfare of Farm Animals. Wageningen Academic Publishers (2013). p. 93–111. doi: 10.3920/978-90-8686-771-4_05
4. EFSA (European Food Safety Authority). EFSA panel on animal health and welfare (AHAW); scientific opinion on the use of animal-based measures to assess welfare in pigs. EFSA J. (2012) 10:2512. doi: 10.2903/j.efsa.2012.2512
5. Mkwanazi MV, Ncobela CN, Kanengoni AT, Chimonyo M. Effects of environmental enrichment on behaviour, physiology and performance of pigs – A review. Asian Austr J Anim Sci. (2019) 32:1–13. doi: 10.5713/ajas.17.0138
6. Matteri RL, Carroll JA, Dyer CJ. Neuroendocrine responses to stress. In: Moberg GP, Mench JA, editors. The Biology of Animal Stress: Basic Principles and Implications for AnimalWelfare.Wallingford: CABI Publishing (2000).
7. Mormède P, Andanson S, Aupérin B, Beerda B, Guémené D, Malmkvist J, et al. Exploration of the hypothalamic-pituitary-adrenal function as a tool to evaluate animal welfare. Physiol Behav. (2007) 92:317–39. doi: 10.1016/j.physbeh.2006.12.003
8. Martínez-Miró S, Tecles F, Ramón M, Escribano D, Hernández F, Madrid J, et al. Causes, consequences and biomarkers of stress in swine: an update. BMC Vet Res. (2016) 12:171. doi: 10.1186/s12917-016-0791-8
9. Herman JP. Neural control of chronic stress adaption. Front Behav Neurosci. (2013) 7:61. doi: 10.3389/fnbeh.2013.00061
10. Russell E, Koren G, Rieder M, Van Uum S. Hair cortisol as a biological marker of chronic stress: current status, future directions and unanswered questions. Psychoneuroendocrinology. (2012) 37:589–601. doi: 10.1016/j.psyneuen.2011.09.009
11. Davenport MD, Tiefenbacher S, Lutz CK, Novak MA, Meyer JS. Analysis of endogenous cortisol concentrations in the hair of rhesus macaques. Gen Comp Endocrinol. (2006) 147:255–61. doi: 10.1016/j.ygcen.2006. 01.005
12. Meyer JS, Novak MA. Minireview: hair cortisol: a novel biomarker of hypothalamic-pituitary-adrenocortical activity. Endocrinology. (2012) 153:4120–7. doi: 10.1210/en.2012-1226
13. Koren L, Mokady O, Karaskov T, Klein J, Koren G, Geffen E. A novel method using hair for determining hormonal levels in wildlife. Anim Behav. (2002) 63:403–6. doi: 10.1006/anbe.2001.1907
14. Henderson GL. Mechanisms of drug incorporation into hair. Forensic Sci Int. (1993) 63:19–29. doi: 10.1016/0379-0738(93)90256-A
15. Ito N, Ito T, Kromminga A, Bettermann A, Takigawa M, Kees F, et al. Human hair follicles display a functional equivalent of the hypothalamicpituitary-adrenal axis and synthesize cortisol. FASEB J. (2005) 19:1332–4. doi: 10.1096/fj.04-1968fje
16. Sharpley CF, Kauter KG, McFarlane JR. An initial exploration of in vivo hair cortisol responses to a brief pain stressor: latency, localization and independence effects. Physiol Res. (2009) 58:757–61.
17. Kirschbaum C, Tietze A, Skoluda N, Dettenborn L. Hair as a retrospective calendar of cortisol production-increased cortisol incorporation into hair in the third trimester of pregnancy. Psychoneuroendocrinology. (2009) 34:32–7. doi: 10.1016/j.psyneuen.2008.08.024
18. Thomson S, Koren G, Fraser LA, RiederM, Friedman TC, Van Uum SH. Hair analysis provides a historical record of cortisol levels in Cushing’s syndrome. Exp Clin Endocrinol Diabetes. (2010) 118:133–8. doi: 10.1055/s-0029-1220771
19. González-de-la-Vara Mdel R, Valdez RA, Lemus-Ramirez V, Vázquez- Chagoyán JC, Villa-Godoy A, Romano MC. Effects of adrenocorticotropic hormone challenge and age on hair cortisol concentrations in dairy cattle. Can J Vet Res. (2011) 75:216–21.
20. MowafyM, Cassens RG. Hair growth in the domestic pig-histological aspects. J Am Leather Chem Assoc. (1976) 71:64–70.
21. Bacci ML, Nannoni E, Govoni N, Scorrano F, Zannoni A, Forni M, et al. Hair cortisol determination in sows in two consecutive reproductive cycles. Reprod Biol. (2014) 14:218–23. doi: 10.1016/j.repbio.2014.06.001
22. Casal N, Manteca X, Peña LR, Bassols A, Fàbrega E. Analysis of cortisol in hair samples as an indicator of stress in pigs. J Vet Behav. (2017) 19:1–6. doi: 10.1016/j.jveb.2017.01.002
23. Heimbürge S, Kanitz E, Tuchscherer A, Otten W. Within a hair’s breadth – factors influencing hair cortisol levels in pigs and cattle. Gen Comp Endocrinol. (2020) 288:113359. doi: 10.1016/j.ygcen.2019.113359
24. Miller GE, Chen E, Zhou ES. If it goes up, must it come down? Chronic stress and the hypothalamic-pituitary-adrenocortical axis in humans. Psychol Bull. (2007) 133:25–45. doi: 10.1037/0033-2909.133.1.25
25. Grissom N, Bhatnagar S. Habituation to repeated stress: get used to it. Neurobiol Learn Mem. (2009) 92:215–24. doi: 10.1016/j.nlm.2008.07.001
26. Jean Kant G, Eggleston T, Landman-Roberts L, Kenion CC, Driver GC, Meyerhoff JL. Habituation to repeated stress is stressor specific. Pharmacol Biochem Behav. (1985) 22:631–4. doi: 10.1016/0091-3057(85)90286-2
27. Figueiredo HF, Bodie BL, TauchiM,Dolgas CM, Herman JP. Stress integration after acute and chronic predator stress: differential activation of central stress circuitry and sensitization of the hypothalamo-pituitary-adrenocortical axis. Endocrinology. (2003) 144:5249–58. doi: 10.1210/en.2003-0713
28. Janssens CJ, Helmond FA, Wiegant VM. The effect of chronic stress on plasma cortisol concentrations in cyclic female pigs depends on the time of day. Domest Anim Endocrinol. (1995) 12:167–77. doi: 10.1016/0739-7240(94)00018-V
29. Heimbürge S, Kanitz E, Otten W. The use of hair cortisol for the assessment of stress in animals. Gen Comp Endocrinol. (2019) 270:10–7. doi: 10.1016/j.ygcen.2018.09.016
30. Lawrence AB, Petherick JC, McLean KA, Deans LA, Chirnside J, Gaughan A, et al. The effect of environment on behaviour, plasma cortisol and prolactin in parturient sows. Appl Anim Behav Sci. (1994) 39:313–30. doi: 10.1016/0168-1591(94)90165-1
31. Biensen NJ, von Borell EH, Ford SP. Effects of space allocation and temperature on periparturient maternal behaviors, steroid concentrations, and piglet growth rates. J Anim Sci. (1996) 74:2641–8. doi: 10.2527/1996.74112641x
32. Jarvis S, Calvert SK, Stevenson J, van Leeuwen N, Lawrence AB. Pituitaryadrenal activation in pre-parturient pigs (Sus scrofa) is associated with behavioural restriction due to lack of space rather than nesting substrate. Anim Welfare. (2002) 11:371–84.
33. Oliviero C, Heinonen M, Valros A, Hälli O, Peltoniemi OA. Effect of the environment on the physiology of the sow during late pregnancy, farrowing and early lactation. Anim Reprod Sci. (2008) 105:365–77. doi: 10.1016/j.anireprosci.2007.03.015
34. Hales J, Moustsen VA, Nielsen MBF, Hansen CF. The effect of temporary confinement of hyperprolific sows in Sow Welfare and Piglet protection pens on sow behaviour and salivary cortisol concentrations. Appl Anim Behav Sci. (2016) 183:19–27. doi: 10.1016/j.applanim.2016.07.008
35. Goumon S, Leszkowová I, Šimecková M, Illmann G. Sow stress levels and behavior and piglet performances in farrowing crates and farrowing pens with temporary crating. J Anim Sci. (2018) 96:4571–8. doi: 10.1093/jas/sky324
36. Schmitt O, Baxter EM, Boyle LA, O’Driscoll K. Nurse sow strategies in the domestic pig: I. Consequences for selected measures of sow welfare. Animal. (2019) 13:580–9. doi: 10.1017/S175173111800160X
37. Heimbürge S, Kanitz E, Tuchscherer A, Otten W. Is it getting in the hair? – Cortisol concentrations in native, regrown and segmented hairs of cattle and pigs after repeated ACTH administrations. Gen Comp Endocrinol. (2020) 295:113534. doi: 10.1016/j.ygcen.2020.113534
[/registrados]
