
Os fatores relacionados à mortalidade pós-desmane podem ser identificados e priorizados para os quais estratégias podem ser implementadas para gerenciar de forma abrangente e reduzir a mortalidade. Os fatores que contribuem para a mortalidade muitas vezes não são claramente definidos. Confira os principais fatores não infecciosos responsáveis pela mortalidade pós-desmame!

A mortalidade pós-desmame é uma matriz causal complexa que envolve fatores animais, ambientais e etiológicos infecciosos. Apesar dos avanços na suinocultura intensiva, como:

Houve melhorias modestas ou inexistentes nas taxas de mortalidade pós-desmame nos últimos anos. As médias da indústria para mortalidade pós-desmame variam de 4 a 8% para cada fase do sistema de produção, creche, crescimento e terminação.
Os fatores relacionados à mortalidade pós-desmane podem ser identificados e priorizados para os quais estratégias podem ser implementadas para gerenciar de forma abrangente e reduzir a mortalidade. Os fatores que contribuem para a mortalidade muitas vezes não são claramente definidos.

Além disso, o fato de que muitas das causas componentes da mortalidade muitas vezes não precisam ocorrer simultaneamente, ou seja, um evento específico pode aumentar a gravidade de um evento posterior. A causa da mortalidade costuma ser muito difícil de entender, mas uma etapa importante é a identificação das possíveis causas dos componentes contribuintes e a tentativa de identificar e quantificar os efeitos interativos.

Sumarizar o estado atual do conhecimento sobre os fatores não infecciosos que contribuem para a mortalidade pós-desmame, com foco nas estimativas de frequência de ocorrências de mortalidade e magnitude do efeito sobre a mortalidade em uma população quando o fator está presente.
A mortalidade pós-desmame pode ser generalizada em fatores não infecciosos e infecciosos (Figura 1), com fatores não infecciosos ainda classificados em:
Vários fatores contribuem, e a contribuição é relativa e extremamente difícil de diferenciar. De agora em diante, toda a discussão a respeito da contribuição de vários fatores na mortalidade pós-desmame é feita com o claro reconhecimento de que a causa imediata e final da mortalidade muitas vezes não é clara. No entanto, tentamos contextualizar o alcance do impacto que esses fatores contribuem para a mortalidade pós-desmame.
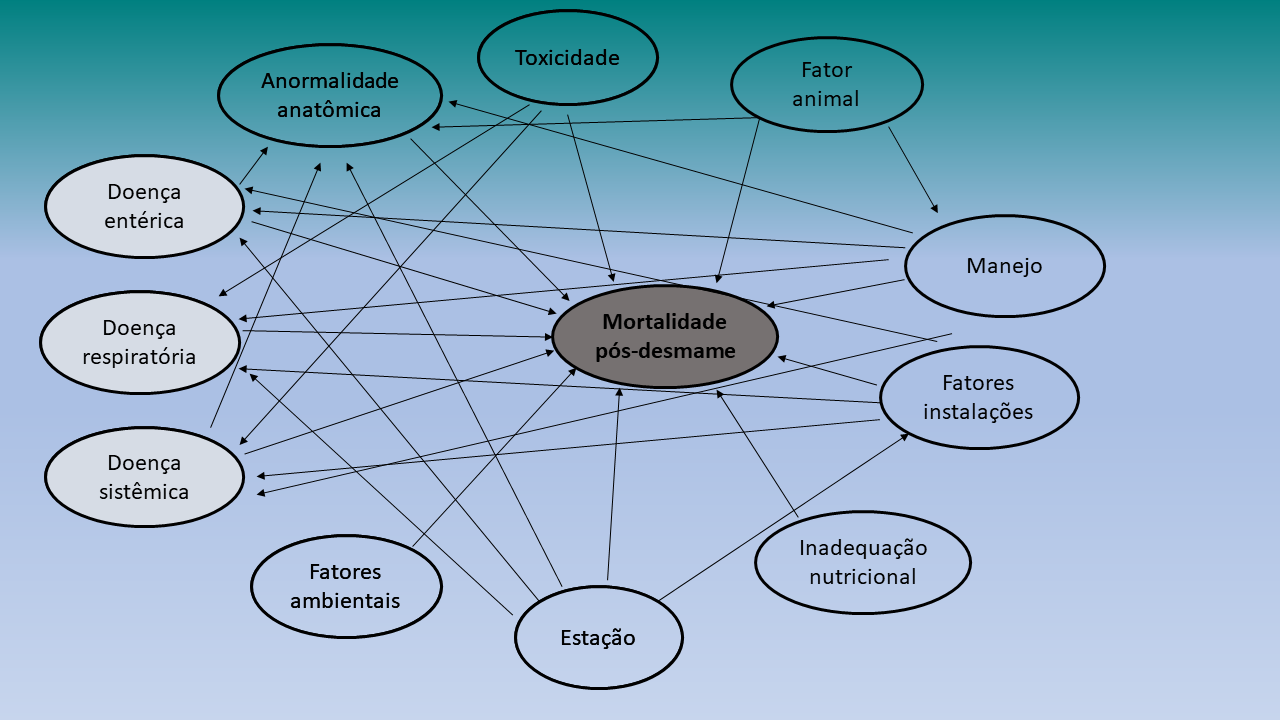
Figura 1: Rede causal de fatores que contribuem para a mortalidade pós-desmame, incluindo causas não infecciosas e infecciosas (cinza). As setas representam o caminho pelo qual uma causa influencia outra causa.
Anormalidades anatômicas podem causar mortalidade direta (por exemplo, torção de órgão abdominal ou vôlvulo) e reduzir a competitividade que leva ao declínio gradual com eutanásia, muitas vezes o resultado (por exemplo, claudicação, hérnia umbilical e prolapso retal). Embora a incidência de anormalidades anatômicas possa variar muito, a taxa de letalidade pode ser muito alta.
A distensão dos órgãos abdominais pode ser classificada em duas causas primárias, são elas:
Fatores que podem levar à torção mesentérica incluem movimento rápido do suíno ou mudanças direcionais, padrão inconsistente de ingestão de ração caracterizado como jejum e ingurgitamento periódico e vísceras distendidas devido à digestão fermentativa (Thomson e Friendship, 2019).
A distensão gasosa do cólon pode ser devida a vários fatores, incluindo dieta e desequilíbrio da microbiota colônica. Isso pode resultar em distensão intestinal subsequente e possivelmente torção, oclusão vascular e morte (Martineau et al., 2008).
Uma quantidade significativa de discussão tem sido focada na síndrome do intestino hemorrágico como causa de morte aguda em suínos na fase de terminação. A síndrome do intestino hemorrágico como um processo de doença independente de vôlvulo/torção permanece especulativa.
A incidência relatada de torção ou vôlvulo de órgão não é amplamente compreendida, mas no geral é relativamente baixa. Uma vez que os órgãos abdominais tenham sido totalmente ocluídos, a mortalidade ocorre rapidamente, resultando em uma alta taxa de letalidade. Pesquisas adicionais são necessárias para entender a causa dos incidentes abdominais agudos e como a incidência pode ser reduzida.
A claudicação pode ser causada por uma série de fatores, incluindo trauma, causas infecciosas resultando em artrite ou osteomielite (Hill et al., 1996; Gomes-Neto et al., 2016), doenças ortopédicas do desenvolvimento, como osteocondrite dissecante, desequilíbrio nutricional resultando em integridade estrutural do sistema esquelético, ou combinação desses fatores (Madson et al., 2019).
Canning et al. (2019) revisaram as submissões de casos laboratoriais de diagnóstico de claudicação em suínos em crescimento e descobriram que 31% dos casos não resultaram em causa conclusiva ou nenhum achado anormal, 42% tiveram um diagnóstico de etiologia infecciosa, enquanto os diagnósticos restantes incluíram doença óssea metabólica, ou outras / causas desconhecidas. É importante observar que as estimativas mencionadas anteriormente foram baseadas em submissões de casos, provavelmente sub-representadas casos que podem ser facilmente diagnosticados em campo.
Estima-se que a claudicação afete entre 0,6% e 2,2% dos suínos em terminação (Krieter et al., 2004; Cagienard et al., 2005; Petersen et al., 2008; Neumann et al., 2014). As rupturas no tegumento podem ser portas de entrada para bactérias e incluem lesões por mordidas na cauda, feridas nos flancos, entre outras, que estima-se que afetem 0,5% a 2% dos suínos em terminação (Cagienard et al., 2005; Petersen et al., 2008 ; Neumann et al., 2014).
Claudicação e lesão física é uma categorização ampla, muitas vezes não levando diretamente à mortalidade, mas sim à morbidade que resulta em competitividade reduzida e eventual abate ou eutanásia.
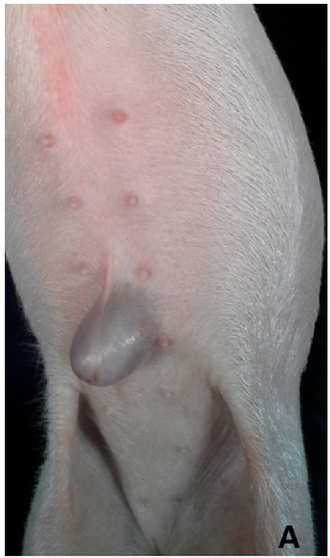
A prevalência de hérnia umbilical foi relatada como sendo de 0,7% a 1,5% em leitões pós-desmame (Searcy-Bernal et al., 1994; Petersen et al., 2008; Straw et al., 2009; Yun et al., 2017; Ramirez , 2019) com taxa de letalidade variando de 0% a 7,2% (Searcy-Bernal et al., 1994; Straw et al., 2009). As hérnias umbilicais muitas vezes não levam à mortalidade em um ambiente comercial devido à prática comum de comercializar animais afetados prematuramente para capturar valor. No geral, essa condição pode resultar em níveis leves de morbidade e mortalidade.
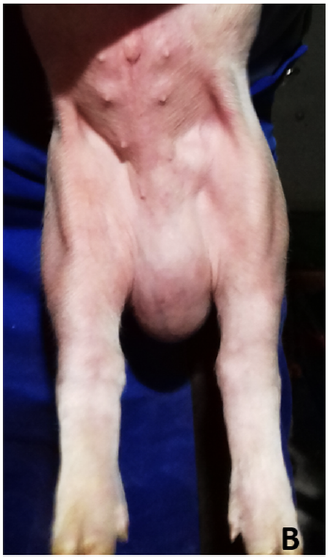
A hérnia escrotal ou inguinal é uma condição em que os órgãos abdominais se estendem além do anel inguinal e se projetam para o canal inguinal (Anderson e Mulon, 2019). Com a hérnia crônica, incluindo deslocamento do intestino, pode ocorrer estrangulamento e causar dor extrema, necrose e morte. Embora a patogênese exata seja desconhecida, foi relatado que a hérnia escrotal/inguinal está associada a linhagens genéticas específicas (Magee, 1951; Grindflek et al., 2006; Ding et al., 2009; Lago et al., 2018). A correção cirúrgica foi descrita por Anderson e Mulon (2019); entretanto, não é comumente realizado em um ambiente comercial. A prevalência de hérnia inguinal foi relatada como sendo de 0,1% a 0,7% com uma taxa de letalidade de 25,0% (Straw et al., 2009).

Se devidamente separados antes do início de um sangramento significativo os suínos podem se recuperar da condição de prolapso; no entanto, o abate precoce e a eutanásia são resultados comuns.
A ulceração gástrica é considerada multifatorial por natureza. Um fator importante que tem sido associado às úlceras gástricas inclui a alimentação, tanto o tamanho da partícula do grão moído quanto a forma da dieta. A alimentação com dietas peletizadas tem sido associada a úlceras gástricas (Robertson et al., 2002). As alterações morfológicas mais graves ocorrem em suínos alimentados com dietas peletizadas imediatamente antes da comercialização por períodos superiores a 2 semanas (De Jong et al., 2016). Além disso, a alimentação com rações peletizadas foi associada a um maior número de suínos removidos do plantel (De Jong et al., 2016). Estudos adicionais relataram que suínos alimentados com dietas peletizadas tinham maior presença de lesões estomacais em comparação a suínos alimentados com dietas úmidas (Grosse Liesner et al., 2009; Cappai et al., 2013; Mosseler et al., 2014). Em muitos desses experimentos, as dietas úmidas tinham um tamanho de partícula mais grosso, confundindo assim a forma da dieta e o tamanho da partícula. Isso resulta em falta de clareza em relação à causa subjacente da associação medida entre a forma de dieta e o risco aumentado de ulceração gástrica. Na ausência de dados adicionais publicados, os sistemas de produção de suínos e as empresas de suporte técnico demonstraram a associação entre a alimentação de pellets e úlceras gástricas.
Vários estudos avaliaram o tamanho das partículas em vários tipos de grãos, incluindo milho, sorgo e trigo e observaram alterações morfológicas no estômago, incluindo queratinização e escores de úlcera. O impacto resultante na mortalidade não está claramente definido na literatura. Investigação adicional em um ambiente comercial usando um grande tamanho de amostra é necessária para determinar se as mudanças morfológicas associadas à alimentação com dietas de tamanho de partícula fina resultam em morbidade e mortalidade. Uma vez que o impacto sobre a mortalidade esteja claramente definido, os resultados podem ser incorporados ao valor econômico das melhorias esperadas na eficiência alimentar para determinar a melhor estratégia de moagem.

A toxicidade pode ocorrer devido a uma lista quase infinita de compostos (naturais e sintéticos) que podem ser introduzidos nos suínos por uma série de rotas, incluindo aerossol, ração e água. Talvez as fontes mais comuns de toxicidade que levam à morte incluam a falta sustentada de acesso à água seguida por um período de disponibilidade repentina levando ao inchaço do cérebro conhecido como toxicidade do íon sódio, intoxicação acidental por ionóforo, seguida por micotoxinas. Embora muitas dessas toxicidades não sejam discutidas em mais detalhes devido à rara incidência, a magnitude do efeito sobre a mortalidade ou a necessidade de despovoar para prevenir danos humanos por meio da ingestão de produtos pode ser grande.
Foi relatado que uma dose de 1 mg / kg de peso corporal de ocratoxina resultou em 38% de mortalidade em leitões quando alimentados por 5 dias (Szczech et al., 1973). Em contraste, observou-se que uma dose mais alta de 2 mg/kg de ocratoxina fornecida aos leitões por 28 dias não teve efeitos letais (Harvey et al., 1989).
A fumonisina tem uma ampla gama de riscos de ataque e fatalidade (Harrison et al., 1990; Haschek et al., 1992; Osweiler et al., 1992; Colvin et al., 1993; Zomborszky et al., 2000), mas na dieta concentrações > 120 mg/kg por um período de 4 dias ou mais estão mais comumente associadas à mortalidade (Ensley e Radke, 2019).
Permanecem questões significativas em relação aos impactos interativos da alimentação de longo prazo com micotoxinas nas doenças, no manejo, na dieta ou em outras causas de mortalidade. As micotoxinas estão frequentemente associadas à morbidade e redução do desempenho. Devido às informações variáveis , mais pesquisas são necessárias para entender melhor o impacto sobre a mortalidade.

O narasin é um ionóforo de aplicação comprovada para aumento da taxa de ganho de peso (15 a 30 g / tonelada) ou melhoria da eficiência alimentar (20 a 30 g / tonelada; FDA, 2018). O fornecimento acidental com doses mais altas, pode ocasionar em toxicidade do ionóforo pode ocorrer levando a alteração do ritmo cardíaco, danos aos miócitos e necrose (McKellar e Lawrence, 1996) com mortalidade significativa quando alimentado com níveis de 139 g/tonelada ou mais (Armien et al., 1997 ; Sturos et al., 2016). Os antibióticos pleuromutilina, como a tiamulina, potencializam a toxicidade dos ionóforos devido à inibição do citocromo P450, reduzindo assim o metabolismo e a depuração dos ionóforos (McKellar e Burch, 1996; Carpenter et al., 2005). Carpenter et al. (2005) relataram que 100% dos suínos inadvertidamente alimentados com narasina a 83 g/tonelada e tiamulina a 31 g/tonelada foram sacrificados após o desenvolvimento de sinais clínicos. A monensina é outro ionóforo comumente usado na alimentação de ruminantes e demonstrou ser letal para suínos a 300 mg/kg (Dilov et al., 1981; Iotsev, 1985). A intoxicação por ionóforo devido a erro de fabricação da ração ocorre em suínos e pode resultar em morbidade e mortalidade significativas.
Uma infinidade de toxinas adicionais tem o potencial em situações únicas de causar mortalidade em suínos pós-desmame. As fontes de toxinas incluem contaminantes da água, como nitratos, nitritos e toxinas produzidas por microorganismos que vivem na água, como algas (Classen et al., 2017). A intoxicação por gás, incluindo sulfeto de hidrogênio, monóxido de carbono, amônia e dióxido de carbono, bem como hipertermia em caso de perda de energia em instalações fechadas e/ou incêndio, também pode levar a uma alta mortalidade. Informações adicionais são discutidas por Ensley e Radke (2019).
Inscreva-se agora para a revista técnica de suinocultura
AUTORES

Programa nutricional para leitões recém-desmamados: redução proteica com suplementação de aminoácidos
Allan Paul Schinckel Amoracyr José Costa Nuñez Kallita L. S. Cardoso Mariana Garcia de Lacerda Vivian Vezzoni de Almeida
Gestão do microclima na maternidade suína: equilíbrio térmico entre porcas e leitões
Cristiano Marcio Alves de Souza Filipe Bittencourt Machado de Souza Jéssica Mansur S. Crusoé Leonardo França da Silva Victor Crespo de Oliveira
Balanço preliminar da suinocultura brasileira em 2025
Iuri Pinheiro Machado
Eco Animal Health reforça presença no Brasil e destaca a relevância do Aivlosin® na suinocultura moderna

DanBred Brasil realiza primeira edição do GPS: Grandes Parceiros da Suinocultura

Parto prolongado, sobrevivência comprometida: evidências do impacto da cinética do parto sobre a asfixia neonatal
Bruno Bracco Donatelli Muro César Augusto Pospissil Garbossa Erich Herzogenrath Cavaca Inácio Matheus Saliba Monteiro Rafaella Fernandes Carnevale Roberta Yukari Hoshino
Sanidade animal não é sobre doença. É sobre ambiente, pessoas e sabedoria
Luiz Felipe Caron
Impacto do uso de antibióticos em leitões após o nascimento
Renato Philomeno
Piglet Protector: Solução inovadora para vitalidade e desempenho de leitões recém-nascidos
Equipe Técnica Biochem Brasil
Impactos de diarreia neonatal na produção de suínos
Jessica Carolina Reis Barbosa Roberto Maurício Carvalho Guedes
Aditivo Improver® como alternativa natural a antimicrobianos melhoradores de desempenho em leitões desmamados
Gefferson Almeida da Silva José Paulo Hiroji Sato Jovan Sabadin Viviana Molnár-Nagy
Do registro às quarentenas: cinco decisões que moldaram a suinocultura gaúcha
Priscila Beck
Consumo de carne suína avança 45% e se aproxima de 20 kg per capita. SNDS aponta próximos passos
Priscila Beck
Quando a tosse custa caro: por que manter a granja livre de Mycoplasma faz diferença?
Cândida Azevedo