El virus de la Influenza porcina es un virus RNA recubierto con el genoma segmentado en 8 partes.
Esta estructura ofrece una gran variabilidad al virus y condiciona en gran medida su patogenicidad y también su diagnóstico.
Cada uno de los 8 segmentos del genoma codifica para distintas proteínas.
6 segmentos codifican distintas proteínas internas y 2 segmentos las proteínas externas (Hemaglutinina – HA y neuroaminidasa – NA).
La HA y NA son la parte más expuesta y las responsables respectivamente de la entrada y salida del virus de la célula, por lo que frente a ellas va dirigida la mayor parte de la respuesta inmune.
Por este motivo, son las proteínas más importantes y las que se emplean para clasificar a los virus de la Influenza en sus distintos subtipos.
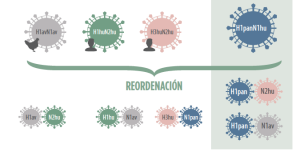
En porcino los principales subtipos son el H1N1, H1N2 y H3N2, con baja reacción cruzada entre ellos. Sin embargo, el tema se complica, porque dentro de la H1, tenemos distintas variantes en función de su origen (aviar, humano o pandémico).
Aunque estas 3 HA pertenecen al mismo grupo (H1), existe poca reacción cruzada entre ellas. Por este motivo es clave identificarlas al realizar un diagnóstico.
En cuanto al resultado, saber que la hemaglutinina del AIV es H1 no nos aporta la información completa del virus ; debemos saber si es un H1av, H1hu o H1pan.
Para acabar de rizar el rizo, los distintos subtipos de AIV pueden reordenarse entre sí cuando 2 virus de subtipos distintos coinfectan a una misma célula al mismo tiempo.
De esta forma podemos, por ejemplo diagnosticar un H1panN2 debido a la reordenación entre un H1panN1 y un H3huN2 o un H1huN2. Así pues, las combinaciones son múltiples y no se restringen únicamente a los 3 subtipos clásicos.
Ahora bien, una vacuna que cubra los 4 principales subtipos, cubre todas sus reordenaciónes entre sí.
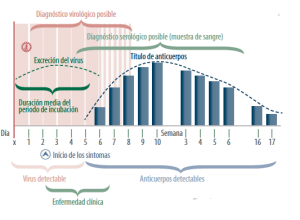
AIV es detectable poco tiempo después de la aparición de la sintomatología (3-5 días) y exclusivamente en el aparato respiratorio (no produce viremia), por lo que el virus nunca es detectable en sangre.
Debido al corto periodo de excreción, para detectar el virus, es importante restringir la toma de muestras a animales con síntomas agudos claros: fiebre alta (>39,5 ºC, o incluso más en cerdas), inanición, letargia, lagrimeo, respiración abdominal y tos.
En algunos casos puede asociarse a abortos o repeticiones acíclicas en cerdas.
Debemos tener en cuenta que al contrario de lo que sucedía hace unos años, AIV se presenta cada vez más de forma endémica, con infecciones recurrentes dentro de la población y con síntomas menos evidentes y afectando a menos animales a la vez.
Para la detección del agente se pueden usar distintas muestras:
La ventaja de las 3 primeras es que vinculan claramente la sintomatología con la enfermedad.
Debido al corto periodo de excreción, la detección del virus en animales individuales con síntomas es muy indicativa de la participación de AIV en el proceso patológico.
Son técnicas muy útiles cuando tenemos animales con síntomas claros (aunque sean pocos).
El lavado traqueobronquial (LTB) presenta la ventaja de poder ampliar el panel diagnóstico a un mayor número de agentes en relación a los hisopos; y en relación a los pulmones, que no necesitamos tener bajas.
Los fluidos orales ofrecen la comodidad de valorar la presencia de virus en varios animales con una sola muestra, lo que es muy útil cuando la prevalencia es baja y los síntomas poco claros.
Sin embargo no siempre establecen un vínculo claro entre síntomatología y enfermedad, por lo que principalmente son útiles para monitorizar animales o granjas.
Por ejemplo, podemos tener procesos en que varios animales se retrasan, coincidiendo con cuerdas positivas a AIV. Sin embargo, no tenemos la seguridad de si el motivo es AIV u otro proceso concomitante (por ejemplo, Glässer). Sin embargo, cuando tomamos muestras individuales de animales afectados con hisopos o LTB y detectamos que una cierta proporción es positiva, el vínculo parece mucho más claro.
Además, los fluidos orales tienen menor carga viral porque AIV está en menor concentración en cavidad oral y además es una muestra más frágil porque contiene inhibidores del virus (sales, enzimas, bacterias) que pueden afectar a su detección por RT-PCR.
Otro problema es que los animales adultos (como las cerdas) suelen prestar poca atención a las cuerdas, por lo que es una técnica aconsejable únicamente en animales jóvenes.
Todas las muestras para detección directa de AIV deben mantenerse en refrigeración (4ºC) y realizar el envío al laboratorio rápidamente. En el caso de los fluidos orales, estas medidas se deben extremar.
La refrigeración debe mantenerse desde el momento de la obtención e incluso es recomendable centrifugar y decantar la muestra obtenida.
Técnicas laboratoriales de detección directa: PCR
El diagnóstico mediante PCR permite detectar en un primer paso la presencia de AIV mediante la identificación de genes que codifican para las nucleoproteínas (M/NP) y en caso positivo subtipar en un segundo paso a partir de una PCR dirigida a la HA y NA.
Algunos laboratorios también disponen de RT-qPCR capaces de determinar el origen de la HA (humana o aviar).
El siguiente ejemplo es positivo a H1avN2 (fruto de una reordenación entre H1avN1 y H1huN2 o H3huN2).
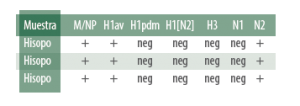
La identificación del origen de las H1 permite determinar si el subtipo presente es pandémico, algo fundamental, puesto que las vacunas registradas hoy en día ofrecen una baja protección frente al AIV pandémico.
Posteriormente también es posible determinar la secuencia genética para realizar un análisis filogenético y conocer la evolución del virus o si se han introducido nuevos virus en la explotación.
Toma de muestras
Los anticuerpos pueden ser detectables a partir de la primera semana post-infección, con un nivel máximo alrededor de las 2-3 semanas p.i., empiezan a disminuir alrededor de los 2 meses y pueden llegar a mantenerse hasta los 8-10 meses pos infección.
El estudio de la seroconversión es muy útil cuando es demasiado tarde para identificar el virus directamente (por ejemplo cuando ya hace una semana que empezaron los síntomas) y permite valorar otras enfermedades para realizar un diagnóstico diferencial.
El estudio de seroconversión en cerdas después de un aborto puede ser fundamental para el diagnóstico diferencial entre influenza, PRRS, mal rojo y leptospirosis, por ejemplo.
Aunque ofrece menos información, una única toma alrededor de las 2-3 semanas post infección nos puede permitir asociar la presencia de títulos altos con la aparición de un brote de AIV.
También nos puede permitir determinar el grado de homogeneidad de una población y usando la técnica de Inhibición de la Hemaglutinación, los subtipos implicados.
Técnicas laboratoriales de detección de anticuerpos: ELISA / Inhibición de la Hemaglutinación
La técnica ELISA no diferencia entre los diferentes subtipos y algunos ELISA son solo cualitativos. Esto lleva a que en ocasiones sea difícil valorar seroconversiones porque en el primer muestreo los animales pueden ya ser positivos frente a subtipos que en ese momento no están involucrados en el proceso clínico de AIV que ha afectado a los animales.
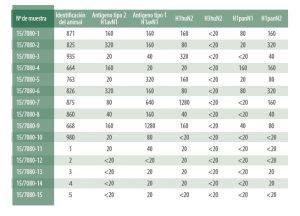
La inhibición de la hemaglutinación (HI) diferencia los distintos subtipos (H1N1, H1N2, H3N2, e incluso las variedades pandémicas H1pdmN1 y H1pdmN2).
Sin embargo el grado de reacción depende de la similitud entre la cepa de referencia empleada en el diagnóstico y la presente en la muestra (cepa campo).
Además, en esta técnica existe cierta reacción cruzada entre los distintos subtipos, por lo que su interpretación puede complicarse en algunas situaciones.
Ejemplo de un resultado de Inhibición de la hemagkutinación en la que se valoran los 3 subtipos clásicos que afectan al cerdo, además de 2 subtipos pandémicos. Puesto que el subtipo H1avN1 es el que tiene mayor variabilidad, en este ejemplo se analizan 2 variantes distintas (tipo 1 y tipo 2).
En la necropsia de pulmones afectados por AIV se observa neumonía bronquiolo-intersticial.
El pulmón no se colapsa y se aprecia consolidación pulmonar concentrada en los lóbulos craneales mayoritariamente que es indiferenciables de la producida por Mycoplasma hyopneumoniae.
Las lesiones también pueden mostrar el típico patrón en tablero de ajedrez. Sin embargo, la contaminación con agentes secundarios suele complicar la observación de lesiones.
La Histopatología permite la observación de lesiones características de AIV: necrosis del epitelio de las vías respiratorias (bronquiolitis necropurulenta).
Estas lesiones, asociadas a la detección del virus mediante PCR o inmunohistoquímica, establecen un diagnóstico claro y permiten realizar un buen diagnóstico diferencial de otros agentes causantes de problemas respiratorios.
CONCLUSIÓN
Suscribete ahora a la revista técnica porcina
AUTORES

Reducir la mortalidad de las cerdas: un caso práctico con resultados y un testimonio
César Bravo Frédéric Laski Tanguy Gicquel
Control de la diarrea postdestete por E. coli en lechones con ácido hipocloroso
David García Páez
Nueva normativa de envases y residuos: ¿cómo afecta al sector ganadero y a los productores?
Diego Calvo
Salud urinaria en cerdas: ¿Le damos la importancia que merece en granja?
Álvaro Guerrero Masegosa Anselmo Martínez Moreno Henar González Ramiro Juan Conesa Navarro Paula Sánchez Giménez Raquel Fernández Rodríguez
Dinámica y evolución del circovirus porcino tipo 2 (PCV2): hallazgos clave sobre sus genotipos
Claudia Maria Tucciarone Giovanni Franzo Joaquim Segalés Matteo Legnardi Michele Drigo
Impacto económico de las enfermedades en la producción porcina
Just Font
¿Qué es el estrés oxidativo y cómo afecta a la producción porcina? ¿Existen herramientas para combatirlo?
Ana García Alvarado
Sólidos y conductividad del agua. ¿Qué sabemos de ellos y cómo afectan a la producción animal?

La mosca, un vector infravalorado en la granja porcina
Claves a tener en cuenta para el control del virus de la gripe en granjas de porcino

Caracterización de antibiorresistencias en la microbiota de purines como estrategia de protección del medio ambiente y la cadena agroalimentaria
María Jesús Serrano Andrés
CIRBLOC® M HYO: Nueva vacuna combinada frente a PCV2 y M.hyo

MASTERFLY BAIT: control eficaz de moscas hasta 8 meses

Vincular los rendimientos y el bienestar a través de la nutrición

Inflamación: un problema oculto

Las complejidades del estrés postdestete y de las herramientas disponibles para mitigarlo

¿Por qué y cuándo se producen las bajas de los lechones en lactación?
Aitor Arrazola Joaquim Tarrés Llibertat Tusell Nuria Alòs Raquel Quintanilla
El verano está a la vuelta de la esquina! ¿Cómo hacer frente al calor?
Dr. Stefan Langer
Mortalidad de reproductoras: una aproximación práctica
Anabel Fernández Bravo Andrea Martínez Martínez Emilio José Ruiz Fernández José Manuel Pinto Carrasco Manuel Toledo Castillo Rocío García Espejo Simón García Legaz