EL COMPLEJO ENTÉRICO PORCINO EN PERIODO DE CRECIMIENTO (TRANSICIÓN Y CEBO)
En este artículo revisamos el contexto actual sobre el complejo entérico en fases de transición y cebo, apoyándonos en la experiencia adquirida por nuestro grupo de investigación y los datos aportados por nuestros últimos estudios.


El manejo, tratamiento y control de las enfermedades digestivas ha sufrido una nueva vuelta de tuerca, principalmente en enfermedades de etiología bacteriana, con las nuevas regulaciones sobre piensos medicamentosos y medicamentos veterinarios, así como con la retirada de moléculas como el óxido de zinc y la colistina, que habían sido de gran ayuda en el control de algunas de estas enfermedades o procesos.
 A este hecho, se le une la cada vez más frecuente resistencia antimicrobiana, que nos limita los recursos terapéuticos disponibles para el tratamiento de enfermedades como la colibacilosis o la disentería porcina. |
En este artículo pretendemos revisar el contexto actual sobre el complejo entérico en fases de transición y cebo, apoyándonos en la experiencia adquirida por nuestro grupo de investigación en las últimas cuatro décadas y los datos aportados por nuestros últimos estudios en el tema.
EL COMPLEJO ENTÉRICO PORCINO EN PERIODO DE CRECIMIENTO (TRANSICIÓN Y CEBO)
Sin duda, las nuevas regulaciones para el uso de antimicrobianos (su limitación y uso prudente) y la retirada del ZnO (óxido de zinc), han afectado a la patología intestinal tal y como la hemos conocido en las últimas dos décadas.
Aunque no podemos obviar la implicación de virus, sobre todo Rotavirus A, en procesos entéricos al destete, la limitación en las medicaciones preventivas (con antibióticos y ZnO) ha abierto la puerta a patógenos bacterianos, liderados por ETEC (E. coli enterotoxigénico), pero al que se le están uniendo otros, no tan frecuentes en estas edades hasta hace poco tiempo.
Es curioso que algunas de las enfermedades de las que vamos a tratar en las próximas líneas comenzaron a cobrar protagonismo también a raíz de un cambio en la legislación sobre las medicaciones, con la retirada de los promotores de crecimiento.


Pero vayamos por partes. El estudio detallado de la composición de la microbiota al destete mediante el análisis del microbioma, nos ha permitido determinar que las medicaciones con antibióticos (por ejemplo, el uso de apramicina) o con dosis terapéuticas de ZnO, eran un apoyo para una correcta maduración de la microbiota comensal en el destete, limitando el crecimiento de E. coli. Su retirada ha significado perder el freno que limitaba el crecimiento de E. coli.

|
En destete se encuentra ETEC, principalmente con las fimbrias F4 y F18 y con todas las combinaciones posibles de toxinas.

Estos datos reflejan que el tratamiento frente a estas infecciones se ve muy limitado en la actualidad y debemos buscar alternativas y medidas preventivas que corrijan los posibles factores predisponentes y desencadenantes de la infección.

Las enfermedades causadas por espiroquetas (tradicionalmente Brachyspira pilosicoli y Brachyspira hyodysenteriae), Lawsonia intracellularis y Salmonella enterica se observaban con más frecuencia en transiciones y cebo.

| A menor edad, menor funcionalidad intestinal, incluyendo la funcionalidad del sistema inmunitario, y, por lo tanto, mayor susceptibilidad a padecer cuadros relativamente graves de cualquiera de las patologías mencionadas. |
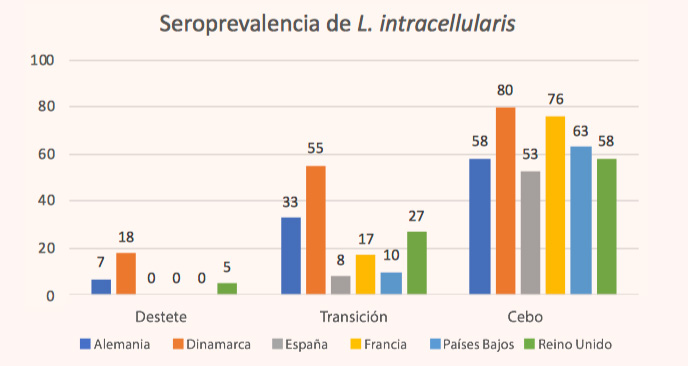
Figura 1: Seroprevalencia de Lawsonia intracellularis en granjas de cerdos en diferentes países europeos (adaptado de Arnold y col 2019).
Uno de los puntos que nos gustaría enfatizar en este trabajo es que los patógenos entéricos rara vez vienen solos, de ahí la locución latina “E pluribus unum”, que viene a significar “de muchos uno”, para resaltar que en la mayoría de las ocasiones estaremos hablando de un proceso producido por la interacción de varios de los patógenos anteriormente mencionados, sobre todo en lo que se refiere a enfermedades (o problemas) en transición y cebo.



La pregunta que puede surgir con estos datos es: ¿son realmente coinfecciones o cada patógeno hace la guerra por su cuenta? Partamos de un axioma, los tres patógenos son capaces de producir enfermedad en animales de forma independiente y sin necesidad de interactuar con los otros dos. Por lo tanto, no es necesario que coinfecten al hospedador.
Sin embargo, estudios recientes demuestran las interacciones que se producen en coinfecciones, y que seguramente están ligadas tanto a alteraciones de la respuesta inmunitaria local |

Desarrollemos un poco estas ideas. Salmonella es un patógeno proinflamatorio que daña principalmente el íleon en el intestino delgado.

L. intracellularis es sin embargo un patógeno silente, no activa una fuerte respuesta inmunitaria en su infección (salvo en ileítis agudas). Infecta principalmente células de íleon a las que roba energía (ATP), de ahí su clara correlación negativa con parámetros productivos.
 Su daño no termina ahí, ya que produce desregulaciones en el ciclo de regeneración celular en las criptas de Lieberkühn, estimulando la división de enterocitos inmaduros que forman una capa gruesa de células afuncionales, la adenomatosis característica de esta enfermedad, y por lo tanto limitando gravemente la funcionalidad del epitelio intestinal. |
Si el intestino delgado no ejerce convenientemente esa función de digestión y absorción de nutrientes, estos quedan disponibles para la microbiota comensal y también para bacterias que no son tan beneficiosas y pueden proliferar en ambientes con concentración de glúcidos simples o proteínas.

Los mecanismos de patogenicidad de estos tres patógenos son distintos, pero sin embargo, y pese a que B. hyodysenteriae infecta el intestino grueso, existe una asociación positiva entre los mismos.
¿Por qué? Por los dos aspectos que acabamos de mencionar: alteración de la fisiología intestinal y respuesta inmunitaria, y la disbiosis que estas infecciones producen. Vamos a ilustrarlo con un ejemplo.
 En un estudio reciente desafiamos lechones con B. hyodysenteriae. A la llegada a nuestras instalaciones los animales fueron negativos en el diagnóstico de B. hyodysenteriae, Salmonella y L. intracellularis. Sin embargo, los cerdos con disentería también excretaban L. intracellularis en la fase aguda de infección (ver Figura 2). |
¿De dónde proviene esa infección si los cerdos están en instalaciones aisladas? Pues no cabe duda de que son animales que llegaron con una infección tan subclínica que no era detectable por PCR, y la coinfección con B. hyodysenteriae reactivó la excreción de Lawsonia en estos lechones infectados (Figura 2).
 Este ejemplo ilustra a la perfección cómo estos patógenos se coestimulan y de ahí los números de coinfecciones que hemos mostrado al principio de este artículo. |
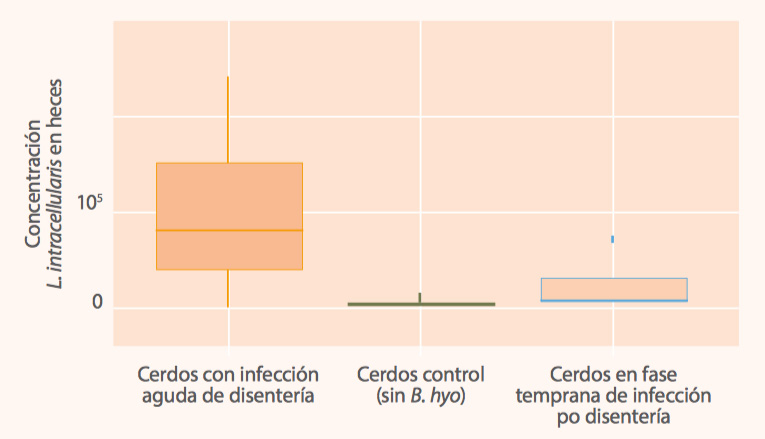
Figura 2: Concentración de Lawsonia intracellularis por gramo de heces en cerdos con infección por B. hyodysenteriae y cerdos control (sin infección) que muestra la estimulación de la excreción de L. intracellularis en cerdos infectados por B. hyodysenteriae.
El control del complejo entérico se debe realizar desde un enfoque holístico (Figura 3), es decir, hay que tocar varias teclas para, por una parte, controlar los patógenos (ya sea con medicaciones, vacunaciones, otras medidas como nutracéuticos, fitobióticos, etc.), limitar los factores predisponentes mediante un correcto manejo (bioseguridad, higiene, inmunización de reposición, etc.) y, por supuesto, una adecuada calidad de alimento y agua.

En muchas ocasiones nos centramos en el control de alguna de las enfermedades sin considerar que el complejo entérico es casi siempre un proceso multietiológico y que, para abordar por ejemplo una reducción de Salmonella en granja, también tenemos que pensar en otros agentes como puede ser L. intracellularis.
Vamos a ejemplificar este concepto. En un estudio realizado hace unos años evaluamos la eficacia de un ácido orgánico en pienso para el control de Salmonella.



Hoy en día nos centramos en tratar de sustituir a los antibióticos por otros compuestos que nos permitan controlar los patógenos entéricos y la lección de este artículo es que, en ese abordaje de control, no debemos de olvidar a otros procesos (entéricos, respiratorios o sistémicos) que puedan estar favoreciendo el proceso a controlar.
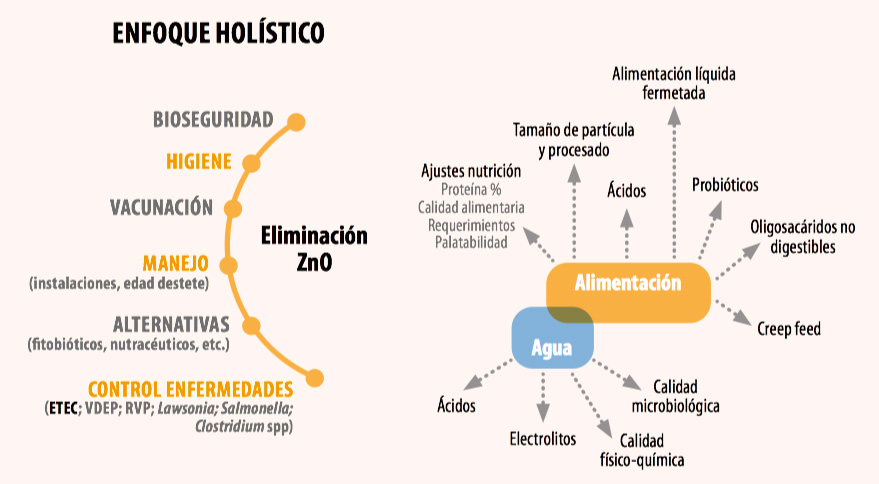
Figura 3: Resumen de actuaciones para el control del complejo entérico (adaptado a diarrea posdestete).
A modo de conclusión de este artículo, la patología digestiva tiene gran relevancia en la actualidad, por la diseminación de patógenos entéricos en todas las fases de producción y la restricción de antimicrobianos para su control.
| Sin duda, el abordaje y prevención debe tener en cuenta la idiosincrasia del complejo entérico, de un correcto diagnóstico de los potenciales patógenos presentes en cada una de las fases, la corrección de factores predisponentes, mejoras en el manejo de los animales y hacer uso de las herramientas de prevención y control que nos ofrece el mercado. |

La correcta formación y contacto con los especialistas es fundamental si queremos tener éxito y mejorar la salud del intestino de nuestros cerdos.

Ver más sobre MSD Animal Health
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez