Los macrólidos, medida complementaria de control
El diseño de una estrategia de control frente al PRRS debe combinar vacunación, manejo y bioseguridad. A esto se puede sumar el uso y metafilaxis como protocolo con macrólidos como la tilmicosina, ya que la combinación de sus efectos, además de ayudar en la contención del virus, mejora los índices zootécnicos y la viabilidad de la granja.

Durante todos estos años se ha avanzado mucho en su conocimiento, pero todavía sigue siendo la enfermedad endémica más importante, por lo menos, de las granjas porcinas de Norte América y Europa.
La razón es simple, seguimos teniendo lagunas de conocimiento importantes. Nos falta un mayor conocimiento del virus y de la respuesta inmune que desencadena tanto innata como adquirida.

Las herramientas de control que usamos bien sean las vacunas vivas atenuadas o inactivadas, presentan limitaciones importantes: no generan una protección heteróloga completa.
En otras palabras, no son lo suficientemente efectivas para prevenir una nueva infección, ni lo suficientemente potentes para reducir la excreción viral a niveles palpables en la práctica.
Los macrólidos, medida complementaria de control
En espera de que nuestro conocimiento mejore, y que se desarrollen productos mucho más eficaces, el control de la enfermedad lo debemos continuar basando en la vacunación, el correcto manejo y en evitar la entrada de nuevas cepas de virus para no regresar de nuevo, al punto de partida.
Por desgracia, sólo con las medidas de control no se consigue la eliminación del virus. Para eliminarlo hay que aplicar medidas adicionales que conllevan una dificultad logística y un coste elevado, como son: el cierre temporal de la granja a la entrada de reposición por un período de tiempo suficiente para eliminar los portadores persistentes; y la despoblación parcial de aquellas áreas en las que el virus continúa circulando frecuentemente, fases de posdestete y cebo.
Cuando hablamos de control, estamos aceptando que el virus continuará circulando en la granja, si bien lo hará de un modo controlado.

Es aquí donde los macrólidos pueden resultar extremadamente útiles y más concretamente a través de la implementación de un tratamiento de metafilaxis protocolizado con tilmicosina.
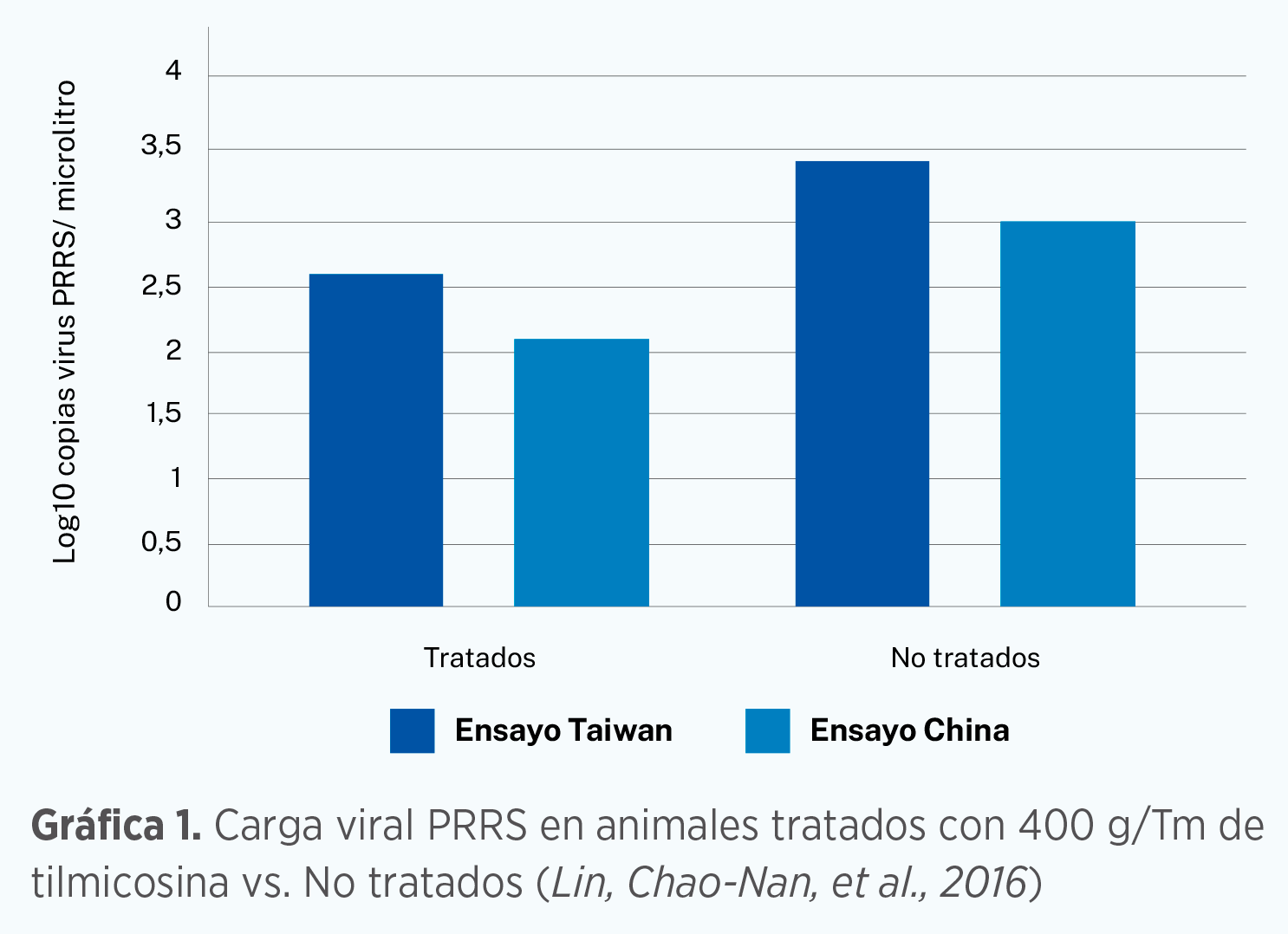
| En 2001, y por casualidad, se trataron unos cultivos celulares con tilmicosina para prevenir contaminaciones bacterianas, concretamente se trataron cultivos de macrófagos alveolares que debían servir para el crecimiento de virus del PRRS. Curiosamente, en esos cultivos se observó una disminución de crecimiento viral y posteriormente se comprobó que la replicación del virus del PRRS se reducía de una manera dosis dependiente. Es la primera vez que se describe la actividad anti-viral de la tilmicosina. Este efecto “in vitro” ha sido posteriormente corroborado por otros grupos de investigación y el mismo efecto se ha descrito “in vivo”, donde cerdos tratados con 400 g/Tm de tilmicosina e infectados del virus PRRS, mostraron una reducción en la severidad de la hipertrofia de los nódulos linfáticos y la severidad de las lesiones pulmonares además de tener cargas virales inferiores (p<0,05) que sus compañeros no tratados. |
Los macrólidos son antimicrobianos con una acción básicamente bacteriostática, si bien a dosis elevadas se comportan como bactericidas.
Los macrólidos se acumulan en los linfocitos, lo que permite que puedan migrar a los sitios donde se encuentra la infección.
Pero esta capacidad de concentrarse a nivel intracelular no es igual para todos ellos y podría ser determinante para la actividad antiviral.
La tilmicosina tiene la propiedad de acumularse en los macrófagos alveolares porcinos, de modo que la concentración intracelular es 51,8 veces superior a la extracelular tras 24 horas de incubación a 10 g/ml.
La naturaleza bioquímica de la tilmicosina es básica debido a dos grupos amina (pKa 7.4 y 8.5). Por tanto, el posible mecanismo de la actividad antiviral de la tilmicosina podría estar relacionado con la alteración del pH en el endosoma de las células tratadas.

En apoyo de esta hipótesis, se ha demostrado que la proteína de la envoltura del virus PRRS posee propiedades similares a las de las proteínas de los canales iónicos y también se ha probado el efecto inhibidor de un pH elevado del endosoma, generado con otras sustancias, sobre la replicación del virus PRRS.
Hay que recordar que los macrólidos poseen además otras dos propiedades inherentes a ellos que son la acción inmunomoduladora y antiinflamatoria asegurando así una excelente eficacia frente un rango amplio de infecciones.
Los mecanismos precisos por los que consiguen estas acciones no se conocen completamente, pero se sabe que inducen la apoptosis de los macrófagos en pulmones de animales experimentalmente infectados y esto reduce la producción de sustancias pro-infamatorias al no romperse las células infectadas.
Y son numerosos los efectos inmunomoduladores descritos y, entre ellos, destacan la reducción de la acumulación de mediadores pro-inflamatorios, reducción de la secreción mucosa y modulan la función de los neutrófilos induciendo también su apoptosis, entre otros. Todos estos efectos se sumarían al afecto anti-viral comentado potenciando su acción.
Experiencias de campo
Hay bastantes experiencias que describen el efecto beneficioso de un tratamiento con tilmicosina donde hay circulación del virus PRRS, concretamente en cerdos durante la fase de posdestete.
En estas experiencias se describen efectos positivos sobre la mortalidad, ganancia media diaria (GMD) e índice de conversión tanto en la fase de posdestete como en la fase de engorde posterior.
Pero los macrólidos también se han empleado en cerdas reproductoras durante brotes de PRRS.
La primera descripción de su uso la hizo L. Fraile en 2004 cuando medicó con tilmicosina las cerdas gestantes entre los 85 y 115 días de gestación de 3 granjas tras detectar los primeros signos clínicos reproductivos de la infección por virus del PRRS. Describió una reducción considerable en la duración de los signos clínicos y una menor duración del impacto de la enfermedad en las fases posdestete y cebo.
Muy recientemente, Kiehne (2021) describió también los beneficios de usar un tratamiento con macrólidos en cerdas reproductoras infectadas por el virus PRRS. Inyectando con tulathromicina a cerdas gestantes con más de 50 días de gestación durante un brote de PRRS comprobó que las cerdas tratadas habían abortado menos, parieron menos nacidos muertos, menos momificados y destetaron más lechones.
Conclusiones
| El control del PRRS no es fácil pues, hoy por hoy, no tenemos herramientas que sean 100 % eficaces. Esta es la razón por la que el diseño de una estrategia de control debe contar con la combinación de distintas medidas entre las que no pueden faltar la vacunación, el manejo y la bioseguridad. A estas se pueden sumar otras como puede ser el uso y metafilaxis como protocolo con macrólidos como la tilmicosina pues la combinación de efectos que posee (antibactérico, antiinflamatorio, inmunomodulador y antiviral) además de ayudar en la contención del virus, ayudará a mejorar los índices zootécnicos y en consecuencia la viabilidad futura de la granja. |
Referencias:
Benfield, D. A., et al. 2002. An evaluation of the effects of tilmicosin in feed on nursery pigs inoculated with pocine reproductive and respiratory syndrome virus. American Association of Swine Veterinarians, 2002.
Buret, AG. 2010. Immuno-modulation and anti-inflamatory benefits of antibiotics: The example of Tilmicosin. Canadian Journal of Veterinary Research, 2010;74:1-10.
Du, Y. et al. 2011. Antiviral Activity of Tilmicosin for Type 1 and Type 2 Porcine Reproductive and Respiratory Syndrome Virus In Cultured Porcine Alveolar Macrophages. J Antivir Antiretrovir 2011, 3:3.
Fraile, D. et al. 2004. Reduction of PRRSv and respiratory clinical disease by tilmicosin. Proceedings of the 18th IPVS Congress, Hamburg, Germany, 2004, 1: 38.
Fraile, D. et al. 2004. Efficacy of tilmicosin in clinical reproductive disease associated with PRRSv. Proceedings of the 18th IPVS Congress, Hamburg, Germany, 2004, 1: 56.
Kiehne, R. 2021. Timing of Draxxin® administration in a PRRSv outbreak may result in positive reproductive outcomes. Proceedings AASV 2021, 291.
Lapuente, S. et al. 2004. Clinical confirmation of Pulmotil® efficacy on the control of PRDC associated to PRRSv infection. Proceedings of the 18th IPVS Congress, Hamburg, Germany, 2004, 1: 37.
Lin, Chao-Nan, et al. 2016. Tilmicosin Reduces PRRSV Loads in Pigs in vivo. Journal of Agricultural Science; Vol. 8, No. 1; 2016.
Molitor, T., et al. 2001. Tilmicosin affects porcine reproductive and respiratory syndrome virus Molitor, T., et al. 2001. Tilmicosin affects porcine reproductive and respiratory syndrome virus replication. Proceedings, Allen D. Leman Swine Conference, 2001.
Scorneaux, B. and Shryock,TR. 1998. Intracellular accumulation, subcellular distribution and efflux of tilmicosin in swine phagocytes. J Vet Pharmacol Ther. 1998 Aug; 21(4): 257-68.
Más sobre Dopharma Iberia
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez