Para minimizar el riesgo de introducción del PRRSV en granjas de reproductoras se debe garantizar que las dosis de semen adquiridas están libres de virus, siendo necesario establecer programas de vigilancia epidemiológica en los centros de inseminación artificial (CIA).
El Virus del Síndrome Reproductivo y Respiratorio Porcino (PRRSV, por sus siglas en inglés, Porcine Reproductive and Respiratory Syndrome Virus) es el agente causal de una de las enfermedades víricas que más preocupa a la industria porcina.
Dos de sus características más remarcables son su capacidad para producir infecciones persistentes y su elevada transmisibilidad (Hermann et al., 2005).
Aunque la transmisión puede producirse por diversas rutas, la entrada de cepas del virus en una granja suele deberse a la introducción de animales portadores o de semen contaminado (Prieto y Castro, 2005).
En consecuencia, los productores de cerdos han tomado conciencia del riesgo que supone la entrada de semen en las granjas y propugnan la adquisición de dosis de semen negativas al virus.
PATOGENIA DEL PRRSV EN EL VERRACO Y TRANSMISIÓN VENÉREA
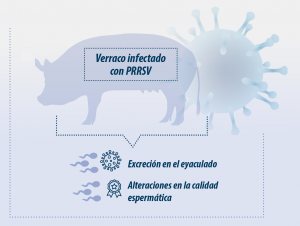
La infección en los verracos produce una viremia de duración variable que permite la distribución orgánica del virus y su llegada al aparato reproductor, donde puede producir alteraciones en la calidad espermática, aunque casi siempre leves (Prieto et al., 1996).
Sin embargo, la consecuencia más importante de la infección es la excreción del virus en el eyaculado, generalmente asociado a macrófagos, durante un tiempo variable. Esta excreción es siempre intermitente, con alternancia de eyaculados contaminados y libres de virus (Wasilk et al., 2004; Park et al., 2017).
La excreción de PRRSV en semen permite la transmisión venérea de la enfermedad, tal y como se ha constatado tanto en condiciones experimentales (Prieto et al., 1997) como de campo (Nathues et al., 2016).

PROGRAMAS DE VIGILANCIA EPIDEMIOLÓGICA EN CIA
La importancia epidemiológica del esperma ha hecho que en algunos países libres de la enfermedad se haya prohibido la importación de semen (ej.: Suiza) mientras que en otros se hayan instaurado controles analíticos exhaustivos a las dosis importadas (ej.: Nueva Zelanda) (Nathues et al., 2014).
En los países positivos también existe preocupación por el riesgo que supone la compra de semen. Por ello, la tendencia general es trabajar con CIA negativos y utilizar dosis de semen de CIA positivos únicamente en situaciones excepcionales (Reicks et al., 2006).
Sin embargo, como los CIA se pueden infectar de forma inadvertida, se han desarrollado programas de vigilancia epidemiológica para garantizar que las dosis de semen comercializadas estén libres del virus.

La infección de los verracos se puede confirmar mediante la detección directa del genoma vírico, por técnicas de biología molecular (i.e. RT-PCR o RT- qPCR), o mediante la determinación de la seroconversión (Rovira et al., 2007; Pepin et al., 2015).


Las muestras más utilizadas para la detección del PRRSV en verracos son semen y suero (Christopher-Hennings et al., 1995; Wasilk et al., 2004; Reicks et al., 2006).
Posteriormente se han incorporado los fluidos orales y los hisopos de sangre obtenidos mediante venopunción (Kittawornrat et al., 2010; Reicks et al., 2006; Rovira et al., 2007, Pepin et al., 2015), aunque su aplicación no está completamente optimizada (Weiser et al., 2018).

Al elegir la muestra hay que tener en cuenta que la viremia comienza siempre antes que la excreción de virus en semen por lo que la detección es más rápida si se utilizan muestras de suero (2-8 días) (Christopher-Hennings et al., 1995; Wasilk et al., 2004; Reicks et al 2006; Rovira et al 2007).
Las muestras de suero se consideran muestras de elección por ser muy homogéneas, ya que el virus se encuentra en la sangre mayoritariamente en forma libre. Además, el suero no presenta, por lo general, inhibidores de la RT-PCR, lo que le confiere elevada repetibilidad. Finalmente, la cantidad de virus en suero es mayor que en semen, por lo que la sensibilidad es mayor (Rovira et al., 2007; Han et al., 2011; Pepin et al., 2015).

Las muestras de semen presentan una elevada celularidad, lo que dificulta la extracción del ARN vírico (Christopher- Hennings et al., 2006), y el plasma seminal puede inhibir la técnica de RT-PCR. Además, la asociación del virus, principalmente a la fracción celular, hace que las muestras de semen no se consideren homogéneas. Ambas características hacen que los resultados obtenidos puedan ser negativos o inconsistentes (Christopher-Hennings et al., 1995; 2006).
Asimismo, al contrario de lo que sucede con las muestras de suero, el análisis de pools de muestras de semen puede comprometer la fiabilidad de los resultados si estos están compuestos por una mezcla de muestras positivas y negativas, ya que la carga vírica suele ser menor en semen que en suero (Rovira et al., 2007).
Esto es particularmente relevante en los primeros días tras la infección, cuando hay pocas muestras positivas, y al final de la infección, cuando la carga vírica en los eyaculados es baja (Han et al., 2011).
Sin embargo, las muestras de semen tienen la gran ventaja de que son mucho más fáciles de obtener que las de sangre, particularmente considerando la frecuencia de muestreo necesaria para llevar a cabo la detección precoz de la infección.

FRECUENCIA DE MUESTREO Y TAMAÑO DE MUESTRA

Por tanto, cuanto mayor sea la periodicidad de muestreo y el tamaño de muestra, mayores serán las posibilidades de hacer una detección temprana.
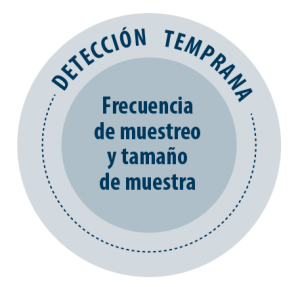
Mediante modelos matemáticos se ha establecido que una menor frecuencia de muestreo y un menor tamaño de la muestra aumentan el tiempo necesario para la detección (Rovira et al., 2007).
En consecuencia, únicamente la toma de un elevado número de muestras con una elevada frecuencia garantiza la detección temprana de la infección en un CIA y disminuye el riesgo de transmisión venérea de la infección.


ACTUACIONES PRÁCTICAS SEGÚN EL ESTATUS SANITARIO DE LOS CIA
CIA NEGATIVOS
En el caso de los CIA negativos, la prioridad es garantizar que los verracos permanezcan negativos.
La detección mediante RT-PCR permite realizar un diagnóstico más rápido, particularmente si la muestra seleccionada es el suero.

CIA POSITIVOS
En el caso de los CIA positivos, ni la seroconversión ni la detección de la viremia son adecuados, ya que el virus se puede excretar en presencia o ausencia, tanto de anticuerpos como de viremia (Christopher-Hennings, 2001).

CONCLUSIONES
La industria ha tomado conciencia de la necesidad de mantener los CIA negativos al PRRSV y de establecer programas de vigilancia epidemiológica para garantizar el mantenimiento de este estatus.
Solo el análisis de todos los verracos en cada extracción, con técnicas optimizadas, garantiza que no se comercialicen dosis de semen contaminadas.
La detección de la presencia del virus se puede hacer en muestras de suero o de semen, pero la detección es más precoz en muestras de suero.
Una detección más temprana permite evitar la difusión del virus a granjas receptoras y contener la difusión del virus en el CIA de forma más rápida y eficaz.
La determinación de la seroconversión supone un retraso en la detección de la infección y no se recomienda.
Sin embargo, en CIA positivos la vigilancia epidemiológica solo se puede realizar analizando las muestras de semen.
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez