El proceso de colonización microbiana intestinal de los lechones sigue un patrón de evolución similar entre diferentes granjas, siendo necesario realizar estudios para determinar cómo podría impactar en la salud intestinal del lechón y el desarrollo de su sistema inmunitario.
El proceso de colonización microbiana del intestino tras el nacimiento juega un papel crucial en el desarrollo del sistema inmunitario neonatal de los mamíferos con implicaciones durante toda su vida (Hansen, C. H. F. et al., 2012).

La colonización microbiana temprana resulta de factores como la genética, la exposición microbiana, tanto a la madre como al ambiente, y el uso de antibióticos.
Esto, a su vez, pone en marcha el cross-talk (conversación cruzada) entre el microbioma y el hospedador mediado por cambios en la nutrición, la inmunidad, la función de barrera, el metabolismo y la expresión génica (Figura 1). Por tanto, se trata de una matriz de sistemas muy compleja capaz de modular la aparición y desarrollo de enfermedades inmunitarias y metabólicas.
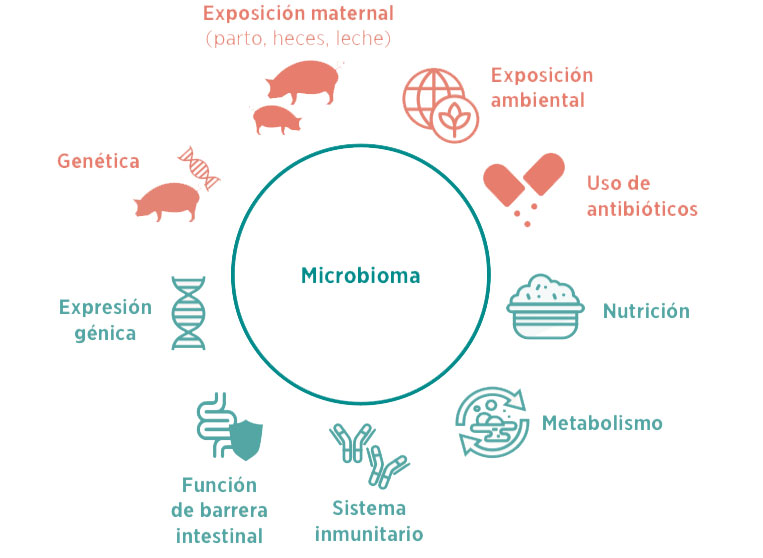
Figura 1. Esquema del cross-talk entre el microbioma y la homeostasis intestinal (Adaptado de Houghteling et al., 2014).
Habitualmente, los mamíferos son inoculados con la microbiota materna al pasar a través del canal de parto (Houghteling, P. & Walker, W., 2014) donde también se encuentran con bacterias intestinales (Makino, H. et al., 2013).

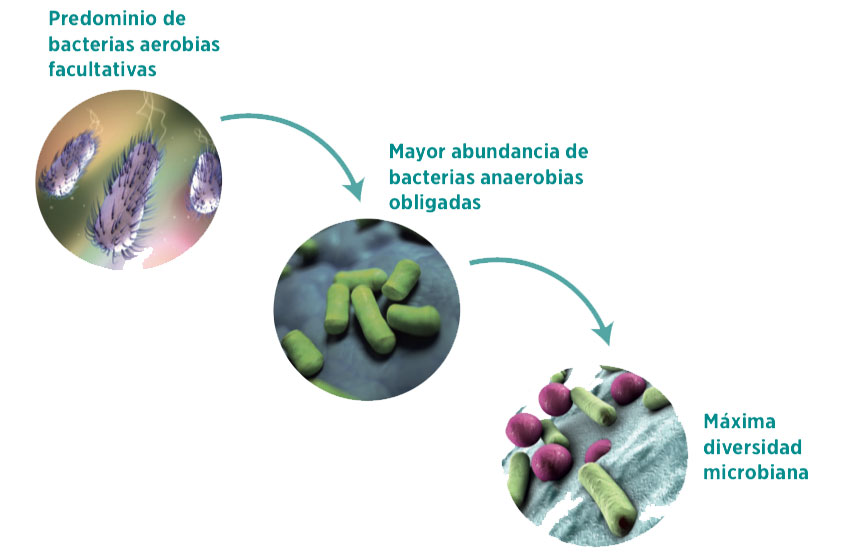
En el ámbito humano se ha descrito que, al nacer, el intestino del neonato presenta un ambiente aerobio compuesto por bacterias aerobias facultativas como Escherichia y Enterococcus, volviéndose gradualmente anaerobio con una mayor abundancia de bacterias anaerobias obligadas, como Clostridia, Bacteroides y Bifidobacteria (Johnson, C. L. & Versalovic, J, 2012; Jost, T., Lacroix, C., Braegger, C. P. & Chassard, C., 2012).

|
Aunque se espera que algo similar ocurra en los cerdos (Thompson, C. L., Wang, B. & Holmes, A. J., 2008), actualmente no existen muchos estudios que permitan comprender en profundidad el impacto de los eventos de la vida temprana sobre el microbioma del lechón y su futuro productivo (Nowland, T., Plush, K., Barton, M. & Kirkwood, R., 2019). |


|
Dado que los estudios sobre la colonización temprana de la microbiota de los lechones son aún limitados, nuestro grupo de investigación se planteó realizar diferentes estudios de campo con lechones durante sus primeros días de vida en el ámbito comercial. |
Diseño experimental
Un total de 4 granjas (A, B, C y D) fueron seleccionadas para este estudio:



|
Tras extraer el ADN de las muestras, se analizó la composición de la microbiota intestinal mediante la secuenciación masiva del gen 16S ARNr (región V3-V4). |
Resultados
Del conjunto de las 4 granjas, se obtuvo un promedio de 65.760 ± 13.853 secuencias por muestra.

*Riqueza de especies de una comunidad a la que consideramos como homogénea y que puede ser medida según el número de especies presentes o según la distancia filogenética.
Escalamiento Multidimensional No Métrico
(EMD-NM) de abundancia relativa de Unidades Taxonómicas Operativas (OTU)
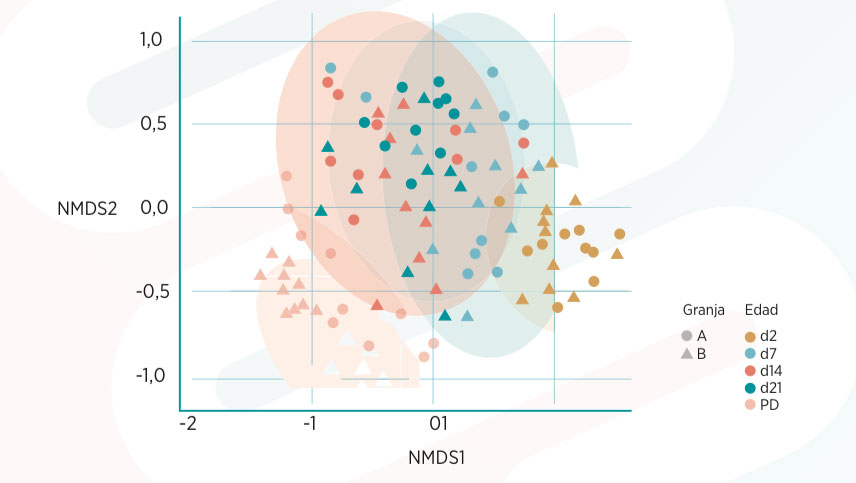
Gráfica 1. Dispersión de la estructura de la microbiota de los lechones de las granjas A y B. Se observa cómo la edad de los lechones, representada en colores diferentes, agrupa a los lechones de ambas granjas en grupos claramente diferenciados, especialmente entre la lactación y el postdestete (PD). Las estructuras de los lechones entre los días 14 y 21 de vida difieren poco entre sí y se encuentran más mezcladas.
En el análisis de la abundancia de taxones diferenciales los filos más abundantes en todas las muestras fueron Firmicutes (49,3%) y Bacteroidetes (29,4%), seguidos de Proteobacteria (10,7%) y Fusobacteria (5,7%) (Gráfica 2). El resto de los filos se presentaron con menor abundancia (<2%).
Cabe destacar que, durante los primeros días de vida (granjas A y B), se observaron grandes cambios en los porcentajes que ocupan estos grupos taxonómicos.
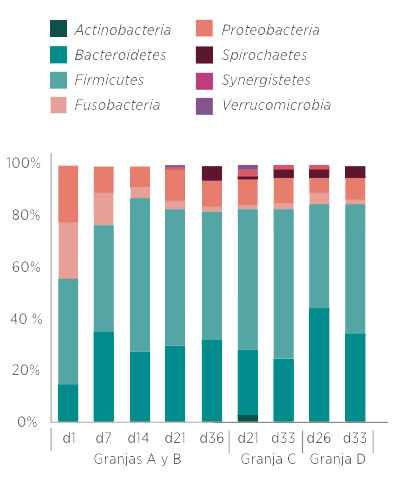
Gráfica 2. Abundancias relativas (%) de los filos presentes en la microbiota de los lechones organizadas por granja y edad de los lechones. El cambio más evidente se produce durante los primeros días de vida en las granjas A y B, donde destaca una mayor abundancia del filo Fusobacteria.
En la literatura, Bacteroidetes, Firmicutes y Proteobacteria constituyen, en términos generales, los tres filos predominantes de la microbiota de los lechones (Chen, X., et al, 2018; Chen, L. et al., 2017; Holman, D. B. et al, 2017; Kim, H. B. et al., 2012).

Las diferencias en los ambientes y dietas entre los experimentos podrían explicar la disparidad en la estructura de la microbiota intestinal de los lechones.
A nivel de filo cabe reseñar también la importancia del filo Fusobacteria, muy predominante durante la lactancia, pero con una disminución drástica en el tiempo. Este mismo resultado ha sido descrito anteriormente por otros autores (Chen, X., et al. 2018; Niu, Q. et al., 2015; Chen, L. et al., 2017; Pajarillo, E. A. B., 2011; Hu, J. et al., 2016) aunque aún se desconoce la trascendencia de esta bacteria en el proceso de colonización microbiana del intestino.
|
En las granjas C y D se observaron con mayor detalle los cambios producidos por el efecto del destete.
|
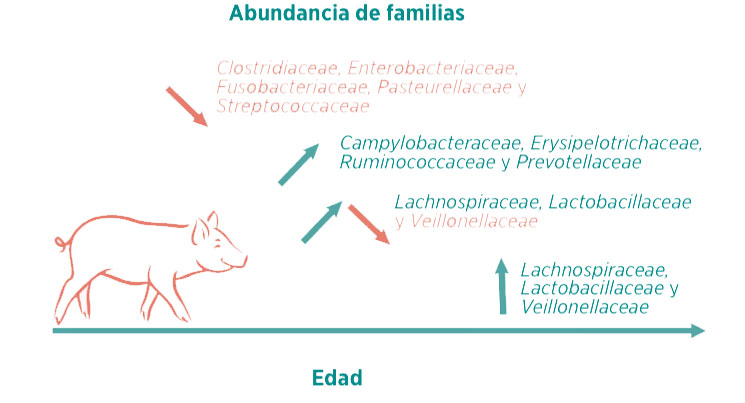
A nivel familiar, Fusobacteriaceae, Clostridiaceae y Enterobacteriaceae fueron mayoritarias durante los primeros días de vida (d7-d21), representando, en conjunto, entre un 50-60% de la abundancia relativa.


Abundancias iniciales similares, así como su drástico descenso con la edad de los lechones, fueron descritos también por otros autores (Chen, X. et al., 2018; Niu, Q. et al., 2015; Chen, L. et al., 2017; Pajarillo, E. A. B. et al, 2011; Hu, J. et al., 2016; Frese, S. A., et al., 2015).
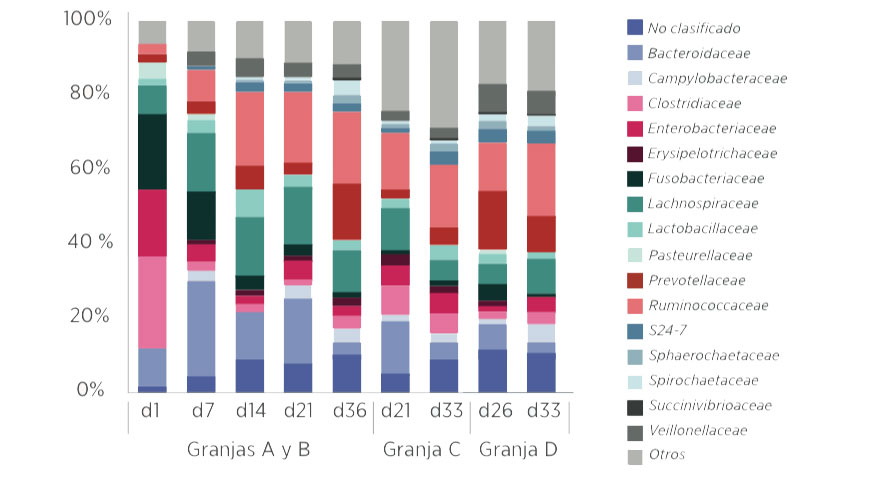
Gráfica 3. Abundancias relativas (%) de las 16 principales familias presentes en la microbiota de los lechones organizadas por granja y edad de los lechones.

Estas familias se relacionan con la fermentación de carbohidratos complejos, y, probablemente, reflejan la evolución y la adaptación del ecosistema intestinal hacia una dieta sólida.
Tras el destete, se observaron reducciones significativas de Bacteroidaceae, Enterobacteriaceae, Fusobacteriaceae y Lactobacillaceae con un aumento significativo de Prevotellaceae, Lachnospiraceae y Erysipelotrichaceae.
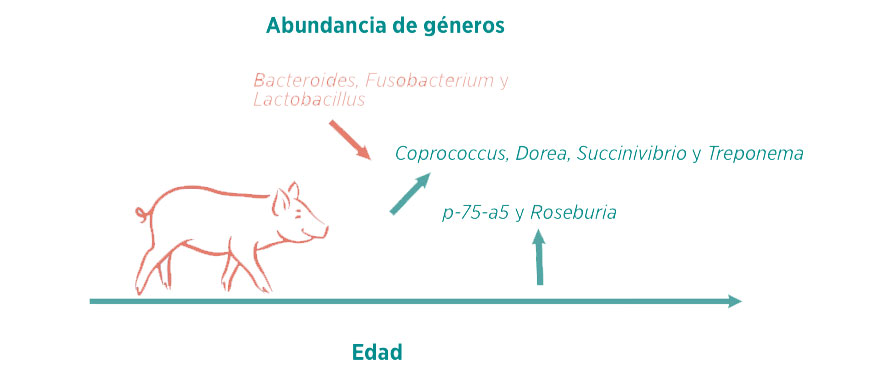
A nivel de género, dos géneros predominantes (>1%) mostraron aumentos significativos después del destete, incluyendo p-75-a5 y Roseburia, mientras que la abundancia relativa de Bacteroides, Fusobacterium y Lactobacillus disminuyó en lechones destetados.

Entre los géneros no predominantes (<1%), también se detectaron varios cambios significativos, como, por ejemplo, una mayor abundancia de Coprococcus, Dorea, Succinivibrio y Treponema en lechones destetados.

|
Bacterioides y Lactobacillus Abundancias relativas más altas de Bacteroides y Lactobacillus en lechones lactantes se han correlacionado con un microbioma orientado a la leche (Frese, S. A., 2015).
Lactobacillus es un conocido productor de lactato al consumir azúcares simples de leche, como la lactosa (Schwab, C. & Gänzle, M., 2011). De hecho, se ha observado |
El cambio abrupto a una dieta sólida basada en cereales y la retirada de leche explican la disminución de los géneros mencionados anteriormente y el aumento de los géneros productores de butirato (Zhao, J. et al., 2018) incluidos los pertenecientes a las familias Ruminococcaceae y Lachnospiraceae, entre otras.
|
Roseburia, Prevotella, Dorea y Succinivibrio Géneros como Roseburia, Prevotella y Dorea están adaptados para metabolizar una amplia gama de oligosacáridos y polisacáridos complejos a la vez que producen ácidos grasos de cadena corta (SCFA).
Asimismo, otros géneros relacionados con la fermentación de carbohidratos, como Succinivibrio (Bryant, M., 2015), incrementan también con la edad, especialmente, tras el destete. |
El proceso de colonización microbiana intestinal de los lechones siguió un patrón de evolución similar entre diferentes granjas, tanto en lo referente a la riqueza de especies y diversidad de la microbiota, que aumentaron en los lechones de forma gradual con la edad, como respecto a los grupos taxonómicos implicados en este proceso.
Estos resultados sugieren que existe una pauta en el establecimiento de la microbiota inicial que evoluciona desde un microbioma orientado a la degradación de los carbohidratos de la leche hacia otro más complejo, orientado a la fermentación de carbohidratos complejos, reflejando así la evolución y la adaptación del ecosistema intestinal hacia una dieta sólida.
|
Es necesario realizar más estudios para determinar cómo la modulación de este patrón de colonización en edades tempranas podría impactar sobre la salud intestinal del lechón y el desarrollo de su sistema inmunitario. |
Los resultados presentados pueden consultarse en la publicación: Saladrigas-García et al. Animal Microbiome (2022) 4:68 https://doi.org/10.1186/s42523-022-00221-9
Agradecemos al Grupo Vall Companys y, en particular, a Jaume Coma, Jordi Bonet y Mario Duran su colaboración en la mayoría de los estudios presentados en este trabajo.
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez