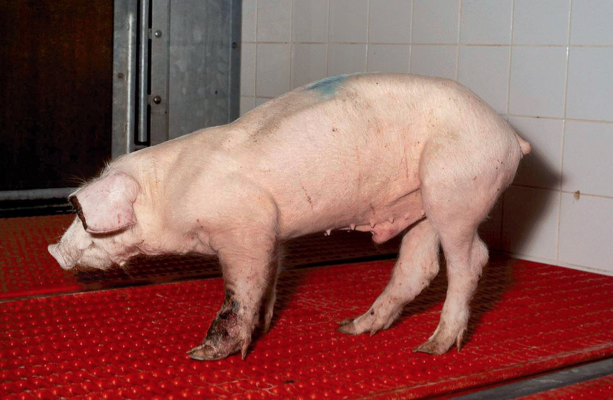
Imagen 1. Cerdo con signos de Síndrome Multisistémico de Desmedro Posdestete (PMWS).
El Circovirus porcino tipo 2 o PCV2 ha sido considerado como uno de los patógenos emergentes más importantes en la producción porcina
Figueras S, Hernández I, Rodríguez V y Díaz E.
Asesores veterinarios Boehringer Ingelheim España SA.
A este virus ADN perteneciente al género Circovirus y la familia Circoviridae (Segales, 2005) se le considera responsable principal del Síndrome Multisistémico de Desmedro Posdestete (PMWS).
Imagen 1. Cerdo con signos de Síndrome Multisistémico de Desmedro Posdestete (PMWS).
La sintomatología clínica se caracteriza por la pérdida de peso, pérdida de condición corporal y efecto inmunosupresor que puede provocar la muerte del animal (Imagen 1). Además, el PCV2 está implicado en otras patologías respiratorias y reproductivas que se engloban bajo la denominación de enfermedades asociadas a PCV2 (PCVAD), no siempre de fácil diagnóstico.
Todo esto conlleva grandes pérdidas económicas para el productor, y considerando que se estima que entre el 80 y 90% de los cerdos del mundo son seropositivos a PCV2, este virus representa uno de los mayores problemas económicos asociados a la industria porcina mundial.
La eficacia demostrada de la vacunación del lechón ha hecho que el control exitoso de la forma clínica de la enfermedad, pase por la inmunización masiva y sistemática de las líneas de producción, generalmente en torno a la edad del destete.
Es bien sabido que la vacunación del lechón reduce la viremia, la carga vírica en los tejidos y por lo tanto la excreción del virus al ambiente (SPC Ingelvac CircoFLEX®).
Este efecto indirecto redunda por lo tanto en una menor circulación del virus dentro la población porcina, al reducirse una de las principales vías de infección, la ya demostrada transmisión horizontal. No obstante, las características propias del virus hacen de él un patógeno muy resistente y difícil de eliminar de las instalaciones de las granjas. Eso por ello que PCV2 sigue circulando entre los animales aunque, indudablemente, a menor intensidad de lo que lo hacía antes de la aparición de las vacunas.
Desde un punto de vista inmunológico, las poblaciones sin inmunidad de base son las que pueden actuar de mantenedoras de la infección dentro de una granja en particular o de la población en general.
En la cabaña porcina actual conviven dos grupos inmunológicamente diferenciados. Por un lado una población mayoritariamente vacunada, principalmente el 90% de los lechones producidos y por otro una población minoritaria de madres en general no vacunada.
Atendiendo a las consideraciones anteriores, es lógico pensar que la circulación del virus en toda esa población continúa existiendo, aunque en menor magnitud que cuando lo hizo en la fase epizoótica de la enfermedad.
Nos encontramos en una situación epidemiológica donde las subpoblaciones inmunológicas existen y se localizan fundamentalmente en los animales no vacunados, esto es, las granjas de reproductoras.
En este escenario la existencia de enfermedad subclínica descrita por varios autores (Opriessnig en 2007, Segales en 2012), comienza a tener cierta relevancia. Esto se explica porque, pese a la elevada seroprevalencia de las granjas de madres, existen algunos individuos dentro de ese grupo que pueden infectarse de nuevo (Madson y Opriessnig, 2011) tras un largo periodo de tiempo desde la última exposición.
De igual modo otra posible causa de recirculación en granja de reproductoras, sería la incorporación de hembras nulíparas al plantel reproductor no expuestas previamente al antígeno.
Tenemos que considerar además que pese a que las futuras reproductoras se vacunan de lechonas al destete e incluso se revacunan dentro de su programa de aclimatación, estas vacunas no confieren una inmunidad que cubra toda su vida reproductiva.
Con todo lo expuesto el resultante final es la modificación del patrón de la cadena de infección en la explotación porcina. Se piensa que este es el mecanismo por el que el virus se perpetúa en esta cabaña.
En efecto, la inestabilidad de una explotación de reproductoras tal como la conocemos en otras enfermedades como por ejemplo en PRRS, es el resultado de la circulación a baja intensidad del agente en la población de tal manera que la infección genera per sé ciertas subpoblaciones no infectadas (Scott Dee, 1996).
Esta inestabilidad del hato en el caso de circovirus es hoy una realidad a la que se enfrentan determinadas explotaciones que, por sus características intrínsecas estructurales (tamaño de granja, numero de naves…) y de manejo (frecuencia de entrada y nivel de adaptación de la reposición, flujo de animales, demografía, programa vacunal…) ven reducido más aún si cabe el contacto reiterado con el virus.
Desde un punto de vista epidemiológico la inestabilidad del plantel reproductor juega un papel fundamental en los dos tipos de transmisión del virus, tanto vertical como horizontal, ampliamente demostrados por Mc Intosh et al, y Madec et al, en 2008.
El resultado por tanto es la transmisión vertical del virus de unas madres virémicas a sus lechones.
Resulta sencillo entender que estos animales infectados inútero suponen un foco de excreción y por tanto de transmisión horizontal del virus, con el permiso de la inmunidad maternal, entre sus congéneres alojados en las mismas instalaciones de maternidad. Siguiendo el hilo de la cadena de infección, este hecho supone un incremento de lechones infectados tempranamente, lo que nos haría vacunar animales que ya están infectados no obteniendo el beneficio directo de la vacunación (generación de inmunidad antes del contacto con el virus). Además una circulación más temprana del virus en la fase de transición es esperable en estos casos.
Podemos monitorizar estas recirculaciones tempranas utilizando serología (IgM aparición temprana 7-10 días tras circulación e IgG aparición entre 3-4 semanas tras infección). Si observamos la aparición de IgM entorno a las 5 semanas de edad (desestimar esta forma de monitorizar recirculación si se usa otra vacuna diferente a Ingelvac CircoFLEX®), nos indicará contacto precoz con el virus de campo.
El uso de la PCR también es una herramienta útil aunque sensiblemente más costosa.
Es bien sabido que PCV2 ataca al tejido linfoide de los animales y por tanto, atendiendo a esta consideración como agente inmunosupresor, estos animales presentan una respuesta inmunológica alterada frente a los desafíos de los patógenos como PRRS y PPV entre otros (Mc Cullough et al, 2008). Por ende esta inmunosupresión también puede afectar, lógicamente, a la correcta respuesta a las vacunas utilizadas de manera habitual. (Opriessnig, www.3tres3.com; 21 mayo 2012).
Por último mencionar que la infección intrauterina subclínica de los lechones provoca lesiones microscópicas en el tejido cardíaco (miocarditis), que si bien pueden no ser letales a corto plazo, si pueden tener consecuencias a medida que los animales se desarrollan en las fases posteriores de crecimiento (Opriessnig et al., 2006, Madson et al 2011).
Para conocer la estabilidad inmunológica a PCV2 de una granja de reproductoras, la serología de las madres por técnica de ELISA convencional aporta una visión incompleta.
Existen estudios que demuestran que, aun siendo seropositiva, una cerda es capaz de reinfectarse, mostrar viremia (Madson et al., 2011) y por lo tanto transmitir el virus vía vertical a su descendencia.
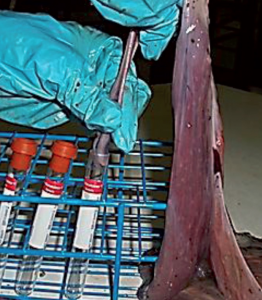
Imagen 2. Toma de muestra de sangre de cordón umbilical placentario (PUCS).
Por el contrario publicaciones recientes (Fangman et al., 2014, Seate et al., 2015) muestran que la monitorización de la estabilidad de una granja puede realizarse mediante el control de dicha transmisión vertical utilizando suero de cordón umbilical placentario (PUCS). Esta técnica no invasiva permite evaluar mediante PCR cuantitativa (qPCR) la prevalencia de transmisión del virus de las cerdas a los lechones, así como la carga vírica transmitida vía placentaria (Imagen 2).
Evidenciada la transmisión vertical y por ende la inestabilidad a PCV2 de las reproductoras, existen varios abordajes:
Dada la perdida de producción de las granjas tras el cerrado de las mismas, la homogenización por vacunación parece la opción más barata.
Diversos estudios realizados en España demuestran como la vacunación en sábana de las cerdas con Ingelvac CircoFLEX® es capaz de reducir esta transmisión vertical en términos de prevalencia y de carga vírica de los animales al nacimiento (Viñeta J., 2015, Navas et al., 2016). Además esta vacunación se ha demostrado segura y sin efectos negativos sobre las cerdas y su producción (Payne et al. 2013).
En un estudio reciente donde se vacunaron masivamente con Ingelvac CircoFLEX® las reproductoras y los lechones de una granja, se consiguió reducir hasta niveles indetectables la prevalencia durante los 12 meses de duración de dicho estudio (Feng et al., 2014). Sin embargo al cesar esta vacunación masiva, se incrementó de nuevo la presencia de PCV2 en el sistema evidenciándose la infección de los lechones en crecimiento.
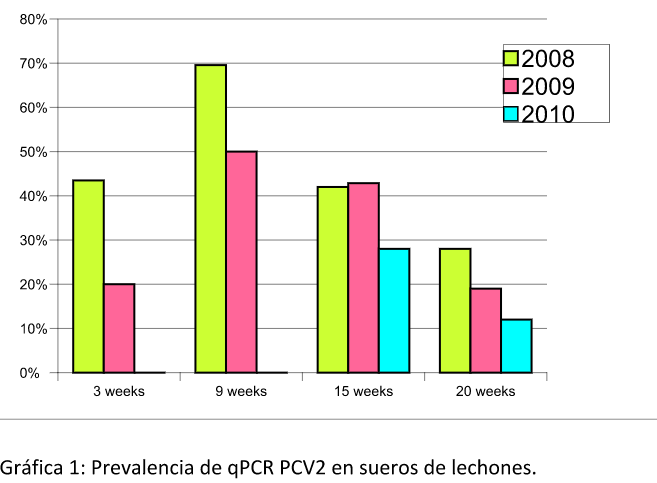
Otro hecho relevante de la vacunación se muestra en la mejora en determinados casos, de los parámetros productivos en las granjas de cerdas reproductoras (Díaz et al, 2011). En este estudio se muestra cómo mejoran los lechones destetados por cerda por la reducción de los abortos y de los momificados en una granja PRRS negativa con infección subclínica de PCV2. Interesante observar como a lo largo del tiempo (tres años) el virus reduce completamente su prevalencia en los lechones a las 3 y 9 semanas de vida (gráfica) desplazando la infección por la reducción de la presión de infección en todo el sistema.
Estos hechos deberían hacernos considerar la inestabilidad a circovirus en madres como motivo de empeoramiento de resultados productivos en transición y cebo.
Como consecuencia incluir en los programas sanitarios vacunales de los hatos reproductores la vacunación rutinaria frente a PCV2 de las cerdas, tendría su sentido epidemiológico dando lugar a la producción de lechones no infectados en el momento de la vacunación y por tanto obteniendo la mayor eficacia de cada dosis aplicada en los mismos.
Por otro lado, cuando acontece una infección temprana de algunos lechones procedentes de una población de madres inestable a este virus inmunosupresor, estamos en un escenario perfecto para el desarrollo de una infección subclínica. En dicha situación, la vacunación adelantada de los lechones con productos registrados para ello y sin perjuicio de la inmunidad maternal, resulta ser de gran ayuda. Todo ello mientras conseguimos la estabilidad de la granja de madres que es realmente la raíz del problema y no tanto el momento de vacunación.
El conocimiento de la evolución de la dinámica de infección de los patógenos en general y de PCV2 en este caso concreto, es crucial para nuestra praxis veterinaria cotidiana.
Es solo bajo un enfoque epidemiológico de la enfermedad (cadena de infección-cadena de prevención) a nivel poblacional, que seremos capaces de corregir los caprichosos, y en ocasiones sutiles, cambios en el patrón de transmisión del virus. Este mecanismo no es más que una forma de adaptarse a las nuevas situaciones epidemiológicas.
El diseño de nuevas estrategias de diagnóstico y vacunación debe suscitar un ejercicio de reflexión con el fin de reducir todavía más si cabe el impacto del virus sobre la población, sobre todo en la manifestación subclínica de la enfermedad.
Bibliografía
Dee S, 1996. Swine Health Prod. 147-149.
Díaz et al, 2011. Proc. 6th ISERPD Page 149. P 068.
Fangman T et al. (2014). Proc. 23rd IPVS. P 110.
Feng et al., 2014 Veterinary Microbiology Vol.172 Issues 1–2, 6 August 2014, Pages 92–99
Madec et al, en 2008. Transbound Emerging Disease 55, 273-283.
Madson, D. , Opriessnig, T. 2011. Proc. AASV Annual Meeting, 427-432.
Madson et al 2011. Anim Health Res Rev. 2011 Jun;12(1):47-65.
Mc Cullough et al, 2008. Swine Pract. Al Leman Conf 60-68.
Mc Intosh et al, 2008 Can. Vet. J., 49:1189-1194.
Navas et al., 2016 ESPHM-IPVS in press.
Opriessnig et al. J. Comp. Path. 2006, Vol. 134, 105–110
Opriessnig, www.3tres3.com 2 1mayo 2012.
Opriessnig et al. 2007. J Vet Diagn Invest. 19(6):591-615
Payne et al. 2013, Proc. 5th ESPHM P194.
Seate J, ISERD 2015. P122
Segalés, Virus Research 164 (2012) 10-19.
SPC CircoFLEX®. www.ema.europa.eu/docs/en_GB/…/ WC500062388.pdf
Viñeta J., 2015 ESPHM Proc. P161
Suscribete ahora a la revista técnica porcina
AUTORES

Estrategias clave frente a resistencias antimicrobianas en granjas porcinas
María Jesús Serrano Andrés
Primer informe español ESUAvet del sector porcino: Ventas y uso de antimicrobianos para medicina veterinaria en 2023
Alejandro Platt Orzáez Carmen Pastor Alcaide Cristina Muñoz Madero
Actinobacillus pleuropneumoniae serotipo 9/11, ¿son realmente el mismo serotipo?
Ana Belén Fernández Ros José Luis Arnal Bernal
Monitorización del impacto de la vacunación frente a Mycoplasma hyopneumoniae sobre los parámetros productivos
David Espigares Laura Garza Mónica Sagrera Paloma Sánchez
El viaje metabólico del fósforo en el cerdo
Alberto Morillo Alujas
Optimización de la vitalidad porcina: conexión con la riboflavina (Vitamina B2)

Del estro al aborto: anatomía de un fallo reproductivo
Ronaldo Gottardo
El papel del calostro en la supervivencia y el crecimiento de los lechones

Capacitación de equipos como motor de la productividad porcina
Laura Batista
Manejo de fase 3 y gestión de cargas en cebaderos
Anabel Fernández Bravo Andrea Martínez Martínez Ángela Gallardo Marín Elena Goyena Salgado Emilio José Ruiz Fernández José Manuel Pinto Carrasco Manuel Toledo Castillo Rocío García Espejo Simón García Legaz
Instalaciones eficientes para hacer frente al calor en granjas porcinas
Stefano Benni