Actualmente, los reportes indican una falta de consistencia en la relación entre signos clínicos y la presencia de PCV3.
El PCV3 fue descubierto en 2017 y, desde entonces, se ha aislado en muestras de tejido porcino en Estados Unidos y Europa. Este artículo expone dos casos clínicos en España




Actualmente, los reportes indican una falta de consistencia en la relación entre signos clínicos y la presencia de PCV3.
Caso clínico 1
El primer caso aparece en una granja con producción en tres sitios, donde la fase 2 está aislada de la fase 1 y de la fase 3, con destetes semanales de lechones en buenas condiciones corporales, que han sido vacunados con una vacuna bivalente de circovirus y Mycoplasma hyopneumoniae (Suvaxyn® Circo+MH RTU).

El diagnóstico clínico es compatible con una infección vírica, por lo que se hace diagnóstico laboratorial de virus PRRS y PCV2 mediante ELISA y PCR en suero. Los resultados indican que ninguno de los dos virus está involucrado en el proceso (tabla 1).
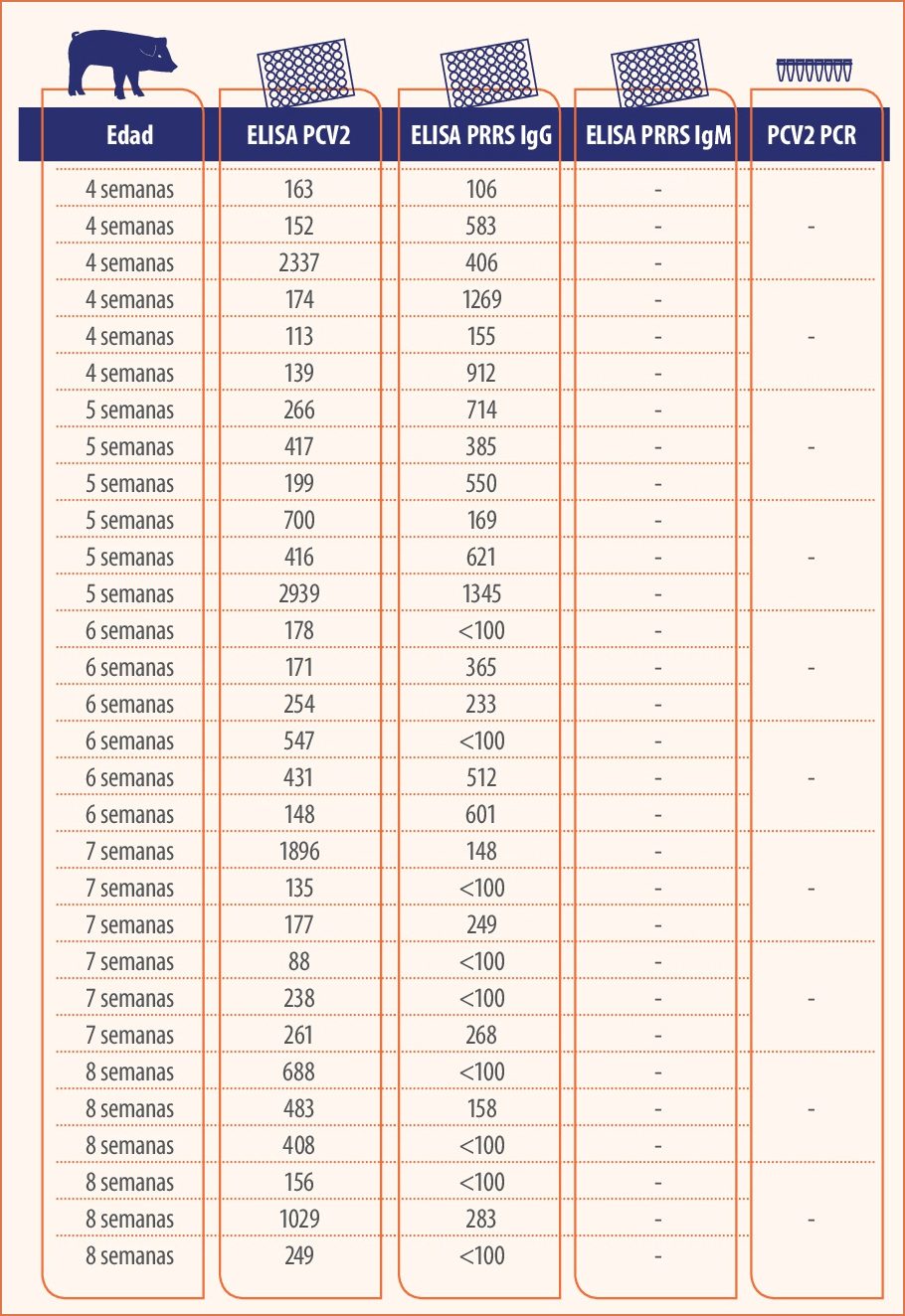
Tabla 1. Diagnóstico de PCV2 y PRRS en lechones posdestete en suero.
El examen histopatológico de lechones al destete indica linfopenia en bazo y linfonodos con necrosis de tejido linfoide y cariorrexis en placas de Peyer acompañada de gastritis hemorrágica. Los lechones de transición tienen las mismas lesiones en placas de Peyer y estómago, pero añaden neumonía catarral intersticial grave con infiltración neutrofílica y exudado purulento.
Posteriormente, se completa el estudio de diagnóstico a partir de varias muestras de líquido pericárdico, ya que se encontraba en cantidad aumentada, aunque no se acompañaba de la fibrina típica de poliserositis. Este líquido pericárdico es una muestra adecuada para la detección de las bacterias asociadas a la poliserositis, pero también es útil para la detección de virus como el PRRS o el circovirus. El resultado del diagnóstico corrobora el resultado en suero, con resultado negativo para PRRS y PCV2, pero aparece positividad frente a PCV3 (tabla 2).

Tabla 2. Detección de antígenos en nueve muestras de líquido pericárdico.
Por último, se detectó el virus Influenza en los lechones cuando se decidió hacer una despoblación de la transición, tras la que desaparecieron los procesos clínicos y la pérdida de condición corporal.
Caso clínico 2
El segundo caso clínico se da en una granja con las fases 1 y 2 en un sitio y separadas del sitio 3. Los lechones se vacunan con una vacuna bivalente de circovirus y Mycoplasma hyopneumoniae (Suvaxyn® Circo+MH RTU).

Como en el caso anterior, se hace diagnóstico sobre suero. Aparecen seroconversión a influenza por ELISA y niveles variables de viremia de circovirus por PCR. Debido a esto, se hace diagnóstico anatomopatológico sobre varios nódulos inguinales que indica una depleción linfocitaria leve o nula e inmunoperoxidasa negativa para PRRS y circovirus, pero aparece un incremento del grosor de los tabiques interalveolares pulmonares debido al acúmulo de células inflamatorias mononucleares.


Tabla 3. Detección de antígenos en nueve muestras de líquido pericárdico.
El proceso clínico desaparece tras haber afectado a varias semanas de producción.
Conclusiones


Leer más sobre Zoetis.
Referencias
1. Allan, G. et al. Discovery and evolving history of two genetically related but phenotypically different viruses, porcine circoviruses 1 and 2. Virus Research, 2012, 164(1-2): p.4-9.
2. Allan, G.M., et al. Experimental reproduction of severe wasting disease by co-infection of pigs with porcine circovirus and porcine parvovirus. J Comp Pathol, 1999. 121(1): p.1-11
3. Palinski R. et al. A novel porcine Circovirus distantly related to known Circoviruses is associated with Porcine Dermatitis and Nephropathy Syndrome and Reproductive Failure. J Virol, 2017. 91(1).
4. Piñeiro P. et al. Porcine circovirus 3: A new member of the PCVAD complex? National Hog Farmer Jul 2018.
5. Ye X. et al. Detection and genetic characterization of porcine circovirus 3 from pigs in Sweden. Virus Genes, 2018.
6. Franzo G et al. Full-genome sequencing of porcine circovirus 3 field strains from Denmark, Italy and Spain demonstrates a high within-Europe genetic heterogeneity. Transbound Emerg Dis, 2018.
7. Tochetto C. et al. Full genome sequence of Porcine Circovirus type 3 recovered from serum of sows with stillbirths in Brazil. Transbound Emerg Dis, 2017.
8. Stadejek T. et al. First detection of detection of porcine circovirus type 3 on commercial pig farms in Poland. Transboundary and Emerging Diseases, 2017. 64(5): p.1350-1353.
9. Faccini S. et al. Detection and genetic characterization of Porcine circovirus type 3 in Italy. Transbound Emerg Dis, 2017. 64(6): p.1661-1664
10. Klaumann F. et al. Retrospective detection of Porcine circovirus 3 (PCV-3) in pig serum samples from Spain. Transboundary and Emerging Diseases. 0(0)
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez