
La leptospirosis porcina es una enfermedad poco diagnosticada en granjas de cerdos, en parte porque hacerlo presenta cierta dificultad, pero sobre todo porque su expresión clínica es a menudo muy baja, tanto en el número de casos como en el problema que crean.





Ha sido hace unos años, desde que el alojamiento de las cerdas en grupo se ha generalizado, que se han descrito más casos de lo habitual. Las gestaciones en grupo hacen que la epidemiología de las enfermedades cambie.
No estoy tan de acuerdo con algunas opiniones que lo achacan a la reducción del uso de antibióticos, argumento que se usa también para explicar otras patologías.

Resulta fácil su diagnóstico cuando entra en contacto la Leptospira con poblaciones vírgenes o cuando aparece un serovar no adaptado.
Suelen ser problemas puntuales ya que se crea una fuerte inmunidad y suele responder bien a los tratamientos, aunque estos deben ser largos.

Es el tratamiento con tetraciclinas, como la oxitetraciclina, o la estreptomicina* lo que acaba con el cuadro de abortos y momificados.
En estos brotes, un tratamiento eficaz sería usar doxiciclina a 10 mg/kg PV/día durante 15 días en agua de bebida, para continuar con 20 mg/kg/ PV/día de oxitetraciclina en pienso, a modo de ejemplo, aunque hay otras posibilidades lógicamente.
*Tratamiento recomendado con estreptomicina:
Inyección de 25 mg/kg de estreptomicina en una sola dosis o con tratamientos de 3-5 días para prevenir abortos y el estado de portador. Además, la aplicación del tratamiento 1 semana antes de la cubrición y 2 tras el parto ha demostrado ser eficaz para minimizar las pérdidas reproductivas.

Conviene hacer diagnóstico diferencial con Chlamydias (Suis y abortus) aunque estas últimas, cuando causan abortos, no lo hacen como agente primario.
Como técnica indirecta la más empleada y eficaz es la aglutinación microscópica (MAT), donde en este tipo de brotes encontraremos bastantes sueros con títulos superiores a 1/800 del serovar causante o de más de uno, ya sea adaptado o no (Bratislava e Icterohaemorrhagie son los más habituales).
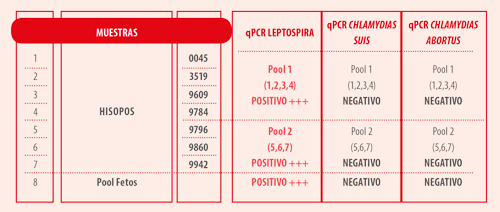
Cuadro 1: Alta carga genética en la qPCR en cerdas abortadas a término.
El tratamiento con tetraciclinas o estreptomicina es muy eficaz una vez instaurada la infección, siendo la vacunación de toda la granja primero, y posteriormente a la reposición, una medida complementaria útil para prevenir las reinfecciones una vez controlado el brote.
Hasta que no se haya establecido un buen nivel de protección, es esencial medicar con antibióticos a toda la explotación.
La mayor dificultad en su diagnóstico es cuando afecta en el momento de la cubrición en granjas con infecciones endémicas.
La mayoría de las infecciones por leptospiras son subclínicas. Suelen ser serotipos adaptados y no aparece ninguna sintomatología, pero pueden verse afectados algunos parámetros como una ligera bajada de la fertilidad o un número bajo de nacidos vivos por un aumento de camadas cortas (litter scatter).

Fotografía 1: Mayor número de camadas pequeñas en infecciones subclínicas
Los títulos de anticuerpos frente a Leptospira que podemos encontrar en los sueros de estas cerdas con pocos nacidos vivos pueden ser nulos o muy bajos (1/40, 1/50), por lo que descartar esta causa es una tarea difícil.
El uso de antibióticos es eficaz, siempre que se haga de forma responsable, basándose en un diagnóstico certero y eligiendo el antibiótico ideal a la dosis adecuada, prescrita por el veterinario. Adicionalmente, se recomienda vacunar al hato reproductor y monitorizar evolución del patógeno en la explotación.
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez