Recordemos que la supervivencia de esta bacteria en agua sin tratar puede ser de hasta 22 días a 25°C.
La bioseguridad es esencial para evitar la propagación de la leptospirosis en las explotaciones porcinas. ¿Cuáles son las principales medidas que debemos tener en cuenta a la hora de proteger a nuestros animales?

Cuando planteamos un protocolo de bioseguridad en una explotación porcina, debemos tener en cuenta a qué serovares nos enfrentamos y cuya entrada queremos evitar. A continuación veremos cuales son las principales medidas que debemos tener en cuenta a la hora de proteger a nuestros animales.
EVITAR LA ENTRADA DE SEROVARES ACCIDENTALES A LA EXPLOTACIÓN
1.- Tratamiento e higienización del agua de bebida
Las leptospiras sobreviven en un pH neutro o ligeramente alcalino (prácticamente lo son todas las aguas). Sin embargo, no soportan pH inferior a 6 ni superior a 8.
Recordemos que la supervivencia de esta bacteria en agua sin tratar puede ser de hasta 22 días a 25°C.
Por ello, los higienizantes más comunes y la acidificación del agua son armas eficaces para la eliminación de la bacteria.
2.- Control de roedores

Los ratones son reservorio de serovar ballum, menos común en nuestro país, pero no de L. icterohaemorrhagiae (de mayor importancia).
3.- Limpieza y desinfección
 Es crucial realizar una limpieza y desinfección esmerada de todos los compartimentos de las explotaciones, teniendo en cuenta que la desecación, la luz del sol, los desinfectantes y los detergentes habituales eliminan la bacteria.
Es crucial realizar una limpieza y desinfección esmerada de todos los compartimentos de las explotaciones, teniendo en cuenta que la desecación, la luz del sol, los desinfectantes y los detergentes habituales eliminan la bacteria.
4.- Restricción del acceso de otras especies

Recordemos que los jabalíes suelen ser portadores de la serovares pertenecientes al serogrupo Pomona.
5.- Higiene durante el transporte


EVITAR LA ENTRADA DE SEROVARES ADAPTADOS
Evitar la entrada de serovares adaptados (Bratislava, Pomona, Muenchen y Tarassovi) es más complicado de lograr.
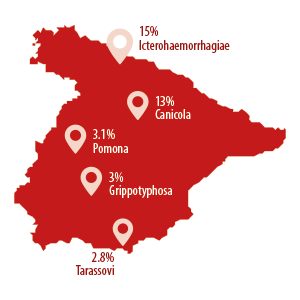
Para hacernos una idea, según datos de Francisco Javier García Peña del Laboratorio Central de Algete, la seroprevalencia de Bratislava en España es de un 86%, coincidiendo el 85% detectado por otros autores (Aguarón y Farré, 2015).
Siguiendo a mucha distancia se encuentran Icterohaemorrhagiae (15%), Canicola (13%), Pomona (3.1%), Grippotyphosa (3%) y Tarassovi (2.8%).
Puede haber explotaciones en las que convivan varios serovares a la vez y, además, siempre chequeamos explotaciones con algún tipo de problema reproductivo, por lo que las prevalencias podrían estar falsamente elevadas.
 Cabe resaltar que el serovar Muenchen aparece cada vez más en las analíticas, bien porque antes no se analizaba o bien porque últimamente se ha extendido más en las explotaciones.
Cabe resaltar que el serovar Muenchen aparece cada vez más en las analíticas, bien porque antes no se analizaba o bien porque últimamente se ha extendido más en las explotaciones.
Además las medidas ya citadas para los serovariedades accidentales, en el caso de las serovariedades adaptadas, es importante controlar las siguientes posibles vías de entrada a la explotación:
1.- Reservorios animales

El serovar Pomona, que puede producir leptospiruria hasta durante 2 años, tiene como hospedador reservorio al ciervo.
Por otro lado, los équidos son reservorio del serovar Bratislava genotipo B1, mientras que los perros, équidos y erizos son portadores del serovar Bratislava genotipo B2a.
2.- Transmisión lactogénica
Las hembras infectadas pueden eliminar leptospiras a través de la leche (Guijarro y Calvo, 1999), pudiendo encontrarse los serovares Pomona y Hardjo asociados a la mastitis clínica.
3.- Transmisión venérea
HEMBRAS
Según algunos autores como Javier García Peña, hay cepas de Bratislava que pueden persistir en el aparato genital de la hembra abortada hasta 150 días.
 A la hora de llevar a cabo la inseminación, es crucial extremar la higiene ya que la bacteria puede estar presente en el tracto reproductivo y podemos extenderla de una cerda a otra.
A la hora de llevar a cabo la inseminación, es crucial extremar la higiene ya que la bacteria puede estar presente en el tracto reproductivo y podemos extenderla de una cerda a otra.
VERRACOS
Los verracos pueden eliminar la bacteria intermitentemente a través del semen durante varios meses. Por tanto hay que evitar montas naturales con machos recelas en explotaciones positivas.
![]() En estos machos, una medida eficaz podría ser tratarlos con Estreptomicina (25mg/kg) cada 2 meses, ya que es el tratamiento de elección.
En estos machos, una medida eficaz podría ser tratarlos con Estreptomicina (25mg/kg) cada 2 meses, ya que es el tratamiento de elección.
SEMEN
La transmisión a través del semen podría explicar la alta prevalencia de Bratislava y Muenchen.
 Si bien no se conocen estudios de presencia en semen de porcino, los estudios realizados con semen de bovino sin tratar con antibióticos revelan que la bacteria puede persistir hasta 58 días a 2ºC. Sin embargo, al añadir Penicilina-Estreptomicina se lograba reducir esta persistencia a la mitad (29 días).
Si bien no se conocen estudios de presencia en semen de porcino, los estudios realizados con semen de bovino sin tratar con antibióticos revelan que la bacteria puede persistir hasta 58 días a 2ºC. Sin embargo, al añadir Penicilina-Estreptomicina se lograba reducir esta persistencia a la mitad (29 días).
4. Transmisión transplacentaria
 Se ha descrito el nacimiento de camadas infectadas de madres que han tenido leptospiremia sin que hayan abortado (Amatredjo y Campbell, 1975), así como la infección en el momento del nacimiento al pasar por el canal del parto.
Se ha descrito el nacimiento de camadas infectadas de madres que han tenido leptospiremia sin que hayan abortado (Amatredjo y Campbell, 1975), así como la infección en el momento del nacimiento al pasar por el canal del parto.
En este punto, se deben implementar una estrictas medidas de higiene durante la manipulación de partos asistidos manualmente.
5.- Reposición
 Los animales de reposición siempre se han considerado un factor de riesgo, aunque suelen dar negativo a nivel serológico.
Los animales de reposición siempre se han considerado un factor de riesgo, aunque suelen dar negativo a nivel serológico.
Este fenómeno se podría explicar por el hecho de que, aunque los centros de multiplicadores fueran seropositivos, los animales destinados a vida llevan varios tratamientos antibióticos para otras enfermedades a lo largo de su vida que consiguen eliminar la bacteria.
No obstante, siempre existe la posibilidad de un contagio en los cebos destinados a vida.
 Hay que tener en cuenta que en los serovares adaptados los animales pueden ser serológicamente negativos y ser portadores/eliminadores.
Hay que tener en cuenta que en los serovares adaptados los animales pueden ser serológicamente negativos y ser portadores/eliminadores.
Por ello, algunos autores recomiendan tratamientos con Estreptomicina a razón de 25 mg/kg en entradas de cuarentenas y repetición a los 15 días de estancia, tanto de cerdas como verracos de reposición.
 Esta medida es fundamental si la granja de destino es seronegativa, pero si se trata de explotaciones seropositivas la medida es menos eficaz, ya que una vez dentro de la explotación su contagio es más que probable, aunque tendría sentido para evitar la entrada de nuevos serovares.
Esta medida es fundamental si la granja de destino es seronegativa, pero si se trata de explotaciones seropositivas la medida es menos eficaz, ya que una vez dentro de la explotación su contagio es más que probable, aunque tendría sentido para evitar la entrada de nuevos serovares.

La leptospirosis es una enfermedad muy compleja debido a la cantidad de especies animales, serovares, vías de contagio y las características inherentes a la bacteria.
![]() Los veterinarios del sector se encuentran, a menudo, que a la hora de realizar un diagnóstico y seguimiento epidemiológico en las explotaciones, no hay pruebas serológicas rutinarias como las disponibles para otras enfermedades.
Los veterinarios del sector se encuentran, a menudo, que a la hora de realizar un diagnóstico y seguimiento epidemiológico en las explotaciones, no hay pruebas serológicas rutinarias como las disponibles para otras enfermedades.
Al tratarse de una enfermedad complicada, se tiende a dejarla “aparcada” y a no darle la importancia que realmente tiene en las explotaciones. Quizá sean necesarias mejores herramientas y medios de diagnóstico, control y divulgación.
Suscribete ahora a la revista técnica porcina
AUTORES
Cómo cuidar la salud respiratoria de los cerdos: medidas clave
Alejandro Cid González Ana I. Pastor Calonge César B. Gutiérrez Martín Mario Delgado García Óscar Mencía-Ares Sonia Martínez Martínez
2026: consolidar fortalezas para avanzar con firmeza

Respuesta de emergencia en accidentes con transporte porcino: la experiencia danesa
Cecilie Kobek-Kjeldager Kirstin Dahl-Pedersen Mette S. Herskin
Microbiota intestinal en el cerdo: de la taxonomía a la función en producción porcina
Eduard de la Torre Candán
Energía neta y crecimiento porcino: claves para una mejor predicción
Gabriela Martínez
La apuesta ganadora de Porgaor, Grupo LANKA: el sistema de alimentación individualizada en maternidades, Materneo de Asserva

El arte de alimentar a cerdas reproductoras: inteligencia artificial al servicio de la nutrición y productividad
Gustavo Márquez Esteban Pablo Fuentes Pardo Sara Crespo Vicente
Lechones más fuertes y numerosos al destete

Estrategia nutricional active feeding en lechones destetados PRRS positivos
Alberto Morillo Alujas
MASTERFLY® BAIT: control eficaz y duradero de moscas

El destete como punto clave de la productividad: puntos críticos a tener en cuenta
Anabel Fernández Bravo Andrea Martínez Martínez Elena Goyena Salgado Emilio José Ruiz Fernández Francisco Frances Diaz José Manuel Pinto Carrasco Manuel Toledo Castillo Simón García Legaz
Medidas para el control de la cepa Rosalía de PRRS

Gestionar la incertidumbre cuando el miedo entra en la granja
Laura Pérez Sala
Bioseguridad y control: estrategias para afrontar el PRRS y PPA en un escenario de riesgo

Bioseguridad aplicada frente a Peste Porcina Africana: protocolos clave en granja, logística y control externo
David García Páez